瑞舒伐他汀改善缺氧/复氧引起的脑微血管内皮细胞损伤的作用*
王圆圆, 白 雅, 马晨超, 郭 超, 秦 娜, 魏 东
(空军军医大学第一附属医院西京医院, 西安 陕西 710032)
缺血再灌注损伤所致的血脑屏障完整性受损可引发继发性的脑损伤,如明显的脑水肿,甚至梗死后出血转化等[1]。防止和减轻血脑屏障的完整性破坏是缓解脑梗死损伤的重要治疗靶点之一[2]。血脑屏障(blood-brain barrier,BBB)主要由内皮细胞、周细胞、胶质细胞终足以及基底膜等结构组成,其中脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)及其紧密连接是外周血液与脑组织间的第一道屏障,对微血管血脑屏障的通透性变化起主要作用[3]。近年来,作为临床二级预防的调脂药物他汀,其非调脂作用(包括抗氧化损伤和抗炎等方面)备受关注,其中,2013年及2015年关于他汀药物对缺血再灌注相应的临床试验研究,如静脉溶栓急性期他汀类药物对卒中患者预后的THRaST研究(Thrombolysis and Statins Study)均提示他汀有改善症状性出血的作用,但具体机制尚不明确[4-5]。目前BMECs体外培养模型已经被广泛应用于BBB的研究[6]。因此,本研究采用氧糖剥夺(oxygen-glucose deprivation,OGD)再复氧(reoxygenation,R)的BMECs体外培养模型为研究对象,探讨瑞舒伐他汀(rosuvastatin,Ros)对BMECs体外缺氧/复氧损伤的影响以推测缺血再灌注损伤的发病机制。
材 料 和 方 法
1 材料
瑞舒伐他汀、DNA酶Ⅰ和Ⅱ型胶原酶购自上海西格玛公司(纯度>99.8%);胎牛血清(fetal bovine serum,FBS)、DMEM高糖培养基、羊血清封闭液和胰酶均购自GIBCO;内皮细胞生长因子和ECM细胞培养基购自ScienCell;噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、Western blot制胶套装及BCA蛋白定量试剂盒购自碧云天生物技术公司;超敏发光液购自Millipore;兔抗小鼠CD34(血管内皮标记蛋白)、兔抗小鼠基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、兔抗小鼠β-肌动蛋白(β-actin)、兔抗小鼠磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)、兔抗小鼠磷酸化核因子κB(phosphorylated nuclear factor kappa B,p-NF-κB)、兔抗小鼠磷酸化P38丝裂原活化蛋白激酶(p-P38)及兔抗小鼠cleaved caspase-3抗体均购自Cell signaling technology;兔抗小鼠MMP2及辣根过氧化物酶标记的羊抗兔抗体均购自Abcam; 荧光染料羧基荧光素二乙酸酯琥珀酰亚胺脂(carboxyfluorescein diacetate succinimidyl ester,CFDA-SE)购自赛默飞世尔科技(中国)有限公司。
2 主要方法
2.1小鼠BMECs原代分离及鉴定 BALB/c小鼠购自北京维通利华实验动物技术有限公司,雌性雄性均可,体重7~9 g,颈椎脱臼处死后消毒,取出全脑及分离脑皮层置于DMEM高糖完全培养液,使用眼科剪剪成1 mm×1 mm×1 mm大小,加入0.1% Ⅱ型胶原酶(含20 μmol/L DNA酶I)37 ℃水浴孵育0.5 h。离心后去上清液,加入20% BSA悬浮混匀后离心,去除中上层神经组织及大血管,加入0.1%胰酶37 ℃水浴消化0.5 h,离心,去上清液,加入20%新生牛血清悬浮混匀后离心,吸出白黄色的层面即为纯化的微血管段,加入DMEM培养基离心漂洗2次后去上清,加入内皮细胞完全培养基(20% FBS,内皮生长因子,1 g/L肝素钠,1×105U/L青霉素,100 mg/L链霉素,2 mmol/L L-谷氨酰胺)悬浮后接种于事先涂布明胶的10 cm一次性塑料培养皿,置于37 ℃、5% CO2培养箱内静置培养,12~24 h后换液,随后隔天换液。7~9 d时细胞可达到单层融合,用0.25%胰酶消化传代,采用分次收集消化液,只收集前5 min消化脱落的细胞进行培养。免疫荧光细胞化学法鉴定,荧光显微镜下观察BMECs的CD34表达。
2.2体外缺氧/复氧模型的建立及实验分组 采用OGD/R的方法模拟体外BMECs的缺氧再灌注损伤,即取3~4代生长良好的BMECs用含有0.02% EDTA的0.25%胰酶消化,以每孔5×104个细胞接种于培养板,培养至完全汇合生长后,更换无糖的Hanks 平衡盐溶液,放入含95% N2和5% CO2的 37 ℃培养箱中培养3 h或6 h;复氧复糖时,更换内皮细胞完全培养基置于37 ℃,5% CO2培养箱中培养24 h。对照组更换无血清内皮细胞培养基,置于37 ℃,5% CO2培养箱中培养;他汀组于缺氧前24 h加入瑞舒伐他汀(用生理盐水配制成100 mmol/L浓度的母液,使用时用完全培养基稀释至相应浓度)。同时倒置相差显微镜下观察各组细胞形态变化。
2.3MTT法检测细胞活力 取200 μL BMECs悬液以每孔1×104的密度接种于96孔板,培养至完全汇合生长后,随机分组并按要求实施缺氧复氧处理后,弃上清,每孔加约20 μL MTT溶液(5 g/L,完全配液基配制)继续孵育1 h,终止培养,小心吸孔内培养上清液,每孔加入150 μL DMSO后,震荡5 min,使结晶充分溶解,设置加入等体积培养基、不同浓度瑞舒伐他汀和MTT溶液,但没有加入细胞的孔作为空白组。酶标仪在波长490 nm测定吸光度(A)值,每孔重复3次。细胞活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.4CFDA-SE细胞增殖检测 CFDA-SE广泛用于细胞追踪和细胞增殖研究。CFDA-SE 很容易穿过完整的细胞膜,进入细胞后,细胞内酯酶会切断乙酸基,产生发荧光的羧基荧光素琥珀酰亚胺酯(CFSE)。用DMSO溶解成5 mmol/L的CFDA-SE储存液,于-20 ℃避光保存。使用时,用氧糖剥夺培养液或完全培养基稀释成5 μmol/L的工作液培养细胞后,并在488 nm的激发光下检测细胞形态改变,统计细胞数目。
2.5免疫荧光染色检测CD34阳性细胞及cleaved caspase-3的水平 制备各组细胞爬片,4%多聚甲醛固定,正常羊血清封闭,室温孵育,依次加兔抗小鼠CD34多克隆抗体(1∶100)和兔抗小鼠cleaved caspase-3多克隆抗体(1∶100),4 ℃冰箱孵育过夜,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗兔II抗(1∶50)于37 ℃孵育1 h。用4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)进行胞核复染15 min,甘油封片。设置阴性对照:磷酸缓冲盐溶液(phosphate-buffered saline,PBS)代替 I 抗,其余步骤同上。染色后荧光显微镜观察,每组细胞随机观察6个视野,ImageJ图像处理软件作荧光强度分析,结果以平均吸光度值表示,其中cleaved caspase-3水平越高则平均吸光度值越大。
2.6Western blot实验 经过处理后的各组细胞,弃去上清液, 用预冷的0.01 mol/L PBS清洗2次,加入细胞裂解液,冰面上裂解30 min,12 000×g,4 ℃离心10 min,取上清,通过蛋白定量试剂盒进行蛋白定量。以10% SDS-PAGE分离, 半干电转移法转移至PVDF膜,室温下用封闭液封闭PVDF膜1 h后,分别加入相应I抗检测MMP2、MMP9、Bcl-2、Bax、p-P38、p-NF-κB及p-JNK蛋白水平(1∶1 000稀释),于4 ℃ 孵育过夜,分别用相应的抗兔或鼠 II 抗(1∶5 000稀释)室温孵育2 h,通过发光液发光显色,成像仪获取图像。β-actin作为内参照。实验重复3次。
3 统计学分析
结果以均数±标准误 (mean±SEM)表示,以SPSS 17.0软件行统计学处理,对各组数据进行方差齐性检验,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 BMECs鉴定及各组形态学变化
免疫荧光细胞化学法检测CD34(绿色荧光)表达阳性的细胞占所有细胞约90%以上,即为BMECs,见图1A。
光镜下观察BMECs形态,对照组可见短梭形、多角形细胞,融合后呈紧密连接的铺路石样单层生长,见图1Ba;与对照组比较,OGD 3 h/R 24 h)和OGD 6 h/R 24 h组的细胞可见不同程度脱落,未脱落细胞变圆回缩,细胞间间隙增大,见图1Bb、g;经1 μmol/L、5 μmol/L、10 μmol/L及20 μmol/L瑞舒伐他汀预处理[7],OGD 3 h/R 24 h组及OGD 6 h/R 24 h组的细胞形态均有不同程度改善,即细胞基本呈短梭形或多角形,融合的细胞呈紧密连接的铺路石样生长,见图1Bc~f、h~k。
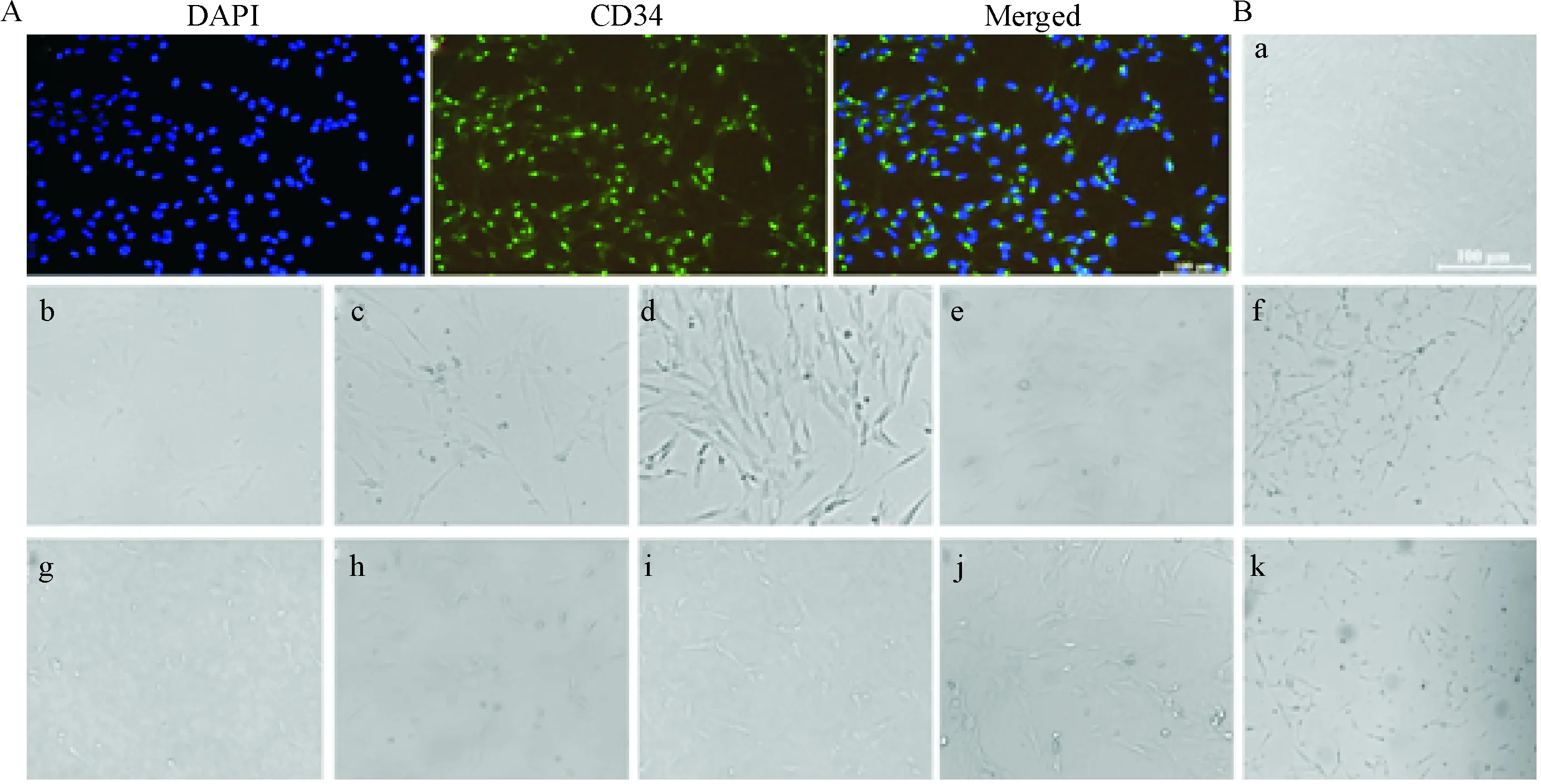
Figure 1.Identification of BMECs and observation of their morphological changes (scale bar=100 μm). A: CD34 positive cells were examined using immunofluorescence staining; B: bright-field images of BMECs. a: control group; b: OGD 3 h/reoxygenation 24 h group; c~f: 1 μmol/L (c), 5 μmol/L (d), 10 μmol/L (e) and 20 μmol/L (f) rosuvastatin pretreatment and OGD 3 h/reoxygenation 24 h groups; g: OGD 6 h/reoxygenation 24 h group; h~k: 1 μmol/L (h), 5 μmol/L (i), 10 μmol/L (j) and 20 μmol/L (k) rosuvastatin pretreatment and OGD 6 h/reoxygenation 24 h groups.
图1BMECs鉴定及各组形态学变化
2 各组细胞活力的比较
OGD 3 h/R 24 h组和OGD 6 h/R 24 h组的细胞活力分别为(81.0±2.3)%和(66.8±6.5)%,瑞舒伐他汀预保护处理组,自1 μmol/L至10 μmol/L瑞舒伐他汀对BMECs活力的改善作用呈现浓度依赖性,其中,10 μmol/L瑞舒伐他汀可显著改善OGD 3 h/R 24 h组和OGD 6 h/R 24 h组的细胞活力(P<0.05)。见图2。
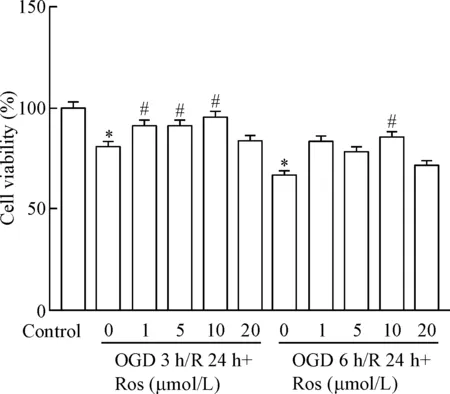
Figure 2.The effects of rosuvastatin (Ros) on the viability of BMECs treated with OGD/ R were analyzed via MTT assay. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vs0 μmol/L Ros group.
图2MTT实验检测BMECs细胞活力
CFDA-SE细胞增殖检测发现,正常情况下,细胞不会出现皱缩,培养24 h后的细胞数量较检测前的增加至(104.7±14.4)%;OGD 3 h/R 24 h组和OGD 6 h/R 24 h组的细胞出现不同程度的皱缩或脱落,复氧24 h后细胞百分数(复氧24 h细胞百分数与OGD后复氧前细胞百分数比值)显著降低;10 μmol/L瑞舒伐他汀可显著缩短细胞皱缩或脱落的程度,复氧24 h后细胞百分数均明显增加(P<0.05),见图3。
3 瑞舒伐他汀对缺氧/复氧诱导的BMECs凋亡有改善作用
荧光显微镜检测各区域内细胞情况,通过DAPI荧光判断细胞核位置及细胞数,比较cleaved caspase-3红色免疫荧光凋亡颗粒,与对照组相比,OGD 3 h/R 24 h组和OGD 6 h/R 24 h组可见红色免疫荧光阳性颗粒数上升;在加入瑞舒伐他汀干预各组,凋亡颗粒数均较OGD 3 h/R 24 h组和OGD 6 h/R 24 h组显著降低(P<0.05),见图4。Western blot实验结果显示,缺氧/复氧损伤引起BMECs的Bcl-2/Bax表达较正常组减少,经瑞舒伐他汀处理的BMECs 组,Bcl-2/Bax升高(P<0.05),见图5。提示瑞舒伐他汀通过抑制cleaved caspase-3,并上调Bcl-2/Bax,从而降低BMECs凋亡。
4 瑞舒伐他汀对缺氧/复氧诱导的BMECs中MMP2和MMP9蛋白表达的影响
与对照组相比, OGD 3 h/R 24 h组和OGD 6 h/R 24 h组的MMP-9表达均显著增加(P<0.05);与缺氧/复氧组相比较,10 μmol/l瑞舒伐他汀预处理可显著降低MMP-9的表达水平,但与对照组相比差异无统计学显著性;同时,缺氧/复氧后,与对照组相比,MMP2的表达量明显上升(P<0.05),而10 μmol/L瑞舒伐他汀预处理可显著降低MMP2的表达水平(P<0.05),见图6。
5 瑞舒伐他汀对缺氧/复氧诱导的BMECs中p-NF-κB、p-P38和p-JNK蛋白水平的影响
与对照组比较,缺氧/复氧均出现p-NF-κB上调,10 μmol/L瑞舒伐他汀干预可使p-NF-κB的蛋白水平显著下降(P<0.05)。除此以外,P38和JNK信号通路也参与调节MMP2和MMP9的表达,与正常组相比,OGD 3 h/R 24 h组和OGD 6 h/R 24 h组p-P38和p-JNK的蛋白水平均上升;而与缺氧/复氧组相比,使用瑞舒伐他汀预处理后,p-P38和p-JNK的蛋白水平降低(P<0.05),见图7。说明瑞舒伐他汀能够降低P38 MAPK、JNK和NF-κB信号通路中关键蛋白P38、JNK、NF-κB蛋白磷酸化的水平,从而抑制缺氧/复氧下BMECs的MMP9和MMP2表达水平。
讨 论
脑梗死是危害中老年人身体健康的主要杀手[8]。目前针对脑梗死最有效的治疗手段是时间窗(脑梗死发生3 h或6 h)内进行血管再通治疗[9-10],但是血流再灌注的同时,常伴随一种棘手的副反应为再灌注损伤[11]。再灌注损伤能够引起BBB损害,脑水肿甚至神经元丢失等[12]。这也是目前临床上影响脑梗死患者治疗效果的关键因素。如果能在再灌注损伤发生前使用药物维护BBB的结构及功能,无疑能增加血管再通治疗的安全性,从而促进有效治疗方案的实施。大量已证实研究他汀类药物在降低血低密度脂蛋白外,还有一系列非调脂性脑缺血保护效应,如抗炎和保护海马神经元损伤等作用,临床上被广泛应用于缺血性脑血管疾病的预防及治疗[13-14]。但临床目前使用的瑞舒伐他汀在缺血再灌注情况下对BBB主要结构成分内皮细胞的作用及机制尚不明确。
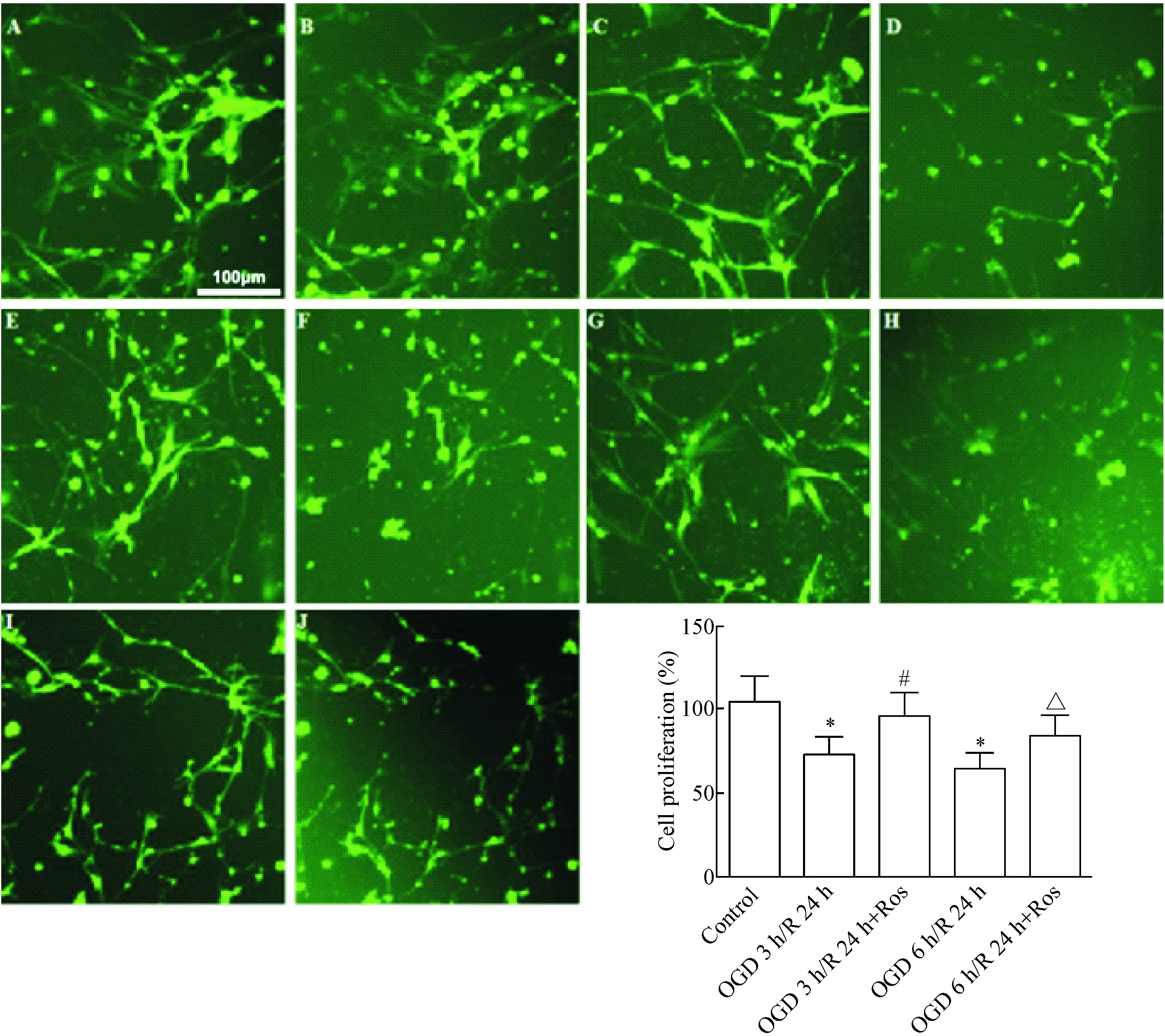
Figure 3.Analysis of BMEC proliferation via CFDA-SE staining. A: control group; B: BMECs were cultured for 24 h; C: OGD 3 h group; D: OGD 3 h/R 24 h group; E: pretreatment with rosuvastatin (Ros) in OGD 3 h group; F: pretreatment with rosuvastatin in OGD 3 h/R 24 h (OGD 3 h/R 24 h+Ros) group; G: OGD 6 h group; H: OGD 6 h/R 24 h group; I: pretreatment with rosuvastatin in OGD 6 h group; J: pretreatment with rosuvastatin in OGD 6 h/R 24 h (OGD 6 h/R24 h+Ros). The results were presented as ratio from CFSE positive cells compared with OGD-treated cells. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsOGD 3 h/R 24 h group;△P<0.05vsOGD 6 h/R 24 h group.
图3CFDA-SE染色检测BMECs增殖
执行BBB结构功能的最主要成分是BMECs,本研究通过缺氧/复氧处理BMECs模拟体内BBB内皮缺血再灌注损伤损伤,从而探讨瑞舒伐他汀对BBB内皮缺血再灌注损伤的作用及机制,结果发现10 μmol/L瑞舒伐他汀能提高不同损伤程度缺血/复氧损伤所抑制的BMECs存活率及增殖活性[7]。近年研究证实,基质金属蛋白酶受缺氧及复氧刺激后,MMPs活性明显上调,参与BBB紧密连接的降解的病理生理过程,是影响BBB通透性和细胞存活的重要机制之一[15-16],主要的是缺血再灌注损伤可诱发MMP2及MMP9的高表达,通过降解脑血管基底膜的主要成分及BBB内紧密连接,造成BBB细胞皱缩死亡,引起血液成分外渗,继而出现再灌注后血管源性脑水肿[17];另外,缺血再灌注损伤可以诱导白细胞介素1、白细胞介素6、肿瘤坏死因子α、表皮生长因子、血小板衍化生长因子、成纤维细胞生长因子和转化生长因子β的表达,从而在转录、酶原活化和蛋白水解酶活方面影响MMP2和MMP9的生物活性[18-19]。我们的实验发现缺氧/复氧损伤后MMP2及MMP9的表达明显上升,10 μmol/L瑞舒伐他汀可通过降低MMP2及MMP9表达维持BMEC的完整性,同时也降低由于MMP2及MMP9引起的细胞凋亡。有报道提示,内皮凋亡的发生与线粒体功能障碍相关,缺血再灌注损伤后线粒体肿胀,并导致线粒体膜破裂,最终导致细胞凋亡[20]。本研究结果表明,缺氧/复氧损伤发生后,线粒体抗凋亡相关蛋白Bcl2与凋亡相关蛋白Bax的比例下调,证实线粒体功能下降,同时caspase3活化增加,而瑞舒伐他汀可上调Bcl2/Bax比值并降低cleaved caspase-3的蛋白水平,从而说明瑞舒伐他汀克改善线粒体功能,减轻缺血再灌注损伤引起的凋亡增加的现象。
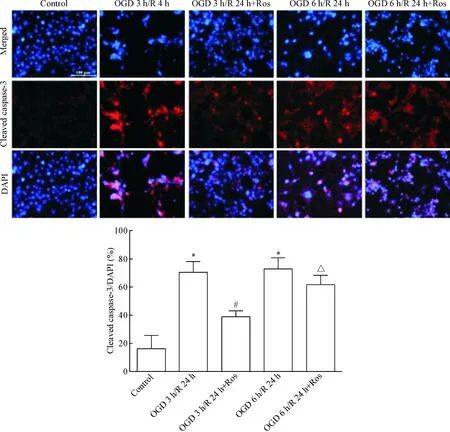
Figure 4.The protein levels of cleaved caspase-3 in BMECs detected by immunofluorescence staining (scale bar=100 μm). Cleaved caspase-3 was examined using fluorescently labeled antibodies against cleaved-caspase 3 (red) . Nuclei were stained with DAPI (blue). The results were presented as ratio from cleaved-caspase3 positive cells compared with DAPI positive cells. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsOGD 3 h/R 24 h group;△P<0.05vsOGD 6 h/R 24 h group.
图4免疫荧光染色检测瑞舒伐他汀对缺氧/复氧诱导的BMECs凋亡相关蛋白cleavedcaspase-3的水平
既往文献亦报道证实丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)在缺血再灌注损伤后可激活P38和JNK磷酸化,参与内皮损伤的病理生理过程并参与细胞凋亡发生,MAPK激活可促进MMP9的活化和炎症因子表达[21]。另外,MMP9基因启动子序列670~599段可受NF-κB p65结合位点识别,引起核内移,伴随后者磷酸化增加,诱导MMP9基因转录起始,炎症因子在NF-κB磷酸化反应后释放增加,从而进一步募集外周血的中性粒细胞聚集BBB的内皮表面,造成MMP9和MMP2的大量释放,加深对BBB的损害,进一步导致管腔破坏,脑水肿发生,神经元坏死等[22]。本研究的结果表明,缺氧/复氧损伤发生后,瑞舒伐他汀可抑制P38、JNK以及NF-κB信号通路的关键蛋白激活。
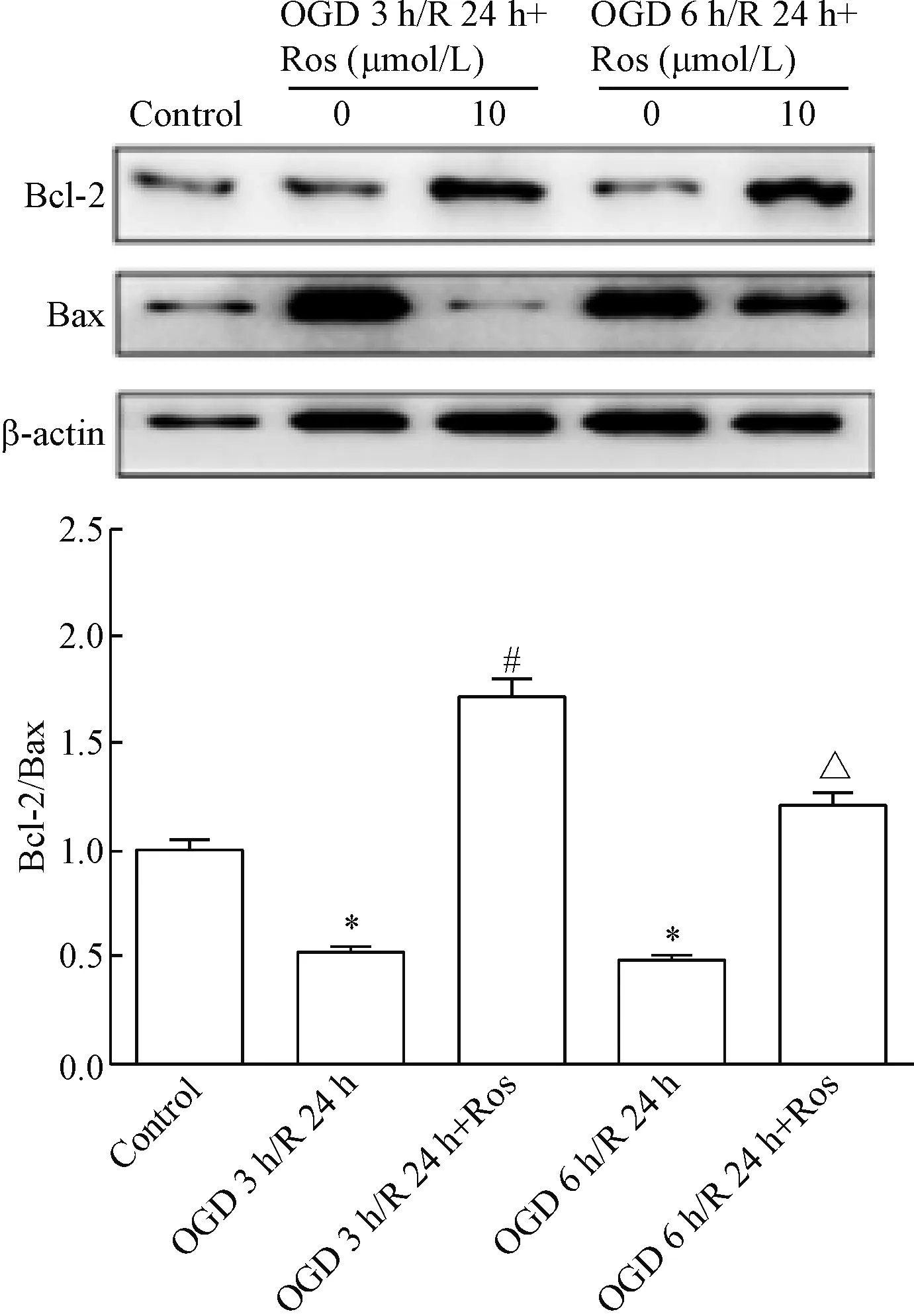
Figure 5.Western blot analysis was used to determine the expression of Bcl-2/Bax. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsOGD 3 h/R 24 h group;△P<0.05vsOGD 6 h/R 24 h group.
图5Westernblot检测Bcl-2/Bax表达水平
本研究仍有一定的局限,BBB的通透性常与紧密连接蛋白及钙黏连蛋白相关,本研究针对瑞舒伐他汀对BBB的紧密连接是否有保护作用有待进一步研究。
总之,本研究揭示瑞舒伐他汀可抑制氧糖剥夺/复氧诱导的BMECs再灌注损伤中相关p38、JNK以及NF-κB信号通路的激活,从而减少MMP2及MMP9活化,使之与MMP2和MMP9相关的细胞凋亡减少。这将为瑞舒伐他汀在BBB通透性和出血转化损伤中的改善作用提供机制说明,为更好的应用该药物提供理论支持。
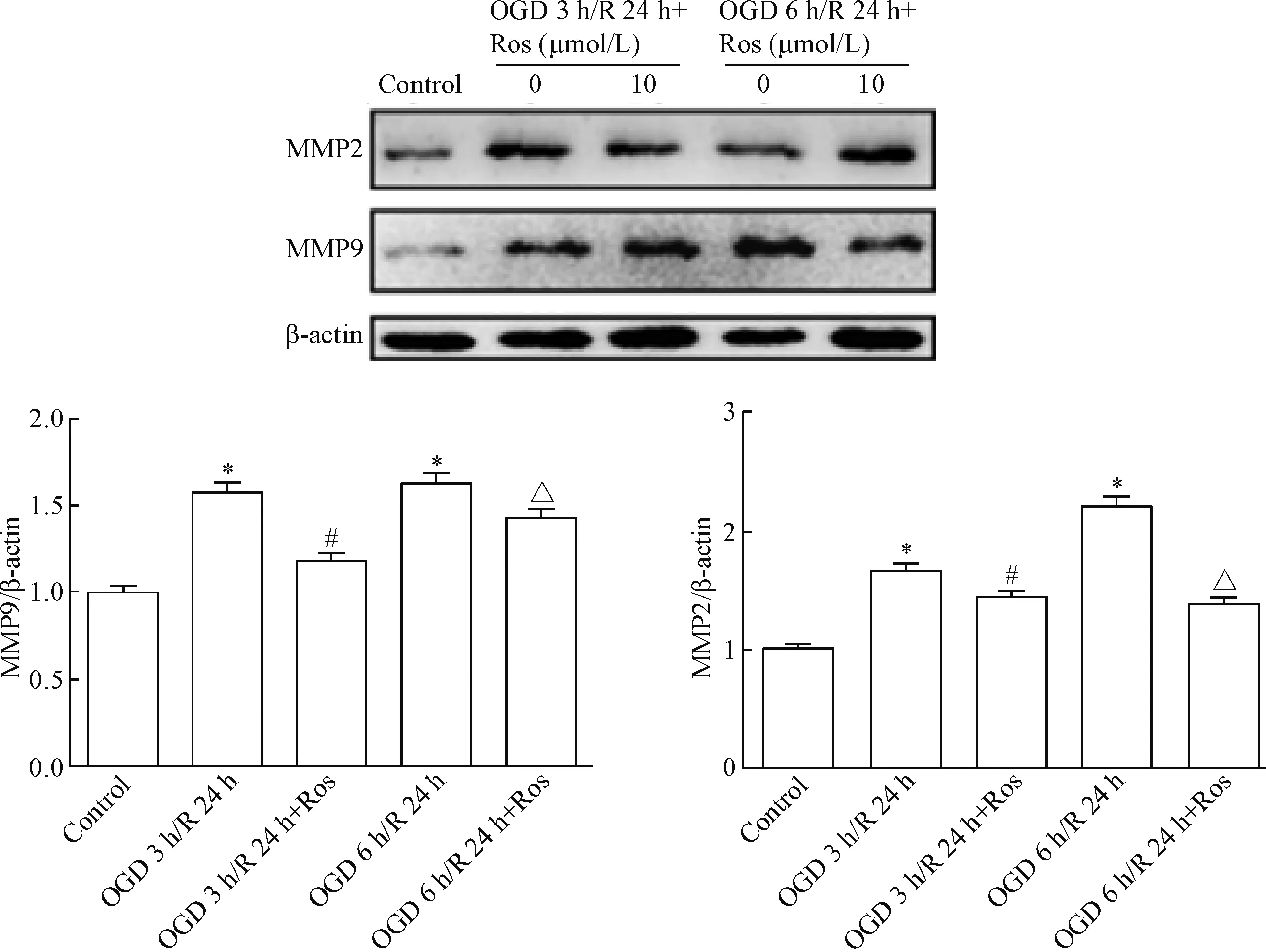
Figure 6.The protein levels of MMP2 and MMP9 were determined by Western blot. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsOGD 3 h/R 24 h group;△P<0.05vsOGD 6 h/R 24 h group.
图6Westernblot检测MMP2和MMP9的蛋白水平
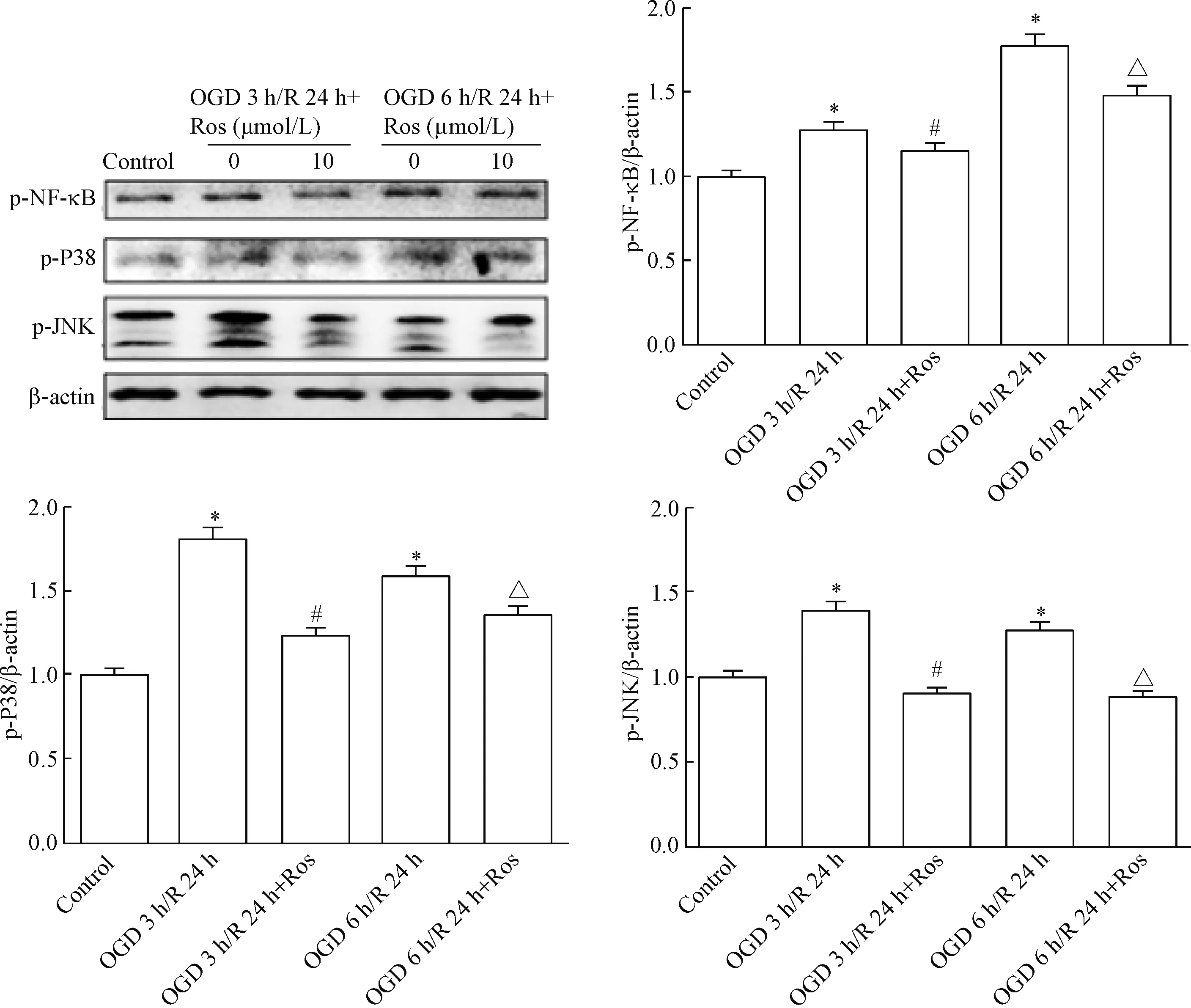
Figure 7.Western blot analysis was used to determine the protein levels of p-NF-κB, p-P38 and p-JNK. Mean±SEM.n=6.*P<0.05vscontrol group;#P<0.05vsOGD 3 h/R 24 h group;△P<0.05vsOGD 6 h/R 24 h group.
图7Westernblot检测pNF-κB、p-P38及p-JNK的蛋白水平

