二硫苏糖醇通过激活calpain-2/caspase-12信号通路诱导BRL-3A细胞凋亡*
罗 轩, 韩 冰, 田 甜, 余 蕾, 郑 璐, 汤 雷, 杨 婷, 杨 勤, 谢汝佳△, 黄建钊
(1贵州医科大学, 贵州 贵阳 550025; 2贵州医科大学附属人民医院, 贵州 贵阳 550002)
内质网是细胞内重要的细胞器,其主要的生理作用是对细胞内合成的蛋白质进行修饰和折叠,从而使之形成正确的构象。此外,内质网还参与类固醇激素的合成、脂质代谢以及Ca2+的储存[1]。内质网应激(endoplasmic reticulum stress,ERS)是指在有害因素的刺激下引起内质网的生理功能发生紊乱,从而导致大量错误折叠或未折叠的蛋白质在内质网腔内聚集的一种亚细胞器的病理过程[2]。通过ERS可使错误折叠或未折叠的蛋白质恢复正确的构象,因此适度的ERS是细胞进行自我保护的一种重要机制[3],但是过度的ERS也会对细胞造成不可逆的损伤甚至促进细胞凋亡的发生[4]。目前越来越多的研究发现,许多肝脏疾病,如非酒精性脂肪肝、酒精性肝病、病毒性肝炎及肝纤维化均与ERS引起的细胞凋亡有关[5-7]。因此,深入研究ERS介导细胞凋亡的分子机制可以为临床上各种肝脏疾病的防治提供新的思路和方法。钙蛋白酶2 (calpain-2)是一种钙离子依赖性的高度保守的蛋白水解酶。近年来有研究发现,calpain-2可能通过激活特异定位于内质网表面的caspase-12,启动ERS介导的细胞凋亡过程,从而加重组织细胞的损伤[8]。本研究拟用ERS诱导剂二硫苏糖醇(dithiothreitol,DTT)诱导体外培养的大鼠正常肝细胞株BRL-3A发生ERS,观察在ERS状态下肝细胞内calpain-2及ERS介导凋亡过程中关键信号分子caspase-12的表达变化,并探讨它们在ERS介导细胞凋亡过程中的作用。
材 料 和 方 法
1 材料
大鼠正常肝细胞株BRL-3A购自中国科学院典型培养物保藏中心昆明细胞库(编号为KCB92013YJ);DMEM、胎牛血清和0.25% 胰酶购自GIBCO;DTT、MTT和二甲基亚砜购自Genview;Triton X-100购自Amresco;抗兔DyLight 549及抗兔Alexa Fluor 488荧光 II 抗、免疫染色固定液、洗涤液、封闭液、 I 抗稀释液、Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒及蛋白定量试剂盒均购自南京碧云天生物技术研究所;抗calpain-2、cleaved caspase-12及cleaved caspase-3抗体购自Cell Signaling Technology;抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)抗体购自Abcam;抗caspase-12和caspase-3抗体购自北京博奥森生物技术有限公司;TRIzol由Invitrogen提供;SYBR Green购自大连宝生物工程有限公司;逆转录试剂盒购自Fermentas;增强化学发光试剂盒及聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜购自Millipore; β-actin、calpain-2、caspase-12、caspase-3及GRP78引物购自上海捷瑞生物工程有限公司。
2 方法
2.1细胞培养及传代 BRL-3A细胞用含10%胎牛血清和1%青、链霉素的DEME培养液于37 ℃、5% CO2培养箱中培养,普通倒置显微镜观察细胞生长状态,每隔2~3 d进行换液,待细胞生长至80%~90% 融合状态时用0.25% 胰酶消化进行传代培养。
2.2MTT法筛选DTT的合适药物浓度 用0.25% 胰蛋白酶消化并收集处于对数生长期的BRL-3A细胞,细胞计数后调整细胞悬液浓度至5×108/L,在96孔细胞培养板中每孔加入100 μL的细胞悬液,待细胞单层铺满孔底后,分别加入终浓度为0.5、1.0、2.0、2.5、4.0和6.0 mmol/L的DTT。同时设置正常对照孔(不加DTT处理)和空白调零孔(加DTT不加细胞),上述每组均设5个复孔。37 ℃,5% CO2培养箱中继续孵育24 h。每孔加入20 μL MTT溶液(5 g/L),继续培养4 h。从培养箱中取出96孔细胞培养板,小心吸去孔内培养液,每孔加入150 μL 二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在全波长酶标仪490 nm处测量各孔的吸光度(A)值。
2.3DTT处理体外培养的BRL-3A细胞 根据MTT实验结果,给予终浓度为2.5 mmol/L的DTT处理细胞,处理时间为12 h和24 h,同时设置不加DTT处理的细胞为正常对照(control)组。
2.4Real-time PCR检测calpain-2、caspase-12、caspase-3及GRP78的mRNA水平 用0.25% 胰蛋白酶消化并收集各实验组细胞,向细胞沉淀中加入1.0 mL TRIzol提取肝细胞总RNA。严格按照Fermentas逆转录试剂盒说明书将总RNA逆转录合成cDNA,随后以DNA为模板进行real-time PCR,反应体系配制及反应条件严格按照说明书执行。以β-actin为内参照,2-ΔΔCt法[9]计算calpain-2、caspase-12、caspase-3和GRP78的mRNA相对表达量。引物序列见表1。

表1 Real-time PCR实验引物序列
2.5细胞免疫荧光检测calpain-2、GRP78、caspase-12及caspase-3的蛋白表达 经DTT处理后的细胞小心吸去培养液,每孔加入1.0 mL 免疫染色固定液室温固定15 min;弃固定液,每孔加入1.0 mL 免疫染色洗涤液,摇床上漂洗3次,每次5 min,然后加入免疫染色封闭液于摇床上封闭1 h,弃封闭液后加入 I 抗[GRP78(1∶100)、calpain-2(1∶100)、caspase-12(1∶200)和caspase-3(1∶100)]进行孵育,于摇床上 4 ℃振摇过夜;次日弃去 I 抗,用免疫染色洗涤液漂洗3次,每次5 min,加入荧光染料标记的 II 抗(1∶1 000),室温避光孵育 1 h,免疫染色洗涤液避光漂洗3次,每次5 min,将抗荧光淬灭封片剂滴加于载玻片上,将细胞爬片从培养板内取出,将细胞面贴于封片剂上,荧光倒置显微镜下观察并拍照。应用Image-Pro Plus图像分析软件对每个视野下荧光强度计算平均灰度值(总灰度值/灰度区域)。
2.6Western blot检测cleaved caspase-12及cleaved caspase-3的蛋白表达 在各组细胞中加入0.5 mL细胞裂解液裂解细胞,将收集的细胞裂解液12 000 r/min离心20 min,收集上清并检测蛋白浓度。将各组蛋白进行SDS-PAGE,电泳后经转膜、封闭,随后加入cleaved caspase-12(1∶1 000)及cleaved caspase-3(1∶800)I 抗孵育过夜。次日,用洗膜缓冲液洗膜3次,每次5 min,然后加入II 抗(1∶1 000)室温孵育2 h,洗膜缓冲液充分洗膜后加入增强化学发光试剂进行成像。采用Image Lab图像分析软件对条带灰度值进行半定量分析。
2.7N-琥珀酰基-亮氨酰-酪氨酰-7-胺基-4-甲基香豆素(N-Suc-Leu-Tyr-7-amido-4-methylcoumarin,N-Suc-Leu-Tyr-AMC)底物法测定calpain-2活性 取含80 μg总蛋白的肝细胞匀浆液,加入1.0 mL反应缓冲液(145 mmol/L NaCl、100 mmol/L Tris-HCl,pH 7.3),37 ℃水浴箱中振荡10 min,加入150 μL 的500 μmol/L 的N-Suc-Leu-Tyr-AMC,37 ℃水浴箱中振荡60 min,在荧光分光光度计上测定荧光强度(激发波长360 nm,发射波长440 nm),以N-Suc-Leu-Tyr-AMC与肝细胞匀浆反应释放出AMC的荧光强度来代表不同样品中calpain-2的活性。
2.8流式细胞术检测细胞凋亡 DTT处理细胞的方法同前。用0.25% 胰蛋白酶消化细胞,适时终止消化并收集各实验组细胞。用10 mL 磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤细胞2次,1 000 r/min离心5 min,弃PBS。加入195 μL Annexin V-FITC结合液重悬细胞沉淀,然后加入5 μL Annexin V-FITC染料,轻轻混匀,室温避光孵育10 min。1 000 r/min离心5 min,弃上清液。加入190 μL Annexin V-FITC结合液重悬细胞沉淀,加入10 μL碘化丙啶(propidium iodide,PI)染料,轻轻混匀,上流式细胞仪进行检测。
3 统计学处理
所有数据均用SPSS 19.0统计软件分析,计量资料以均数±标准差(mean±SD)表示。多组数据的差异采用单因素方差分析(one-way ANOVA),两两比较采用LSD法进行。以P<0.05表示差异有统计学意义。
结 果
1 MTT法测定不同浓度DTT处理BRL-3A细胞后细胞的存活率
不同浓度DTT处理BRL-3A细胞24 h后,经MTT法测定各组细胞的存活率发现,DTT抑制BRL-3A细胞存活的50%抑制浓度(IC50)为4.0 mmol/L。为了降低DTT对BRL-3A细胞的毒性作用,在后续实验中,选用接近2/3 IC50的浓度即2.5 mmol/L作为DTT的最佳作用浓度。不同浓度DTT处理BRL-3A细胞后细胞存活率的变化见图1。
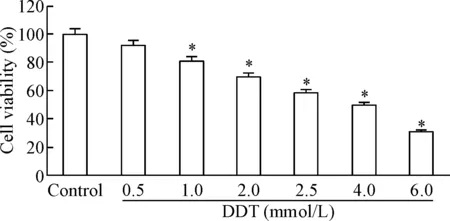
Figure 1.The viability of BRL-3A cells treated with DTT at different concentrations was measured by MTT assay. Mean±SD.n=5.*P<0.01vscontrol group.
图1MTT法测定不同浓度DTT处理BRL-3A细胞后细胞的存活率
2 Real-time PCR 检测DTT处理BRL-3A细胞后GRP78、calpain-2、caspase-12及caspase-3的mRNA水平
Real-time PCR结果显示,BRL-3A细胞经DTT处理12 h及24 h后,GRP78、calpain-2及caspase-12的mRNA表达较正常对照组显著升高(P<0.01),而caspase-3的mRNA水平与正常对照组比较无显著变化,见图2。
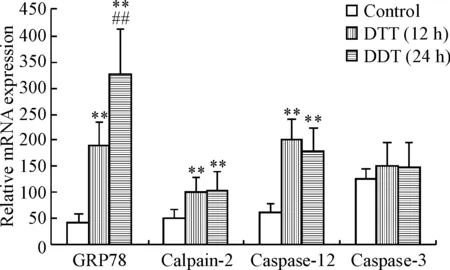
Figure 2.The mRNA expression of GRP78, calpain-2, caspase-12 and caspase-3 in the BRL-3A cells treated with DTT. Mean±SD.n=5.**P<0.01vscontrol group;##P<0.01vsDTT (12 h) group.
图2DTT处理BRL-3A细胞后GRP78、calpain-2、caspase-12及caspase-3的mRNA表达变化
3 细胞免疫荧光法检测DTT处理BRL-3A细胞后GRP78、calpain-2、caspase-12及caspase-3的蛋白表达
细胞免疫荧光检测发现GRP78、calpain-2、caspase-12及caspase-3蛋白主要分布于细胞胞浆内。BRL-3A细胞经DTT处理12 h及24 h后,胞浆中GRP78、calpain-2、caspase-12及caspase-3蛋白水平较正常对照组显著升高(P<0.01),见图3。
4 Western blot检测DTT处理BRL-3A细胞后cleaved caspase-12及cleaved caspase-3的蛋白表达
Western blot结果显示,BRL-3A细胞经DTT处理12 h及24 h后,细胞中cleaved caspase-12及cleaved caspase-3蛋白较正常对照组明显增多(P<0.01),见图4。
5 N-Suc-Leu-Tyr-AMC底物法检测DTT处理BRL-3A细胞后calpain-2活性的变化
经DTT处理12 h及24 h后,BRL-3A细胞中calpain-2的活性较正常对照组显著增高(P<0.01),见图5。
6 流式细胞术检测细胞凋亡的变化
正常对照组仅有少量细胞发生凋亡;经DTT处理12 h后,细胞凋亡率较正常对照组显著增加;DTT处理细胞24 h后,细胞凋亡率进一步增高(P<0.01),见图6。
讨 论
细胞凋亡是受细胞外微环境和细胞内基因调控的一种细胞主动性死亡方式,许多生理及病理因素都可以诱导肝细胞发生凋亡[10-13]。肝细胞凋亡是一柄双刃剑,一方面与肝脏的生理活动密切相关,通过肝细胞凋亡可调节肝组织正常的细胞更新、增殖以及再生,而另一方面,如果肝细胞过度凋亡也可导致肝脏的损伤和肝脏疾病的发生。例如病毒性肝炎、自身免疫性肝炎以及肝纤维化等多种肝病都表现为大量肝细胞凋亡,从而影响肝脏的功能,加速病情的恶化。因此,深入了解肝细胞凋亡的发生机制可为临床上防治各种肝脏疾病提供新的思路和方法。
内质网是细胞内重要的细胞器,参与蛋白质的合成、修饰、折叠以及维持细胞内Ca2+稳定,在内膜系统中占有中心地位[14]。凡是能引起内质网摄取、释放Ca2+障碍或蛋白质加工、运输障碍的因素均能导致ERS的发生。GRP78属于热休克蛋白(heat shock protein,HSP)70 家族,是细胞内重要的分子伴侣,其主要作用是促进未折叠/错误折叠蛋白进行正确折叠。ERS时由于大量未折叠/错误折叠蛋白在内质网腔中堆积,GRP78表达上调有助于蛋白质的正确折叠,恢复内质网的正常功能,从而促进细胞的存活。因此,GRP78可作为ERS的标志蛋白[15]。本次研究采用DTT(一种可影响蛋白质翻译后修饰的物质)诱导体外培养的大鼠正常肝细胞BRL-3A发生ERS反应,经real-time PCR和细胞免疫荧光检测GRP78的表达发现,随着DTT刺激时间的延长,细胞内GRP78在mRNA及蛋白水平的表达逐渐增高,提示采用2.5 mmol/L的DTT诱导BRL-3A细胞发生ERS是成功的。
ERS的程度及持续时间决定了应激细胞的结局。一定程度的ERS能激活细胞的保护机制,例如增加内质网分子伴侣表达及减少蛋白质合成来改善细胞的状态,发挥保护细胞的作用;相反,当应激原强度超过细胞自身处理能力时,保护机制不能与损伤抗衡,ERS则可通过启动细胞凋亡途径来清除受损的细胞[16-17]。Caspase-12作为内质网外膜上的促凋亡分子,是ERS介导细胞凋亡的特异性启动蛋白酶之一,其活化是ERS介导凋亡的中心环节[18]。研究发现,敲除caspase-12基因的细胞虽然仍对其它各种凋亡诱导因素敏感,但对ERS诱导的凋亡可产生耐受[19],说明caspase-12信号通路是ERS介导细胞凋亡的特有信号通路之一。本次研究发现,给予2.5mmol/L DTT处理BRL-3A细胞后,细胞中caspase-12的mRNA及活性caspase-12蛋白的水平均较正常对照组显著增加,说明在内质网应激状态下,不仅caspase-12的mRNA水平上调且蛋白质活性也是增加的。本研究还观察了caspase-12下游促凋亡蛋白caspase-3的表达变化,结果发现DTT处理细胞后caspase-3的mRNA水平未发生显著变化,但活性caspase-3蛋白较正常对照组显著增加,提示内质网应激不能上调caspase-3 mRNA水平,但可增加其蛋白活性,这可能与caspase-12活化后进一步激活其下游的caspase-3有关。采用流式细胞术对细胞凋亡的检测发现,随着DTT刺激时间的延长,细胞凋亡率逐步增加。上述结果表明DTT处理BRL-3A细胞后可通过激活caspase-12/caspase-3信号通路促进细胞凋亡的发生。但关于caspase-12/caspase-3信号通路是如何激活的,目前尚不清楚,推测可能与calpain-2有关。
Figure 3.The immunofluorescence observation for the protein levels of GRP78, calpain-2, caspase-12 and caspase-3 in the BRL-3A cells treated with DTT (×200). Mean±SD.n=3.**P<0.01vscontrol group.
图3细胞免疫荧光显示DTT处理BRL-3A细胞后GRP78、calpain-2、caspase-12及caspase-3蛋白水平的比较
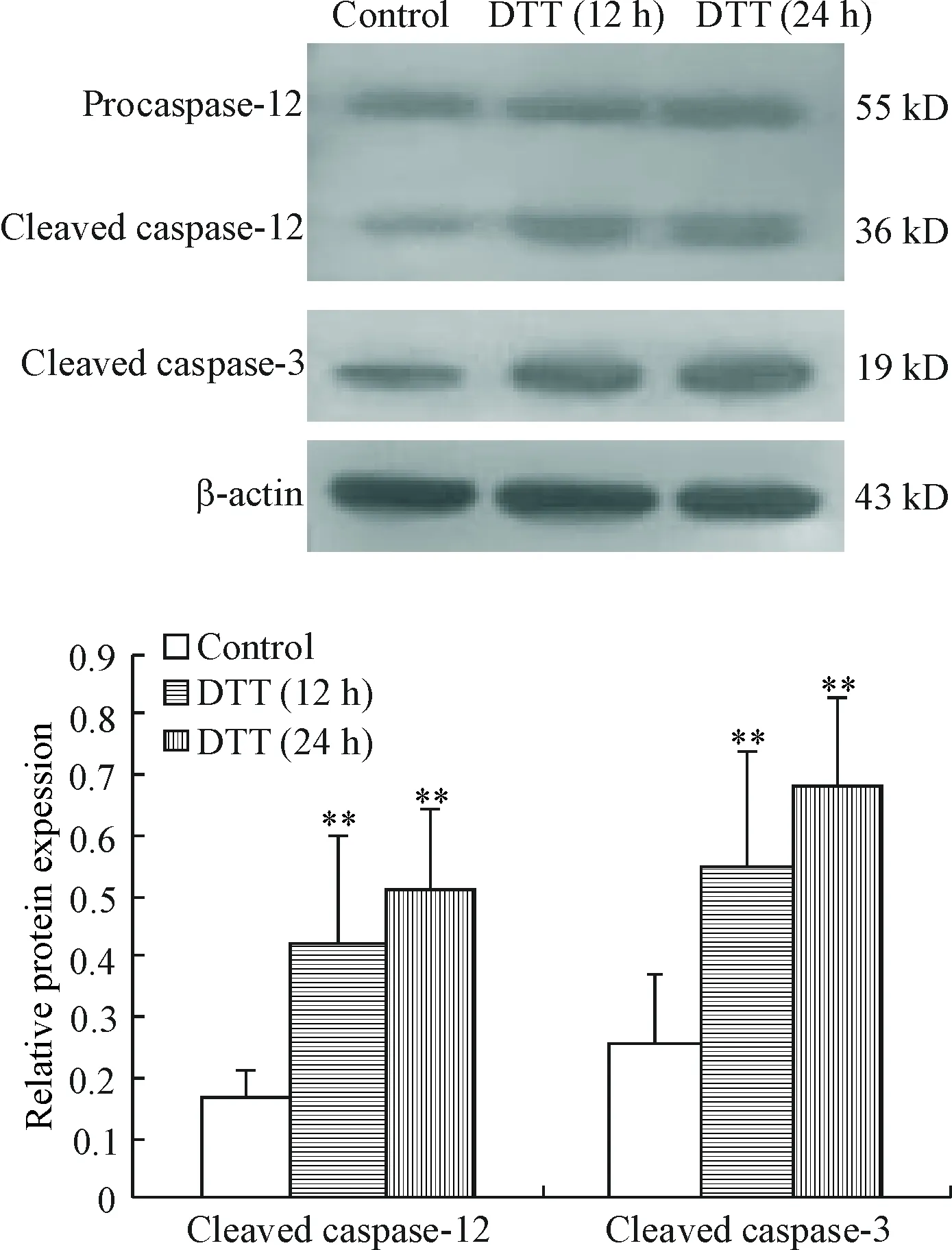
Figure 4.The protein levels of cleaved caspase-12 and cleaved caspase-3 in the BRL-3A cells treated with DTT. Mean±SD.n=3.*P<0.01vscontrol group.
图4DTT处理BRL-3A细胞后cleavedcaspase-12及cleavedcaspase-3的蛋白表达水平
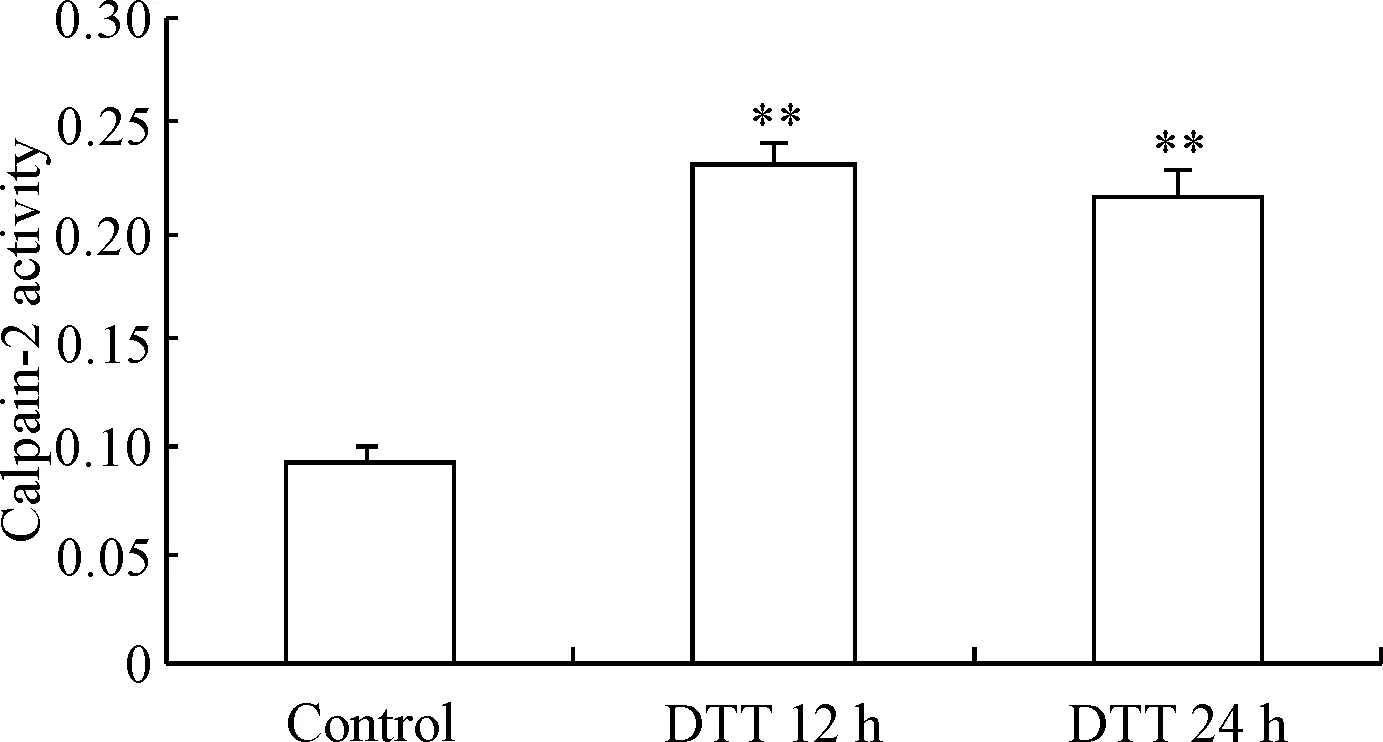
Figure 5.The change of calpain-2 activity in BRL-3A cells treated with DTT. Mean±SD.n=3.*P<0.01vscontrol group.
图5DTT处理BRL-3A细胞后calpain-2活性变化
Calpain-2是钙离子依赖性的蛋白水解酶[20],近年来有研究发现,calpain-2可能通过激活特异定位于内质网表面的caspase-12,启动ERS介导的细胞凋亡过程,从而加重组织细胞的损伤[21]。本次研究结果发现,DTT处理BRL-3A细胞后,细胞中calpain-2的mRNA及蛋白的表达较正常对照组显著增加。进一步对calpain-2的活性进行检测发现,经DTT处理后BRL-3A细胞中calpain-2的活性较正常对照组显著增加。由于calpain-2是细胞内的一种蛋白水解酶,其活性增加可导致多种底物蛋白的水解,这其中可能也包括对caspase-12的水解和激活。有研究发现ERS时calpain-2可移位到内质网,并对位于内质网上的caspase-12进行水解,从而激活caspase-12[8]。上述结果提示ERS状态下calpain-2表达上调及活性增加可能通过激活ERS凋亡通路中关键信号分子caspase-12从而介导细胞凋亡过程。
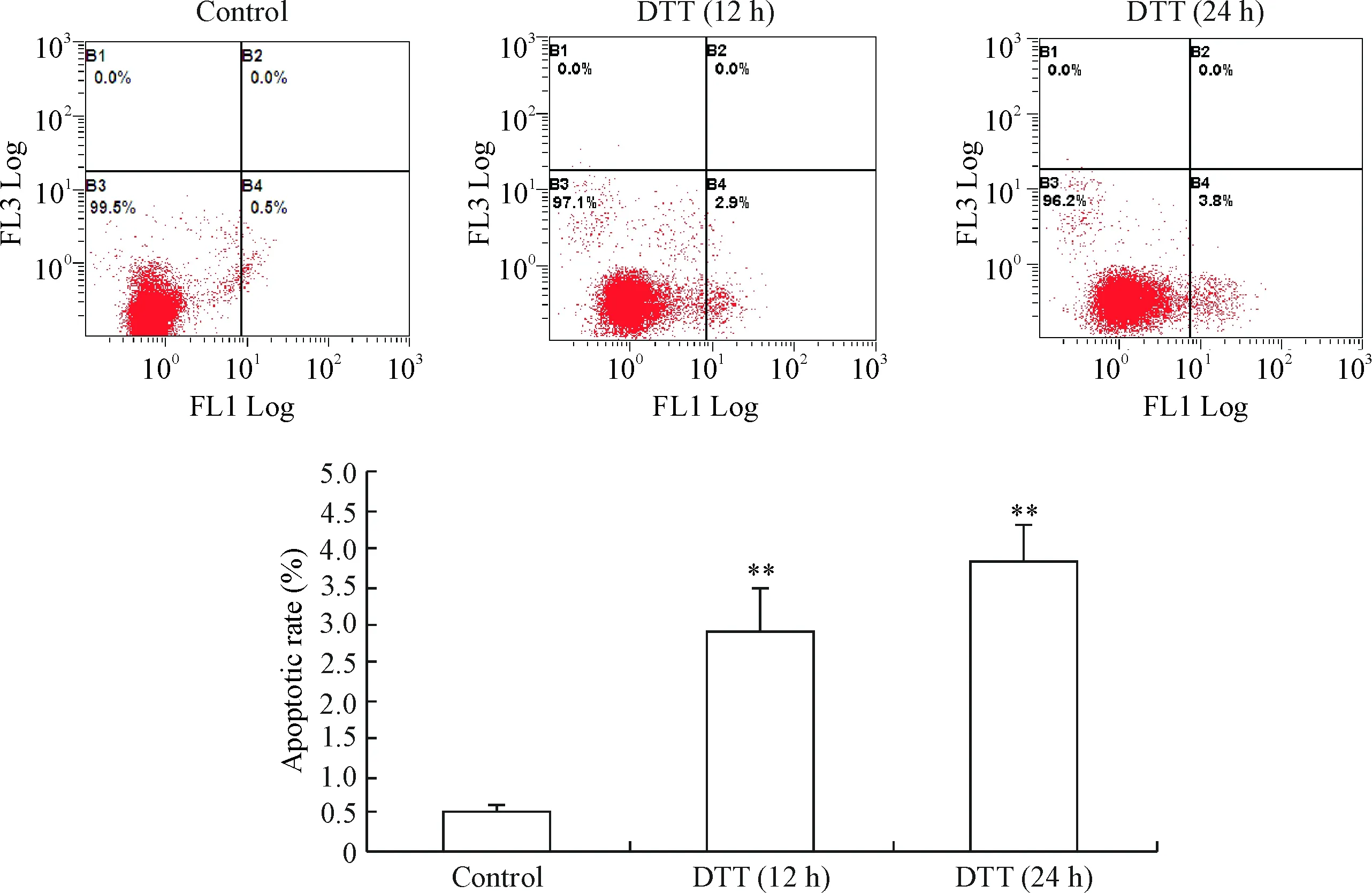
Figure 6.The apoptosis of BRL-3A cells treated with DTT was detected by flow cytometry. Mean±SD.n=3.**P<0.01vscontrol group.
图6流式细胞术检测DTT处理BRL-3A细胞后细胞凋亡率的变化

