SIRT6对小鼠米色脂肪细胞适应性产热功能的影响*
韩在祺, 崔佰吉, 冯 波, 姚 璐
(吉林医药学院, 吉林 吉林 132013)
目前,中国已经成为全球肥胖人口最多的国家[1]。肥胖不仅引起糖脂代谢紊乱、脂肪因子分泌异常和慢性低度炎症反应,还会导致内皮功能障碍、肠道菌群失调和自噬功能受损等异常,同时,肥胖还是诱发2型糖尿病、心血管疾病和多种肿瘤的重要危险因素[2-3]。遗憾的是,目前仍缺乏有效的方法来预防和治疗肥胖。
能量摄入超过能量消耗,过剩能量以甘油三酯形式储存于脂肪细胞的脂滴中,长此以往就会导致肥胖[4]。研究者利用正电子发射计算机断层显像技术发现,成人体内存在具有适应性产热潜能的脂肪细胞,白色脂肪组织中的米色脂肪细胞(beige fat cells)受到冷刺激或β3-肾上腺素能受体激动剂CL316,243的诱导后会进行适应性产热,即解偶联氧化磷酸化,使储存于ATP高能磷酸键中的化学能以热能形式散失[5-6]。米色脂肪细胞可以通过增加能量消耗,使能量动态平衡向负平衡转变,从而抑制肥胖,“白色脂肪米色化”成为人类战胜肥胖的新希望[7-10]。寻找促进“白色脂肪米色化”的有效干预靶点并进行药物研发,有望成为治疗肥胖及其相关代谢性疾病的新方法。随着研究的深入,越来越多的基因和信号通路被发现参与调控白色脂肪米色化,但确切的调控机制仍有待阐明[11]。
沉默信息调节因子6(silent information regulator 6, SIRT6)是NAD+依赖的去乙酰化酶sirtuins家族的一员,具有NAD+依赖的蛋白去乙酰化酶活性和单ADP-核糖基转移酶活性,主要定位于细胞核中[12]。Sirt6基因敲除小鼠出生时表型正常,但是随着生长发育会出现致死性低血糖、淋巴细胞明显减少、皮下脂肪缺失和脊柱弯曲等缺陷,最终在出生4周左右死亡[13]。对Sirt6转基因小鼠进行研究发现,过表达SIRT6会抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPARγ)下游基因的表达,与野生型小鼠相比,Sirt6转基因小鼠内脏脂肪的含量明显减少,胰岛素敏感性显著提高[14],这些研究结果提示SIRT6可能在脂肪组织中参与调控糖脂代谢。脂肪组织特异性Sirt6基因敲除小鼠会因抑制脂肪分解而易感高脂饮食诱导的肥胖[15]。此外,棕色脂肪组织中定位于PPARγ辅激活因子1α(peroxisome proliferator-activated receptor-γ coactivator 1α,PGC-1α)启动子区的SIRT6会通过招募磷酸化的活化转录因子2(activating transcription factor 2,ATF2)促进PGC-1α表达,但是,米色脂肪细胞中SIRT6调节对能量代谢的调控作用及其机制仍有待研究[16]。
PGC-1α是一种转录辅激活因子,通过特异性结合不同的转录因子参与多种能量代谢过程[17]。PGC-1α是调控适应性产热的关键因子,其表达水平受β3-肾上腺素信号通路的调控,冷刺激或CL316,243通过激活β3-肾上腺素信号通路促进PGC-1α表达;作为一个转录辅激活因子,PGC-1α通过与其它转录因子[PPARγ、干扰素调节因子4(interferon regulatory factor 4,IRF4)和PPARα等]相互作用而促进解偶联蛋白1(uncoupling protein-1,UCP1;又名增温素)等产热基因的表达[18-19]。已有研究发现,PGC-1α的活性会受其磷酸化和乙酰化水平的影响,AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)和SIRT1分别可以通过磷酸化和去乙酰化增强PGC-1α的转录辅激活活性[20-21],但是通过翻译后修饰激活PGC-1α转录辅激活活性的上游信号通路仍有待进一步研究。
本研究主要以小鼠原代米色脂肪细胞为模型,探讨SIRT6对小鼠原代米色脂肪能量代谢的影响,并研究SIRT6对PGC-1α乙酰化水平的调控作用,进一步明确米色脂肪细胞中SIRT6调控适应性产热的机制。
材 料 和 方 法
1 材料
人胚胎肾293细胞HEK293A(本实验室保存);质粒抽提试剂盒(天根公司);Lipofectamine 2000转染试剂(Thermo Fisher Scientific);抗SIRT6、乙酰化的赖氨酸抗体(Cell Signal Technology);抗PGC-1α抗体(Millipore和武汉三鹰公司);抗Flag和Myc抗体、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、罗格列酮、吲哚美辛和三碘甲状腺原氨酸(triiodothyronine,T3)(Sigma);抗tubulin抗体、辣根过氧化物酶标记的 II 抗和ECL检测试剂盒(康为试剂公司);蛋白质定量试剂盒、双萤光素酶报告基因检测试剂盒和qPCR Mix(Promega);DMEM培养基和F12培养基(Gibco)。
2 方法
2.1真核表达载体及重组腺病毒的构建 利用PCR扩增小鼠Sirt6和Ppargc1a基因的cDNA序列,并将其插入到pcDNA4/Myc-His载体中,构建表达融合蛋白SIRT6-Myc和HA-PGC-1α的真核表达载体。H133Y是没有催化活性的SIRT6突变体,设计引物对Sirt6 cDNA序列进行定点突变后,过表达H133Y真核表达载体的构建方法与过表达SIRT6真核表达载体的构建方法完全相同。构建重组腺病毒Ad-Flag-Sirt6和Ad-GFP的方法与文献报道一致[22]。
2.2白色脂肪来源间充质干细胞的分离、体外培养及小鼠原代米色脂肪细胞的诱导分化 C57BL/6小鼠拉颈处死,取出腹股沟处的脂肪垫,将脂肪垫剪碎并移至含有胶原酶Ι的工作液中消化,滤网过滤,滤后的工作液经离心除去上清,沉淀即为白色脂肪来源间充质干细胞。用含10% 胎牛血清的DMEM/F12培养基重悬沉淀,并均匀分至培养板中,置于5% CO2、37 ℃细胞培养箱中培养,待间充质干细胞达到100%融合,将原培养基更换为添加1 μmol/L地塞米松、850 nmol/L胰岛素、0.5 mmol/L IBMX、1 μmol/L罗格列酮、125 nmol/L吲哚美辛和1 nmol/L T3的DMEM/F12培养基,培养48 h,再将培养基更换为添加850 nmol/L胰岛素、1 μmol/L罗格列酮和1 nmol/L T3的DMEM/F12培养基,继续培养4~5 d后,即为分化成熟的小鼠原代米色脂肪细胞。同时,检测分化成熟的小鼠原代米色脂肪细胞中米色脂肪细胞标志性基因Cd137和Tmem26的表达情况。
2.3免疫共沉淀(co-immunoprecipitation,Co-IP)实验和免疫沉淀(immunoprecipitation,IP)实验 Co-IP和IP实验的操作方法基本相同,转染或共转染过表达SIRT6-Myc、H133Y-Myc和HA-PGC-1α真核表达载体的HEK293A细胞、小鼠原代米色脂肪细胞及感染腺病毒Ad-Flag-Sirt6或Ad-GFP的小鼠原代米色脂肪细胞,利用含有蛋白酶抑制剂的RIPA裂解液提取细胞总蛋白。细胞总蛋白经对照IgG和Protein A/G琼脂糖珠预处理后,留少量总蛋白作为Input,剩余蛋白样品均分2份,一份加入抗目的蛋白抗体,另一份加入相应IgG作为对照,4 ℃孵育过夜后,加入Protein A/G琼脂糖珠继续孵育2 h,离心收集Protein A/G琼脂糖珠,用PBS洗涤5次,最后用电泳加样缓冲液重悬Protein A/G琼脂糖珠后,煮沸10 min,-20 ℃冻存备用。利用Co-IP实验检测SIRT6与PGC-1α的相互作用,用抗SIRT6抗体进行IP,用抗PGC-1α抗体进行Western blot检测,反之则反。利用IP实验检测PGC-1α的乙酰化水平,用抗PGC-1α抗体进行IP,用抗乙酰化的赖氨酸抗体进行Western blot检测。
2.4Western blot实验 配制10% SDS-PAGE,取蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂牛奶室温孵育1 h,将PVDF膜孵育相应的I抗稀释液,4 ℃孵育过夜,用1×TBST漂洗5次,每次10 min。室温下,用HRP标记的II抗稀释液孵育PVDF膜2 h,再用1×TBST漂洗4次,每次10 min。最后,利用ECL发光,X线片曝光、显影、定影。
2.5油红O染色实验 除去培养液并用PBS漂洗细胞后,加10%中性甲醛固定细胞。配制染色液(称取预先研磨粉碎的0.5 g油红干粉,溶于少量异丙醇中,然后加异丙醇至100 mL,米色瓶密封或锡箔纸包裹避光,4 ℃保存,此为储存液,可长期保存,用时取6 mL储存液加双蒸水4 mL混匀,定性滤纸过滤后即为染色液),除去培养皿中的10%中性甲醛并加入染色液,染色10 min。用60%异丙醇漂洗脱色,晾干后,使用光学显微镜进行观察。
2.6双萤光素酶报告基因实验 小鼠Ucp1增强子区为约2 kb的序列,该序列中包含PPAR反应元件(PPAR response element, PPRE),经PCR扩增后插入到pGL3-Basic质粒中。将HEK293A细胞接种到24孔板中,培养约18 h,细胞密度达到约80%,共转染SIRT6质粒、PGC-1α质粒、萤火虫萤光素酶报告基因表达质粒和海肾萤光素酶报告基因表达质粒,并用pEGFP-C1质粒调平转染质粒的总质量。转染48 h后,吸去培养基,用预冷PBS洗涤细胞,吸净残留液体。每孔加入80 μL被动裂解液,室温裂解30 min。吸取20 μL上清加入到测试板中,并利用双萤光素酶报告基因检测系统进行检测读值。相对萤光素酶活性=萤火虫萤光素酶读值/海肾萤光素酶读值。
2.7Real-time PCR实验 使用TRIzol试剂从小鼠原代米色脂肪细胞中分离纯化总RNA,通过反转录酶和随机引物合成cDNA第1条链。利用基因特异性引物和SYBR Green实时定量PCR预混液,使用实时定量PCR仪对新合成的cDNA进行分析测定。利用2-ΔΔCt循环阈值方法分析数据。测定各目标基因转录水平时以Rps18作为内参照基因,各组实验中目标基因的mRNA水平表示为对照组表达量的数倍。所用引物的序列见表1。

表1 Real-time PCR引物的核苷酸序列
3 统计学分析
采用SPSS 13.0软件进行统计学处理。数据表示为3次实验结果的均数±标准差(mean±SD)。两组间比较采用独立样品t检验;多组间多重比较采用单因素方差分析(one-way ANOVA),之后各组间的两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 SIRT6增强小鼠原代米色脂肪细胞适应性产热
经体外诱导分化获得成熟的小鼠原代米色脂肪细胞,且其标志性基因Cd137和Tmem26的mRNA表达水平均高于棕色和白色脂肪细胞,见图1A。将米色脂肪细胞感染重组腺病毒Ad-GFP和Ad-Flag-Sirt6,24 h 后利用荧光显微镜观察绿色荧光蛋白(green fluorescent protein, GFP)的表达情况,可见绿色荧光强度基本一致,说明2组细胞感染重组腺病毒的程度相近,见图1B。通过油红O染色实验发现2组细胞的脂滴大小和密度基本一致,说明SIRT6不参与调控脂肪分化,见图1B。利用Seahorse能量代谢分析仪检测发现, SIRT6上调小鼠原代米色脂肪细胞的基础耗氧速率;寡霉素(oligomycin)作为一种ATP合酶抑制剂会阻断ATP产生,结果显示SIRT6会增强适应性产热功能;FCCP是一种解偶联剂,反映细胞的最大耗氧能力,从图中可以看出,SIRT6会增大细胞的呼吸潜能(P<0.01),见图1C。此外,与感染Ad-GFP对照组相比,感染Ad-Flag-Sirt6重组腺病毒使小鼠原代米色脂肪细胞中Sirt6的表达量显著上调,过表达SIRT6可以明显诱导Ucp1、Dio2和Elovl3等适应性产热基因的表达上调(P<0.05),见图1D。

Figure 1.SIRT6 stimulated adaptive thermogenesis in mouse primary beige fat cells. A: relative mRNA expression of beige fat cell-specific markersCd137 andTmem26 was measured by real-time PCR in differentiated brown, beige and white fat cells; B: the infection rate (upper panel, ×400) and oil red O staining (lower panel,×40) of control and SIRT6-expressing primary beige fat cells; C: continuous measurement of oxygen consumption rate (OCR) in control and SIRT6-expressing primary beige fat cells. Oxygen consumption was performed under basal conditions, followed by the addition of oligomycin (1 μmol/L), the pharmacological uncoupler FCCP (2 μmol/L) or the Complex III and I inhibitor antimycin A and rotenone (0.5 μmol/L each); D: relative mRNA expression ofSirt6,Ucp1,Dio2 andElovl3 in primary beige fat cells infected with Ad-GFP and Ad-Flag-Sirt6 was measured using real-time PCR. Mean±SD.n=4.#P<0.05vsbrown adipocyte group and white adipocyte group;*P<0.05,**P<0.01vsAd-GFP group.
图1SIRT6增强小鼠原代米色脂肪细胞适应性产热
2 HEK293A细胞中外源SIRT6和PGC-1α存在相互作用
PGC-1α是一个非常重要的影响能量代谢的调控因子,考虑到与SIRT6同属一个家族的SIRT1能够通过去乙酰化PGC-1α调节其活性,我们设计实验探索SIRT6与PGC-1α之间的相互作用情况[17, 21]。将转染或共转染过表达SIRT6-Myc、HA-PGC-1α和GFP重组质粒的HEK293A细胞,提取总蛋白后进行Co-IP实验发现,外源性的SIRT6和PGC-1α存在相互作用,见图2A、B。此外,对转染或共转染HA-PGC-1α、SIRT6-Myc或H133Y-Myc重组质粒的HEK293A细胞进行Co-IP实验发现,SIRT6的突变体H133Y与PGC-1α之间不存在相互作用,见图2C。

Figure 2.There was an interaction between exogenous SIRT6 and PGC-1α in HEK293A cells. Co-IP assays of exogenous PGC-1α with exogenous SIRT6 (A), exogenous SIRT6 with exogenous PGC-1α (B), and exogenous PGC-1α with exogenous SIRT6-Myc and H133Y-Myc (C) were performed.
图2HEK293A细胞中外源性的SIRT6与PGC-1α存在相互作用
3 小鼠原代米色脂肪细胞中SIRT6与PGC-1α存在相互作用
小鼠原代米色脂肪细胞感染Ad-GFP和Ad-Flag-Sirt6后,进行Co-IP实验发现,外源性SIRT6与内源性PGC-1α存在相互作用,见图3A。进一步对小鼠原代米色脂肪细胞进行Co-IP实验证实,内源性SIRT6与PGC-1α仍存在相互作用,见图3B。

Figure 3.There was an interaction between SIRT6 and PGC-1α in mouse primary beige fat cells. A: Co-IP of endogenous PGC-1α with Flag-Sirt6 and Co-IP of exogenous SIRT6 with endogenous PGC-1α from primary beige fat cells infected with Ad-GFP or Ad-Flag-Sirt6; B: Co-IP of endogenous PGC-1α with endogenous SIRT6 from subcutaneous fat pads.
图3小鼠原代米色脂肪细胞中SIRT6与PGC-1α存在相互作用
4 SIRT6通过去乙酰化PGC-1α增强其转录共激活活性
SIRT6具有去乙酰化酶活性,而去乙酰化PGC-1α会增强其活性,因此我们利用IP实验检测PGC-1α的乙酰化水平,以探索SIRT6对PGC-1α的调控机制。HEK293A细胞转染或共转染过表达SIRT6-Myc、H133Y-Myc、HA-PGC-1α或GFP的重组质粒后,提取总蛋白进行IP实验,发现过表达SIRT6会降低外源性PGC-1α的乙酰化水平,而SIRT6的无活性突变体H133Y则无此作用,见图4A。小鼠原代米色脂肪细胞感染Ad-GFP或Ad-Flag-Sirt6后,进行IP实验,发现SIRT6会去乙酰化内源性PGC-1α,见图4B。
Ucp1增强子含有PPRE,PPARγ与PPRE结合,PGC-1α通过与PPARγ结合发挥其转录辅激活活性,促进Ucp1转录[21]。利用PCR扩增小鼠Ucp1增强子含PPRE的序列,并将其插入到萤光素酶报告质粒pGL3-Basic启动子区域,构建重组萤光素酶报告质粒并进行双萤光素酶报告基因实验,结果表明PGC-1α会促进Ucp1的转录,并且SIRT6会协同增强PGC-1α的转录辅激活活性,见图4C。
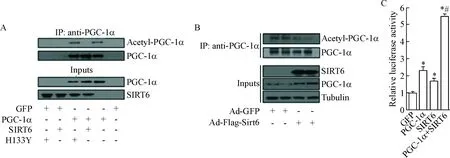
Figure 4.SIRT6 activated transcriptional coactivator PGC-1α through deacetylation of PGC-1α in mouse primary beige fat cells. A: the effects of SIRT6 and H133Y on PGC-1α acetylation were measured in HEK293A cells cotransfected with GFP, PGC-1α, SIRT6 and H133Y plasmids; B: the effects of SIRT6 on PGC-1α acetylation were measured in mouse primary beige fat cells infected with Ad-GFP or Ad-Flag-Sirt6; C: fragments of theUcp1 promoter fused to a luciferase reporter were cotransfected into HEK293A cells together with GFP plasmid (control) or SIRT6 in the presence or absence of a PGC-1a expression plasmid, and the luciferase activity was corrected forRenillaluciferase activity and normalized to control activity. Mean±SD.n=4.*P<0.05vsGFP group;#P<0.05vsPGC-1α group.
图4SIRT6通过去乙酰化PGC-1α增强其转录共激活活性
讨 论
通过上述实验,我们认为米色脂肪细胞中SIRT6可通过去乙酰化PGC-1α上调其转录共激活活性,使PGC-1α下游适应性产热基因的表达升高,并通过增强适应性产热使米色脂肪细胞的能量消耗增多。研究发现,棕色脂肪组织中SIRT6可以通过招募磷酸化的ATF2结合到Ppargc1a启动子而增加PGC-1α表达,从而促进适应性产热[23]。棕色脂肪细胞和米色脂肪细胞是2种不同的脂肪细胞,由不同的前体脂肪细胞分化而来,基因表达谱有很大差别,因此,SIRT6虽在2种脂肪细胞中均发挥调控能量代谢的重要作用,但是具体的调控机制并不相同[19]。
Dominy等[24]发现 SIRT6会通过激活乙酰化酶通用控制非抑制蛋白5(general control nonrepressed protein 5, GCN5)使其乙酰化PGC-1α,从而抑制肝脏糖异生,但是Yang等[25]研究却发现,在肝脏中敲低SIRT6会抑制PGC-1α的表达。因此,在肝脏中SIRT6对PGC-1α生理功能的调控作用及其机制仍需进一步研究。研究已经证实,PGC-1α在不同组织器官中具有不同的生理功能,棕色脂肪组织中,PGC-1α会促进线粒体生物合成和适应性产热;肝脏中,PGC-1α会调节糖异生和脂肪酸氧化;肌肉组织中,PGC-1α则参与调控肌肉纤维类型转化[18]。这在一定程度上暗示,SIRT6对PGC-1α的调控可能是具有组织特异性的。
SIRT1与SIRT6同属sirtuins家族,对SIRT1的研究远早于对SIRT6的研究,随着研究发现SIRT1具有广泛而重要的生理功能, SIRT1被寄予厚望作为治疗糖尿病、心血管疾病等疾病的分子靶点[26]。令人遗憾的是,SIRT1是一把双刃剑,在具有积极生理学功能的同时,会因抑制细胞凋亡而增加机体罹患癌症的风险[27]。随着对SIRT6研究的深入,越来越多的研究表明SIRT6有望成为治疗肥胖和2型糖尿病等代谢性疾病的靶点。SIRT6不仅在调控能量代谢和糖脂代谢中发挥积极的生物学功能,同时,有研究发现SIRT6可以延缓衰老,抑制肿瘤的发生发展[28-30]。后续我们将对SIRT6进行更深入透彻的研究,验证其作为治疗肥胖和2型糖尿病等代谢性疾病分子靶点的可能性,以期为治疗代谢性疾病提供新的可能。

