Sos2抑制NFATc1介导的糖尿病肾病足细胞损伤的机制研究*
杜 玥, 张 鸿, 窦曹帅, 谈锦萍, 付 蕾,史 伟, 梁馨苓, 刘双信, 章 斌△
(1华南理工大学医学院, 广东 广州 510006; 2广东省人民医院肾内科, 广东省医学科学院, 广东 广州 510080)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病主要的慢性并发症之一,也是导致终末期肾病的主要原因[1-2]。足细胞损伤在糖尿病肾病的进程中发挥着至关重要的作用,近年来受到研究者的重视[3-4]。国内外[5-7]和本课题组[8]研究发现,核转录因子——活化T细胞核因子胞浆1型 (nuclear factor of activated T-cells, cytoplasmic 1,NFATc1)是影响足细胞损伤、凋亡及肾小球硬化的关键因子。静息状态,NFATc1以磷酸化形式存在细胞质中,损伤刺激时,Ca2+内流,活化钙调磷酸酶,NFATc1去磷酸化进入细胞核,启动下游目的基因的转录[9]。我们前期的其它研究显示,在慢性肾脏病的动物模型中,包括脂多糖肾病、5/6 肾大部切除肾病和糖尿病肾病动物模型,足细胞NFATc1都扮演了重要的致病角色[10-12]。这些证据促使我们进一步思考足细胞NFATc1活化的调控机制。
鸟苷酸交换因子Sos(Son of Sevenless)是一种Ras激活剂,可引起GTP/GDP交换,哺乳动物Sos家族由2个成员——Sos1和Sos2组成[13]。以往研究表明,Sos1和Sos2参与外周CD4+T细胞中PI3K通路的调节[14]。在肾脏病研究领域,大规模外显子组分析显示,Sos2在肾脏的发育过程中发挥着重要作用[15]。但Sos2在肾小球足细胞中的功能,目前国内外尚无报道。本研究拟通过人类糖尿病肾病及细胞模型观察Sos2在足细胞中的表达,在体外实验验证Sos2对足细胞损伤和活动性的影响,并进一步探究Sos2是否可通过影响NFATc1的入核对足细胞损伤产生影响。
材 料 和 方 法
1 主要仪器和试剂
二氧化碳培养箱购自Thermo;台式离心机和加样器购自Eppendorf;冷冻高速离心机购自Beckman;电泳系统购自Bio-Rad;激光共聚焦显微镜购自Zeiss。
胎牛血清、0.05%胰酶和Opti-MEM培养液购自Gibco;DMEM培养液购自Corning;干扰素γ购自ProSpec;核浆蛋白提取试剂盒购自广州凯基生物公司;NFATc1抗体购自Abcam;GAPDH 抗体购自Bioworld; histone抗体和DAPI购自Cell Signaling Technology;抗podocin抗体、Tris、甘氨酸、丙烯酰胺和Ⅰ型鼠尾胶原购自Sigma;抗synaptopodin、Sos2和NFATc1抗体购自Santa Cruz;驴抗兔荧光II抗488购自Thermo Fisher Scientific;逆转录试剂盒和SYBR GREEN购自TaKaRa;羊抗鼠荧光II抗546、 Lipofectamine 2000和TRIzol购自Life Technologies;Sos2 siRNA购自广州锐博生物公司。
2 主要方法
2.1足细胞的培养和实验分组 条件永生化小鼠足细胞系由美国Jochen Reiser教授(Rush University Medical Center, Chicago, IL, USA)惠赠。足细胞先在33 ℃、5% CO2培养箱中增殖,细胞融合达到70%~80%时转入5% CO2、37 ℃培养箱中分化,在37 ℃培养10~12 d,足细胞分化成熟。本实验所有足细胞实验均在分化成熟后进行。
根据实验设计,为明确高糖(high glucose, HG)刺激下肾组织及足细胞中Sos2的表达,分组如下:正常对照组(control组):含5.3 mmol/L葡萄糖的DMEM培养48 h;甘露醇(mannitol, MA)对照组(MA组):含5.3 mmol/L葡萄糖和24.7 mmol/L甘露醇的DMEM培养48 h; HG组:含30 mmol/L葡萄糖的DMEM培养48 h。为探讨过表达Sos2对足细胞podocin表达、活动性及NFATc1入核的影响,分组如下:过表达对照组(pHBAd+HG组):含5.3 mmol/L葡萄糖的无血清DMEM培养液及5 μL pHBAd腺病毒干预24 h后高糖刺激48 h;过表达组(Sos2+HG组):含5.3 mmol/L葡萄糖的无血清DMEM培养液及5 μL pHBAd-Sos2腺病毒干预24 h后高糖刺激48 h。为探讨沉默Sos2对足细胞podocin表达、活动性及NFATc1入核的影响,分组如下:正常对照组(control组)、control siRNA组、Sos2 siRNA1组和Sos2 siRNA2组,siRNA浓度均为50 nmol/L。
2.2病毒感染 足细胞分化成熟后,向含有5 mL无血清的DMEM培养液中加入5 μL的腺病毒液,感染24 h后,吸去培养皿中的培养液,换成普通含有5%血清的DMEM培养液,再做其它干预。
2.3siRNA转染 足细胞分化成熟后将含有50 nmol/L siRNA与8 μL Lipofectamine 2000的混合液加入无血清无抗生素培养液内,6 h后换成5% 血清的DMEM培养液继续培养48 h。
2.4免疫荧光染色 肾组织或足细胞先进行冰甲醇固定、0.5% Triton X-100透化、5%BSA封闭,再孵育I抗4 ℃过夜,然后用相应的荧光II抗避光孵育及DAPI染核,封片,激光共聚焦显微镜或荧光显微镜下观察,所用图片均在400倍镜下拍摄。
2.5Western blot实验 收集蛋白后用BCA法测蛋白浓度,加入蛋白变性液煮沸变性。蛋白加入到7.5%、9%凝胶进行SDS-PAGE、200 mA恒流湿转到PVDF膜上,5%牛奶封闭1 h,I抗4 ℃孵育过夜,用相应II抗室温孵育1 h后,使用电化学发光液(ECL)进行曝光。ImageJ软件分析条带的灰度值。每组实验重复3次。
2.6RT-PCR TRIzol法提取细胞总RNA,采用反转录试剂盒将RNA反转录成cDNA。按照SYBR Green PCR试剂盒说明书操作检测目的基因表达。引物序列:Sos2正义链5’-TCACAGGACATTCTTGCACCA-3’,反义链5’-CTTAAAGCCGTCAGCAATGGA-3’;GAPDH 正义链5’-AGGTCGGTGTGAACGGATTTG-3’,反义链5’-TGTAGACCATGTAGTTGAGGTCA-3’;Plaur正义链5’-GACTACCGTGCTTCGGGAATG -3’,反义链5’-ATGGTCCTGTTGGTCTTTTCG -3’;Wnt6正义链5’-CTCCTACAGTGTGGTTGTCAGG-3’,反义链5’-GCGCATCCATAAAGAGTCTTGA-3’;Fzd9正义链5’-CGCACGCACTCTGTATGGAG-3’,反义链5’-GCCGAGACCAGAACACCTC-3’;Rcan1正义链5’-CTCCTCCCGTTGGCTGGAAA-3’,反义链5’-CTGGGAGTGGTGTCTGTCGC-3’。反应程序为: 95 ℃预变性5 min; 95 ℃变性10 s, 60 ℃退火25 s, 72 ℃延伸25 s,此3步共循环40次; 72 ℃终止5 min;每个样本设3个复孔,定量结果取平均值。
2.7划痕实验 将已分化成熟的足细胞按每孔1×108/L数量接种到6孔板,5%CO2、37 ℃孵育过夜。用1 mL无菌吸头末端刮除每孔盖玻片上的细胞,刮出“井”字,PBS轻轻洗涤1次后换上新鲜的培养液, 进行过表达或沉默处理,按上述实验时间后,进行高糖处理48 h。处理结束后去上层培养液,PBS轻轻洗涤2次,-20 ℃冰甲醇固定15 min,PBS洗3次,0.5% Triton X-100透化10 min,PBS洗3次。DAPI染色10 min显示细胞核,避光PBS洗3次后封片,置于荧光显微镜下观察,所用图片均在100倍镜下拍摄。
3 统计学处理
符合正态分布计量资料用均数±标准差(mean±SD)表示,组间比较用单因素方差分析,采用LSD检验进行两组间比较。采用统计软件SPSS 22.0进行统计学分析,以P<0.05为差异有统计学意义。
结 果
1 Sos2在糖尿病肾病患者的足细胞中表达降低
免疫荧光染色通过肾小球足细胞标志蛋白synaptopodin定位足细胞,结果显示正常肾组织的足细胞中Sos2的表达量较多,而在糖尿病肾病患者的肾小球足细胞内Sos2的表达量显著减少,见图1。
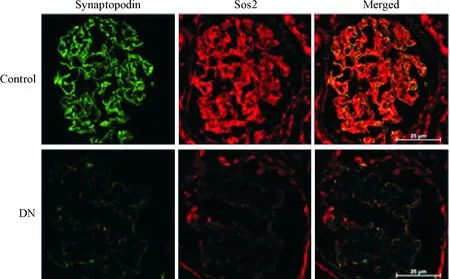
Figure 1.Sos2 was decreased in podocytes of diabetic nephropathy (DN) patients. Sos2 protein (red) was found in podocytes, as shown by double immunofluorescence with the podocyte marker synaptopodin (green) resulting in a partial yellow overlap. Scale bar is 25 μm.
图1Sos2在糖尿病肾病患者的足细胞中表达降低
2 Sos2在高糖刺激体外培养的足细胞中表达降低
用30 mmol/L葡萄糖处理足细胞48 h,RT-PCR和Western blot结果显示,与对照组和甘露醇组比较,高糖组Sos2的表达均显著降低(P<0.05),见图2A、B。同时,免疫荧光染色后,通过DAPI来定位细胞核,肾小球足细胞标志蛋白synaptopodin来定位足细胞,叠加结果显示HG干预足细胞可使Sos2表达显著减少,见图2C。
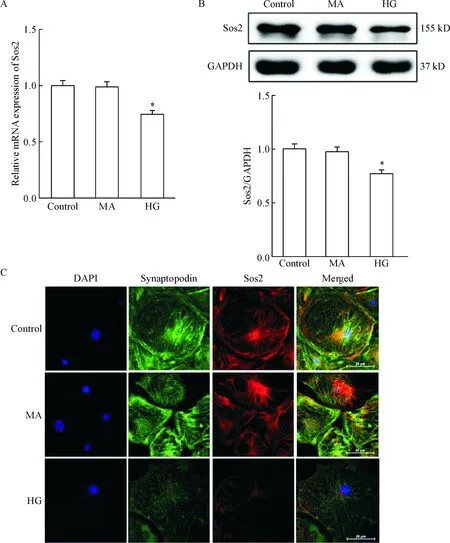
Figure 2.Sos2 was decreased in high glucose (HG)-treated podocytesinvitro. A and B: RT-PCR and Western blot showed an lower level of Sos2 in podocytes with HG; C: Sos2 protein (red) was found in podocytes, as shown by double immunofluorescence with the podocyte marker synaptopodin (green) resulting in a partial yellow overlap. Scale bar is 25 μm. Mean±SD.n=3.*P<0.05vscontrol group.
图2HG体外处理后足细胞Sos2表达降低
3 过表达及沉默足细胞中Sos2效率的验证
RT-PCR结果显示Sos2 siRNA1的沉默水平可达到对照组的46%(P<0.05),Sos2 siRNA2的沉默水平可达到对照组的46%(P<0.05),Sos2过表达水平可达到对照组的15.98倍(P<0.05)。同时,Western blot结果显示Sos2 siRNA1的沉默水平可达到对照组的36%(P<0.05),Sos2 siRNA2的沉默水平可达到对照组的44%(P<0.05),Sos2过表达水平可达到对照组的5.67倍(P<0.05),见图3。本实验可明确Sos2过表达及沉默水平皆有统计学意义,为下一步实验做准备。
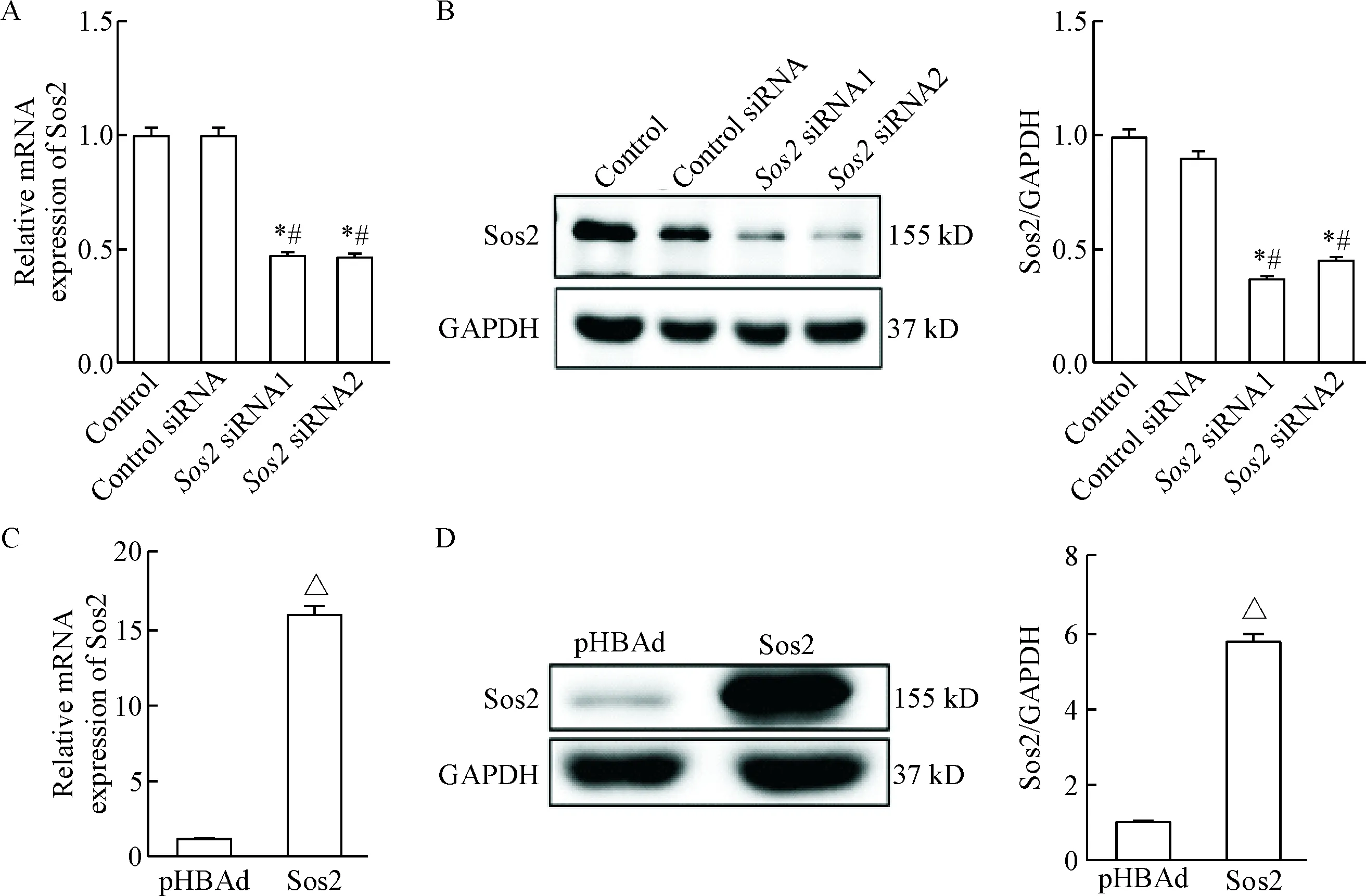
Figure 3.The efficiency validation ofSos2 overexpression (C, D) and silencing (A, B)invitroby RT-PCR (A, C) and Western blot (B, D). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscontrol siRNA group;△P<0.05vspHBAd group.
图3体外Sos2过表达和沉默效率的验证
4 调控Sos2对足细胞podocin蛋白表达的影响
Western blot结果显示,沉默Sos2后,podocin的表达显著降低(P<0.05),而在高糖刺激下过表达Sos2后,podocon的表达显著升高(P<0.05)。免疫荧光结果显示,沉默Sos2后,podocin的表达相比对照组有显著损伤且无序,高糖条件下过表达Sos2时,podocin的表达更加明显和规则,见图4。
5 调控Sos2对足细胞活动性的影响
通过划痕实验来观察足细胞在不同条件下的活动性,实验结果可知,在Sos2沉默时,与control组和control siRNA组比较,足细胞的迁移数目明显增多(P<0.05)。反之,在高糖条件下,当过表达Sos2时,与pHBAd+HG组相比,足细胞的迁移数目明显降低(P<0.05),见图5。
6 调控Sos2对足细胞NFATc1入核的影响
由足细胞核蛋白Western blot及定量分析结果观察到,沉默Sos2时,NFATc1的入核显著增加(P<0.05);高糖条件下过表达Sos2时,NFATc1的入核显著降低(P<0.05)。而观察总蛋白Western blot结果可知,在沉默和过表达Sos2后,总蛋白中NFATc1基本没有变化。同时,检测NFATc1下游目的基因的转录情况,沉默Sos2时,NFATc1入核后的下游目的基因Plaur、Rcan1、Wnt6和Fzd9[5]转录水平显著增高(P<0.05);高糖条件下过表达Sos2时,Plaur、Rcan1、Wnt6和Fzd9转录水平显著降低(P<0.05),见图6。
讨 论
糖尿病肾病是全球卫生问题之一,是糖尿病导致的肾脏损害,其发病机制与多种因素密切相关[16]。足细胞是肾小球滤过屏障的重要组成部分,几乎所有的肾小球疾病都与足细胞损伤有关[17]。因此,阐明糖尿病肾病足细胞损伤机制将有助于提供防治DN的新策略。
以往研究表明[18],Sos2作为一种Ras、Rac鸟苷酸交换因子,可使GDP带上磷酸基团转化为GTP,从而使Ras激活。Sos2蛋白在人类肾脏的肾小球和肾小管中有表达[19]。2016年,一项大规模外显子组分析显示,Sos2可调节肾脏发育和功能[15]。但是,在足细胞中,Sos2的表达和效应尚未有报道。本研究首次发现在人类肾小球足细胞及体外培养足细胞中均有Sos2的表达,且在糖尿病肾病患者足细胞中表达减少,体外培养的足细胞在高糖环境中也表达减少,因此我们推测Sos2的表达变化极有可能与足细胞损伤有关。
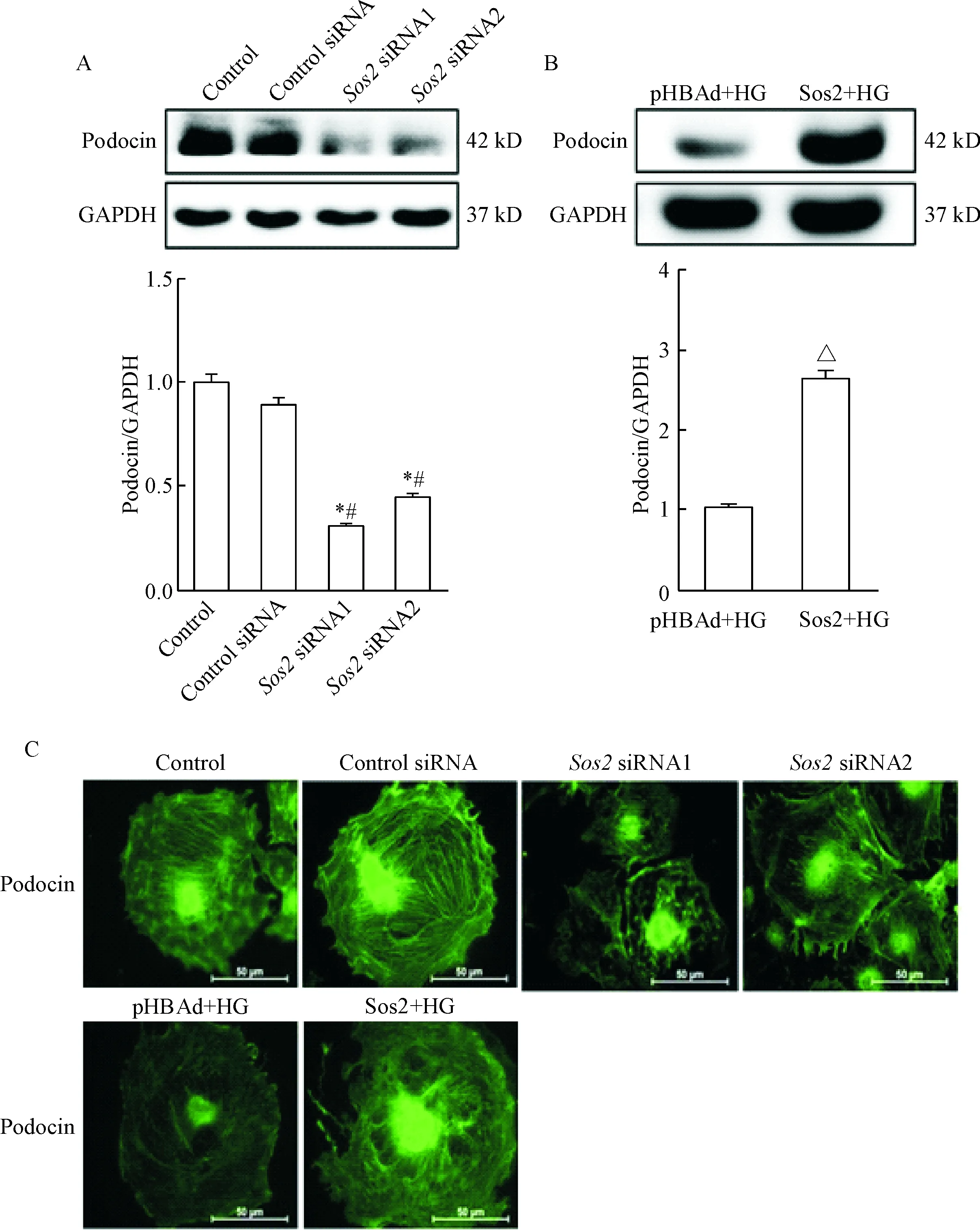
Figure 4.Sos2 affected podocin expression in the podocytes. A and B: Western blot showed the expression of podocin in the podocytes; C: immunofluorescence staining showed the expression of podocin in the podocytes (green). Scale bar is 50 μm. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscontrol siRNA group;△P<0.05vspHBAd+HG group.
图4调控Sos2对足细胞podocin蛋白表达的影响
有研究证实[20],podocin编码基因NPHS2敲除小鼠病理表现为严重的系膜硬化,电镜可观察到足突广泛融合,裂孔膜消失。足细胞受损时,足细胞标志蛋白podocin表达下降[21]。同时,足细胞活动性的增强也是足细胞的一个重要损伤因素,在体内会引起足细胞足突的融合甚至足细胞丢失导致蛋白尿,在体外表现为足细胞活动性的增强同足突融合有着相似的机理[22],抑制损伤足细胞的活动性是公认的保护足细胞的关键之一。本实验中,为了探究Sos2在足细胞中的效应,我们首先在体外调控足细胞中Sos2的表达,采用Sos2 siRNA下调Sos2的表达,过表达Sos2的腺病毒上调Sos2的表达。通过观察不同条件下podocin的表达,来证明足细胞的损伤情况;同时通过划痕实验来观察足细胞在不同条件下的活动性。以上结果表明,Sos2对足细胞具有保护作用,可抑制足细胞迁移,保持足细胞相对稳定的状态,即对于足细胞而言Sos2是一个保护因子。
我们进一步研究Sos2在足细胞中的保护作用机制时观察到,过表达足细胞中的Sos2时,NFATc1入核明显减少,下游目的基因Plaur、Rcan1、Wnt6和Fzd9转录水平随之降低;沉默Sos2时,NFATc1的入核明显增加,下游目的基因转录水平随之升高,这提示我们Sos2对足细胞的保护效应与核转录因子NFATc1有关。NFATc1是核转录因子,当细胞受到损伤刺激引起细胞内游离钙离子增加时,钙调磷酸酶(calcineurin, CaN) 活化,催化NFATc1去磷酸化进入细胞核,启动下游目的基因的转录[9]。在足细胞,本课题组[8, 10-11, 23]和国内外研究者[5, 24-25]报道,CaN-NFATc1信号轴活化导致足细胞损伤、凋亡和肾小球硬化,这反映了经典通路CaN-NFATc1在肾小球疾病发病机制中的核心地位。本实验明确了Sos2可抑制NFATc1的入核,参与了经典通路CaN-NFATc1[9]的调控,从而保护足细胞,但是Sos2是通过何种途径对NFATc1进行调控,目前尚未明确,需进一步探索。
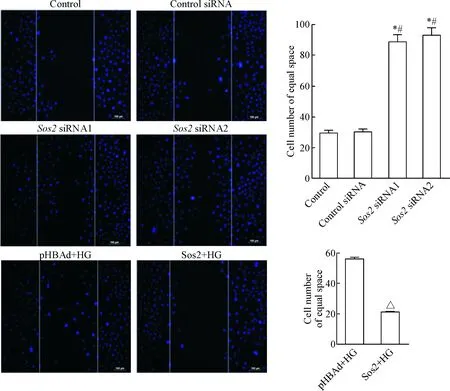
Figure 5.The effects of Sos2 on the motility of podocytes (DAPI staining). Scale bar is 100 μm. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscontrol siRNA group;△P<0.05vspHBAd+HG group.
图5Sos2可抑制足细胞的迁移
本研究首次发现鸟苷酸交换因子Sos2在足细胞中有表达,且在足细胞中Sos2是一个保护因子,介导足细胞的保护机制是通过抑制NFATc1入核,降低NFATc1活性。本研究从一个全新的视角探究NFATc1的调控机制,丰富了CaN-NFATc1信号轴机制,为临床治疗糖尿病肾病提供新的干预策略。Sos2作为鸟苷酸交换因子,是通过何种机制对足细胞podocin表达和细胞活动性进行调控,是通过何种途径对NFATc1入核进行调控;且在人类糖尿病肾组织的免疫荧光染色观察到足细胞中Sos2表达降低,Sos2是否在内皮细胞和系膜细胞中也表达?后续我们将继续探究相关问题,并构建转基因动物模型,进一步验证Sos2对肾脏损伤的影响及和NFATc1之间的关系,从而为Sos2应用于临床提供更多的实验依据。
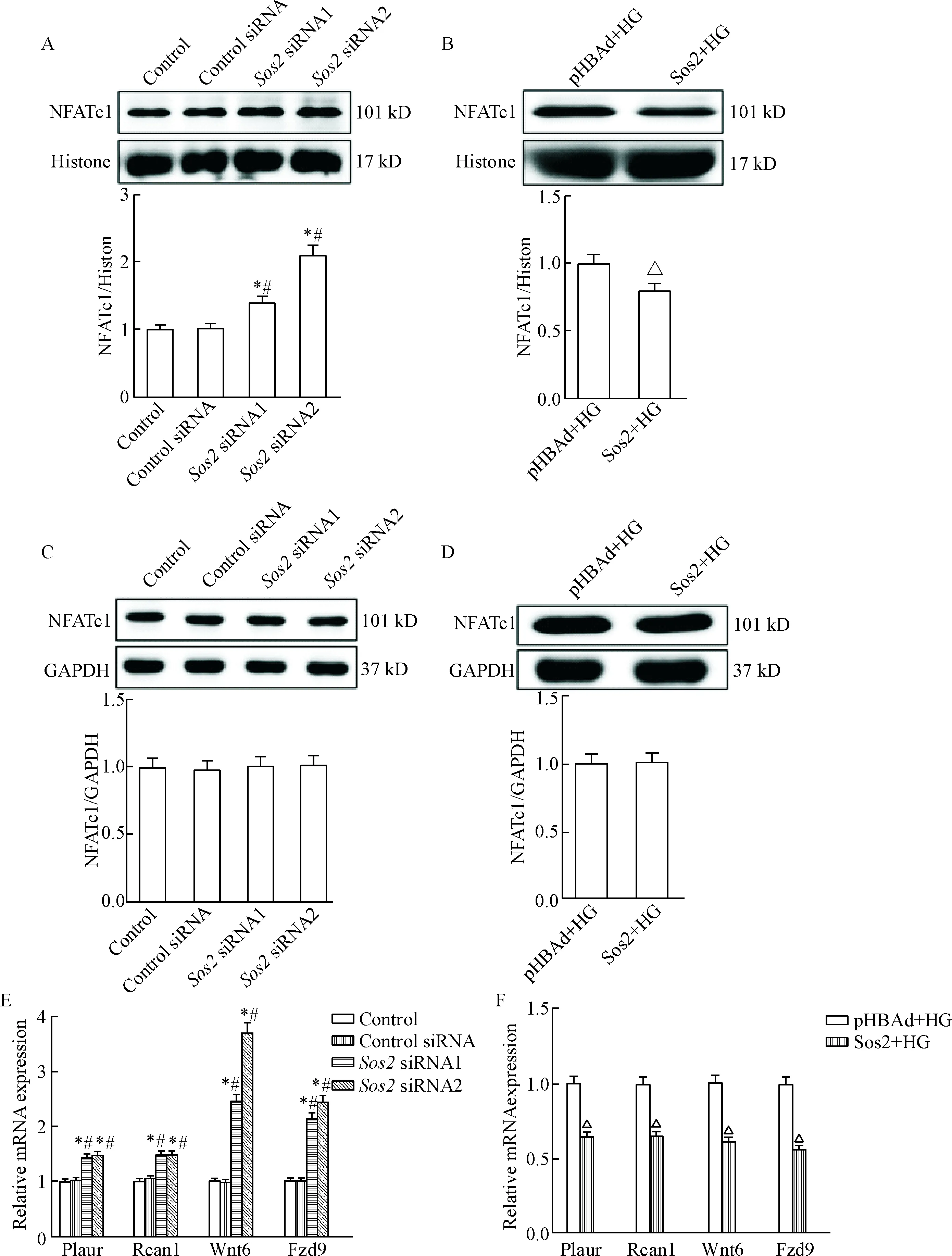
Figure 6.Sos2 inhibited the translocation of NFATc1 into the nucleus. A and B: Western blot showed NFATc1 protein level in the nucleus; C and D: Western blot showed total NFATc1 protein level in podocytes; E and F: RT-PCR showed the expression of downstream target genes for NFATc1. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscontrol siRNA group;△P<0.05vspHBAd+HG group.
图6Sos2抑制NFATc1入核

