3,4-二羟基苯乙酮通过AMPK途径降低肝细胞及肝脏组织的甘油三酯含量*
张代娟, 刘江月, 王建英
(潍坊医学院病理生理教研室, 山东 潍坊 261053)
3,4-二羟基苯乙酮(3,4-dihydroxyacetophenone, 3,4-DHAP)是从具有活血化瘀作用的中药——秃毛冬青叶中提取的单体成分,在临床上被试用于治疗冠心病、妊娠高血压综合征和慢性阻塞性肺病等疾病,有较好的疗效;在实验水平发现3,4-DHAP具有抑制血小板聚集和抑制血栓形成等作用;另外,我们发现其还具有抗炎作用[1-2]。众所周知,动脉粥样硬化(atherosclerosis, AS)是许多心脑血管疾病的基本病理过程,其发病机制涉及炎症反应和脂质代谢异常等多方面。我们发现3,4-DHAP在AS斑块炎症反应中有较好的抗炎效果,同时也观察到其具有降脂作用:如在ApoE-/-小鼠AS模型中,3,4-DHAP可降低小鼠血浆总胆固醇(total cholesterol, TC)和甘油三酯(triglyceride, TG)[3];在新西兰大白兔AS模型中,3,4-DHAP可降低血浆TC、TG及低密度脂蛋白胆固醇,亦可降低兔肝脏的TC和TG水平[2]。3,4-DHAP通过什么途径改善肝脏脂质代谢呢?我们拟从脂质代谢的调节途径之一——AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)途径入手,揭示3,4-DHAP的降脂作用机制,为其临床推广提供实验数据。
材 料 和 方 法
1 动物
雄性新西兰大白兔,由潍坊医学院实验动物中心提供,9周龄,清洁级,体重(2.5±0.2) kg。
2 主要试剂
3,4-DHAP购自TCI;辛伐他汀粉剂购自Sigma;抗AMPK抗体、抗磷酸化AMPK(phosphorylated AMPK, p-AMPK)(Thr172)抗体、抗磷酸化固醇调节元件结合蛋白1c(phosphorylated sterol regulatory element binding protein 1c, p-SREBP-1c)(Ser372)抗体、抗磷酸化乙酰辅酶A羧化酶(phosphorylated acetyl-CoA carboxylase, p-ACC)(Ser79)抗体、qPCR试剂盒和TG试剂盒购自Sigma。
3 主要方法
3.1细胞培养、分组及处理 L02细胞由潍坊医学院段誉副教授赠送,常规传代培养,置于37 ℃、 5%二氧化碳培养箱中培养。细胞分组:正常对照(control)组、模型(model)组、3,4-DHAP组和辛伐他汀组。模型复制方法:将细胞接种在培养瓶或培养板中,当细胞生长到80%密度时,换成无血清培养液继续培养大约12 h,再用0.1 mmol/L油酸(oleic acid, OA)孵育24 h。各组药物处理如下:正常对照组(培养基),模型组(OA+培养基),3,4-DHAP组(3,4-DHAP+OA+培养基),辛伐他汀组(辛伐他汀+OA+培养基)。3,4-DHAP终浓度为10-7mol/L,辛伐他汀终浓度为10-7mol/L[3]。药物处理8 h后,收集细胞。
3.2细胞油红O染色 将细胞接种于放有盖玻片的6孔培养板内,按照方法3.1分组处理之后,倒掉培养液,用 PBS 洗涤细胞2次。用50%异丙醇固定细胞2 min。用蒸馏水将0.5%油红O储存液按2∶3比例稀释,过滤,染色10 min。倒掉染色液后用70%乙醇洗1 min,放显微镜下观察,细胞中的红色颗粒即为脂质。用异丙醇复溶油红O,在450 nm波长下检测吸光度(A)值。
3.3细胞内TG含量的检测 用PBS洗涤处理后的各组细胞2次,加入RIPA裂解液,冰浴10 min。4 ℃、 12 000×g离心10 min,取上清。上清液中的TG含量检测根据试剂盒操作说明进行。裂解液的蛋白浓度用Bradford法测得。TG含量表示为mg/g蛋白。
3.4RT-qPCR检测AMPK的mRNA表达 将细胞接种在6孔培养板中,按照方法3.1分组处理后,用PBS洗涤细胞2次,加入TRIzol液提取细胞总RNA,具体步骤按RT-qPCR试剂盒操作说明进行,具体反应程序为:95 ℃ 2 min; 95 ℃ 15 s、 60 ℃ 1 min,共40个循环。结果以2-ΔΔCt计算,引物序列见表1[4]。
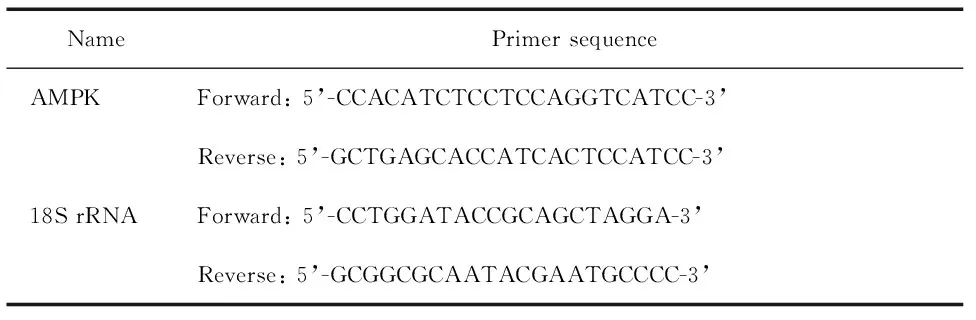
表1 RT-qPCR引物序列
3.5Western blot法检测AMPK、p-AMPK、p-SREBP-1c和p-ACC蛋白水平 将细胞接种于培养瓶中,按方法3.1处理后,在冰上用PBS洗涤细胞2次,加入细胞裂解液,提取细胞总蛋白。用Bradford法测得各组蛋白浓度。SDS-PAGE分离,转膜。分别加入I抗,室温下孵育2 h,洗涤后加入II抗,室温孵育1 h。采用化学发光法显示条带,利用凝胶成像处理系统分析条带。
3.6兔动脉粥样硬化模型造模 将适应环境1周的32只雄兔随机分为正常对照(control)组、模型(model)组、3,4-DHAP组和辛伐他汀组。正常组兔标准饮食,高脂(1% 胆固醇、 5%猪油和7.5%蛋黄粉)饲养模型组、3,4-DHAP组、辛伐他汀组兔,每只兔每天喂食饲料120 g,自由饮水。3,4-DHAP组和辛伐他汀组兔给药剂量为10 mg/kg,腹腔注射。药物处理12周后,收集肝脏标本。
3.7肝脏组织油红O染色 取各组肝脏,包埋做冰冻切片,60%异丙醇浸润2 min,油红O染色10 min,60%异丙醇调色,苏木素复染1 min,自来水冲洗返蓝,甘油明胶封片。
3.8肝脏组织TG检测 取肝组织约50 mg,加入氯仿和甲醇(2∶1)提取液2.5 mL,制作匀浆液,室温下抽提12 h,取上清,用TG试剂盒测TG含量。匀浆液的蛋白浓度用Bradford法测得。TG含量表示为mM/g蛋白。
3.9Western blot法检测肝脏组织中AMPK、p-AMPK、p-SREBP-1c和p-ACC蛋白水平 将-80 ℃冻存的肝脏组织取出约30 mg置研钵中迅速磨成粉状,加入裂解液提取蛋白。余下步骤同方法3.5。
4 统计学处理
所得实验数据以均数±标准差(mean±SD)表示,采用SPSS 18.0软件进行分析。组间采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 细胞脂化及TG含量
油红O染色结果可以看出,模型组细胞内的脂滴明显增多;3,4-DHAP及辛伐他汀处理后的细胞内脂滴较模型组明显减少,见图1A。模型组及药物处理组的细胞内TG含量较正常组均明显升高(P<0.05); 3,4-DHAP组及辛伐他汀组细胞内TG含量均比模型组显著降低(P<0.05),且3,4-DHAP组细胞内TG含量低于辛伐他汀组(P<0.05),见图1B。

Figure 1.Oil red O staining (A;×200) and the intracellular TG content (B) in L02 cells. Mean±SD.n=6.△P<0.05vscontrol group;*P<0.05vsmodel group;#P<0.05vssimvastatin group.
图1L02细胞油红O染色及TG含量
2 细胞AMPK mRNA表达水平的变化
RT-qPCR结果可以看出,模型组AMPK mRNA表达比正常组明显降低(P<0.05);3,4-DHAP及辛伐他汀处理后,两组的AMPK mRNA表达均比模型组显著增高(P<0.05),且3,4-DHAP组AMPK mRNA水平高于辛伐他汀组(P<0.05),见图2。
3 细胞AMPK、p-AMPK、p-SREBP-1c和p-ACC蛋白的表达
Western blot结果可以看出,模型组AMPK及p-AMPK蛋白表达均比正常组减少(P<0.05);3,4-DHAP及辛伐他汀处理后,两组的AMPK及p-AMPK蛋白表达均比模型组显著增加(P<0.05),且3,4-DHAP组高于辛伐他汀组(P<0.05)。与正常组比较,模型组的p-SREBP-1c和p-ACC明显减少(P<0.05);与模型组比较,3,4-DHAP及辛伐他汀组的p-SREBP-1c和p-ACC明显增加(P<0.05),且3,4-DHAP组高于辛伐他汀组(P<0.05),见图3。
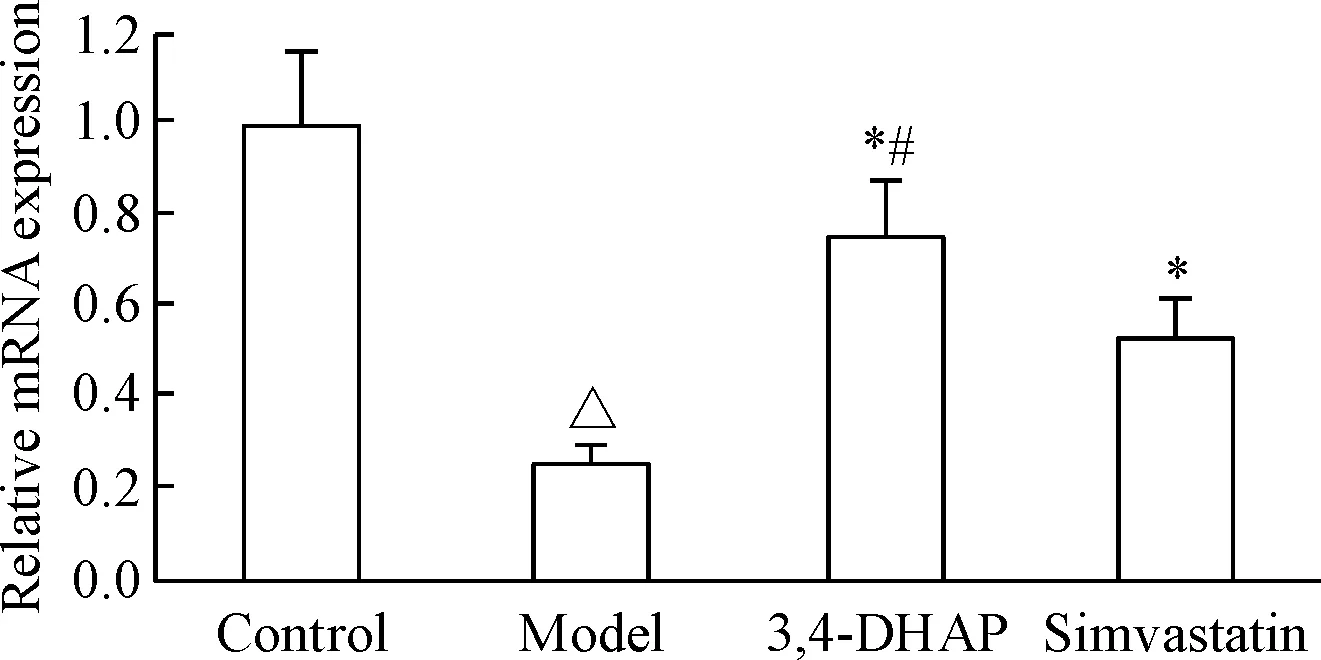
Figure 2.The RT-qPCR results of AMPK mRNA expression in L02 cells. Mean±SD.n=6.△P<0.05vscontrol group;*P<0.05vsmodel group;#P<0.05vssimvastatin group.
图2各组L02细胞AMPKmRNA的表达
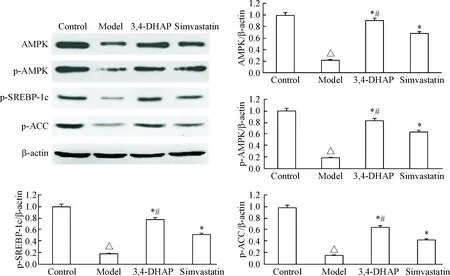
Figure 3.The Western blot results of AMPK, p-AMPK, p-SREBP-1c and p-ACC protein levels in L02 cells. Mean±SD.n=6.△P<0.05vscontrol group;*P<0.05vsmodel group;#P<0.05vssimvastatin group.
图3各组L02细胞AMPK、p-AMPK、p-SREBP-1c和p-ACC蛋白的表达
4 肝脏组织冰冻切片油红O染色及TG含量
与正常组比较,模型组肝脏切片中脂滴增加,TG含量亦增加(P<0.05);与模型组比较,3,4-DHAP及辛伐他汀组脂滴及TG含量减少(P<0.05),但两组间差异无统计学意义,见图4。
Figure 4.Oil red O staining (A;×40) and the hepatic TG content (B) in rabbits. Mean±SD.n=8.△P<0.05vscontrol group;*P<0.05vsmodel group.
图4兔肝脏油红O染色及TG含量
5 肝脏组织中AMPK、p-AMPK、p-SREBP-1c和p-ACC的蛋白表达
Western blot可以看出,模型组的AMPK及p-AMPK蛋白表达均低于正常组(P<0.05);3,4-DHAP及辛伐他汀处理后,2组的AMPK及p-AMPK蛋白表达均比模型组增加(P<0.05),但两组间差异无统计学意义。与正常组比较,模型组的p-SREBP-1c及p-ACC明显减少(P<0.05);与模型组比较,3,4-DHAP及辛伐他汀组p-SREBP-1c和p-ACC明显增加(P<0.05),但两组间差异无统计学意义,见图5。
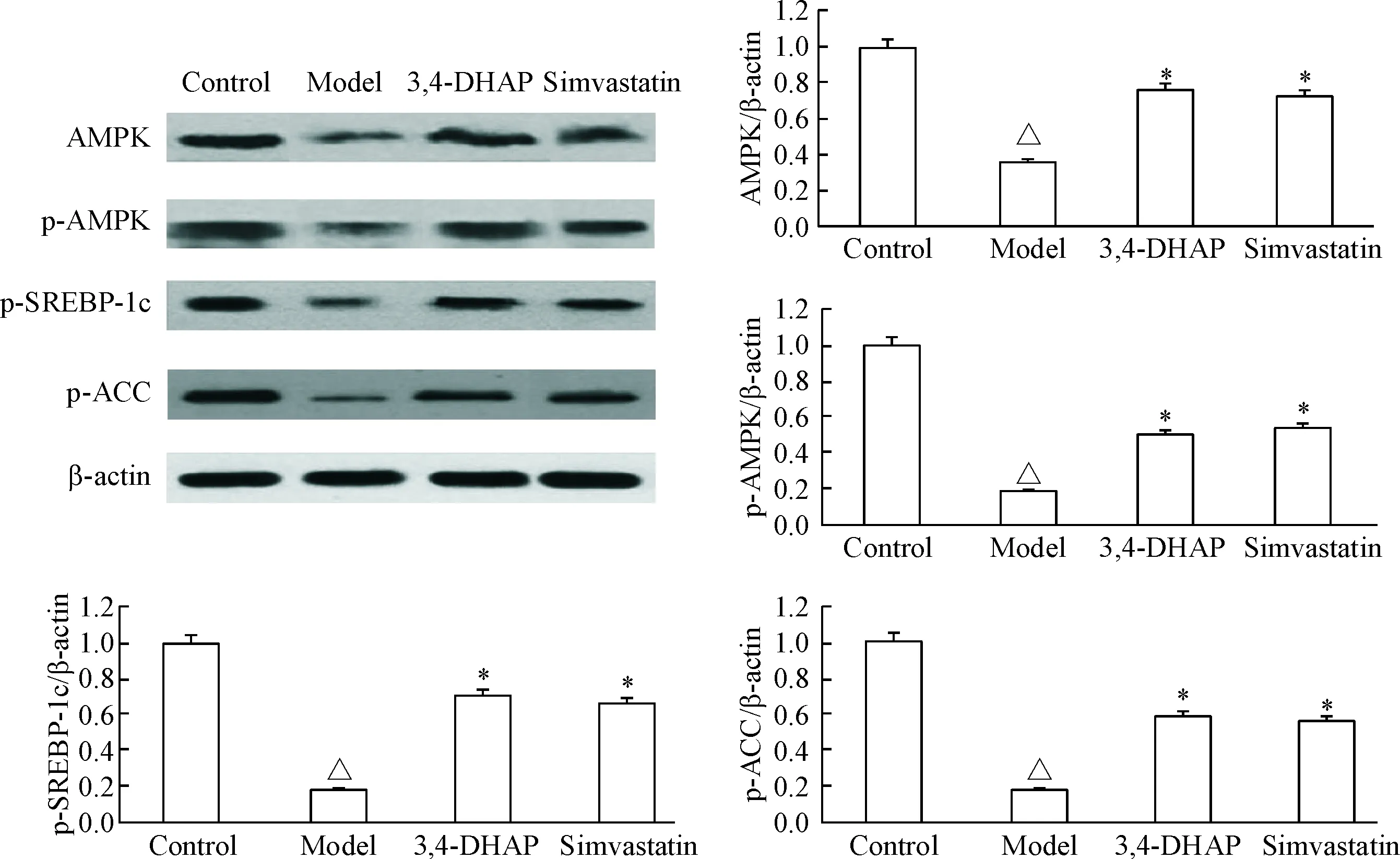
Figure 5.The Western blot results of AMPK, p-AMPK, p-SREBP-1c and p-ACC protein levels in the liver of rabbits. Mean±SD.n=8.△P<0.05vscontrol group;*P<0.05vsmodel group.
图5各组兔肝脏组织中AMPK、p-AMPK、p-SREBP-1c和p-ACC蛋白的表达
讨 论
前期工作中,鉴于AS的炎症反应学说和脂质浸润学说,我们在细胞、ApoE-/-小鼠和新西兰大白兔3种不同的AS模型上进行了抗炎降脂药理实验。我们研究的药物3,4-DHAP是具有活血化瘀作用的传统中药秃毛冬青叶的有效成分,以往研究发现其具有舒张血管,改善血流动力学等作用。而我们在兔AS模型中发现3,4-DHAP不仅能减轻斑块中的炎症反应,还能降低血脂[2];在ApoE-/-小鼠AS模型中亦有同样的发现。但3,4-DHAP的降脂机制尚不清楚,为此,我们拟研究其降脂机制。
AMPK途径是脂质代谢的重要调节途径,该途径被激活后,可降低TC及TG[4],其调节机制为:(1)失活脂肪酸和TG合成所需关键酶,如ACC,抑制脂肪酸和TG的合成;(2)调节激素敏感性脂解酶的活性,促进TG降解;(3)调节脂肪酸、胆固醇合成过程中的一些转录因子,如SREBP-1c,降低脂肪酸和TC含量[5]。本研究发现:3,4-DHAP可增加AMPK的mRNA及蛋白表达,并能增强其磷酸化过程(即增强活性),从而降低肝细胞及肝脏组织的脂质含量。AMPK磷酸化后也可以调节一些转录因子,因此,我们对其下游调节因子如SREBP-1c进行了研究。SREBP-1c被激活后可进入核内,调节与肝脏脂肪酸、TG合成有关的靶基因转录,如ACC、脂肪酸合成酶等,使脂肪酸、TG合成增多;若SREBP-1c被p-AMPK磷酸化之后,入核被抑制,其调节作用亦被抑制,导致脂肪酸和TG合成减少[6]。我们发现,在细胞及肝脏中,3,4-DHAP能增强SREBP-1c磷酸化过程,该过程可能是上游的AMPK活性增强引起的;SREBP-1c磷酸化增强,入核受抑制,从而导致TG合成减少。另外,多种脂质代谢关键酶,如ACC,亦参与调节脂质代谢过程[7]。在脂肪酸合成过程中,ACC是限速酶,有ACC1和ACC22种亚型。ACC1能促进脂肪酸合成[8],被p-AMPK磷酸化后,活性受到抑制,脂肪酸合成减少。ACC1亦是SREBP-1c调节的下游靶基因[9],SREBP-1c磷酸化后失去了调节作用。在实验中,药物处理后,SREBP-1c磷酸化增加,在基因水平可减少ACC1转录,我们推测脂质减少一方面与ACC1磷酸化水平增加有关,另一方也与ACC1基因转录、蛋白表达减少有关。另外,我们发现,在细胞水平,3,4-DHAP与辛伐他汀的降脂作用有显著差异,而在整体水平上,两者降脂作用的差异无显著性,机制不清,有待进一步研究。此外,脂质代谢的其它调节途径,如过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptors-α, PPARα)途径[10]和肝X受体(liver X receptors,LXRs)途径[11]等,本研究没有涉及到,亦有待进一步研究。
综上所述,我们在肝细胞和肝脏组织中观察了3,4-DHAP对脂质代谢调节途径——AMPK途径的影响;研究结果提示,3,4-DHAP可能通过作用于AMPK途径,降低肝细胞及肝脏组织中的TG含量。

