盐酸小檗碱通过PI3K/Akt信号通路促进小鼠前成骨细胞MC3T3-E1的分化*
江 健, 廖莉娅, 容 婵, 陈捷侨, Ashish SHRESTHA, 刘星琦, 苏 雅, 舒晓春△
(1中山大学附属第五医院, 广东 珠海 519000; 2南方医科大学附属顺德医院, 广东 佛山 528300)
骨质疏松症(osteoporosis)是最常见的代谢性骨骼疾病,其特点是骨量减低,骨质强度减弱,骨微结构破坏,从而骨折的风险增加[1]。随着人口老龄化的不断增加,我国作为世界上老年人口绝对数最大的国家,正面临着骨质疏松症高患病率的严峻的挑战,据统计,我国50岁以上人群骨质疏松症患病率女性为20.7%,男性为14.4%[2]。目前治疗骨质疏松症的药物主要是抑制骨吸收药物,包括双膦酸盐、降钙素和雌激素[3]。然而,有研究表明这些药物的使用可能引起一些副作用,包括骨坏死、非典型股骨骨折和食道癌等[4]。因此,探索更加安全、健康的天然药物来治疗骨质疏松显得尤为重要,已有研究发现一些天然药物,如骨碎补总黄酮、淫羊藿苷和盐酸小檗碱等都有促进成骨分化和抗骨质疏松的潜能[5-7]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)通路是与新陈代谢、增殖、分化及凋亡关系密切的信号通路[8],蛋白激酶B(protein kinase B, PKB/Akt)是PI3K激活的主要信号分子,它随后通过磷酸化对下游的多种物质产生作用[9]。此外,PI3K/Akt信号通路在成骨和破骨细胞的形成、分化以及氧化损伤的调节中起着重要作用[10-13]。盐酸小檗碱(berberine,BBR)是一种生物碱,如今,关于BBR促进成骨细胞分化的作用机制仍不是十分清楚。本研究通过探讨BBR对前成骨细胞分化与矿化的影响,检测成骨细胞相关分化分子的表达情况,并探讨其机制是否与BBR激活PI3K/Akt信号通路有关,为进一步促进黄连素的临床应用提供实验依据。
材 料 和 方 法
1 材料
1.1细胞 小鼠前成骨细胞系MC3T3-E1由南方医科大学提供。
1.2药物和主要试剂 盐酸小檗碱(纯度>98%)购于东京化成工业株式会社;PI3K/Akt 信号通路特异性抑制剂LY294002(碧云天生物公司);α-MEM细胞培养基(Gibco);四季青胎牛血清(浙江天航生物科技有限公司); CCK-8试剂盒(同仁化学研究所);BCA蛋白检测试剂盒(凯基生物公司);碱性磷酸酶(alkaline phosphatase, ALP)活性检测试剂盒(南京建成生物公司);real-time PCR所用引物及定量检测SYBR Green(上海生物工程公司);茜素红S染液(翔博生物公司);抗体β-actin (Santa Cruz);抗体p-Akt(CST);羊抗小鼠及羊抗兔Ⅱ抗(Abclonal);极超敏ECL化学发光试剂盒(碧云天生物公司)。
2 主要方法
2.1前成骨细胞MC3T3-E1的培养 细胞复苏后加入4 mL完全培养基,置于37 ℃、CO2体积分数为5%的培养箱中培养,每2 d换液一次,显微镜观察细胞生长状况,待细胞生长融合到80%后,PBS洗2遍,加入0.25%胰蛋白酶2 mL,37 ℃静置1 min, 加入4 mL完全培养基终止消化,800 r/min离心5 min,弃上清, 加入4 mL完全培养基重悬细胞,接种到培养瓶中,37 ℃、CO2体积分数为5%的培养箱中静置培养。
2.2细胞活性测定 细胞接种在96孔板中,密度为每孔3 000个细胞,待细胞基本融合后,采用不同浓度(0,1,5,10和20 mg/L)的盐酸小檗碱进行干预,3 d后,使用CCK-8试剂盒检测细胞活性。每孔加入含10% CCK-8试剂的培养基100 μL,37 ℃孵育4 h,酶标仪选择450 nm波长检测其吸光度(A)值。计算细胞活性,结果用与对照组的百分比表示。
2.3碱性磷酸酶活性的测定 MC3T3-E1细胞按1×108cells/L的密度接种2 mL于6孔板中,待细胞融合至80%,加不同浓度(0、1、5、10和20 mg/L)的盐酸小檗碱分别培养3 d和7 d,每2 d更换一次培养基。测定步骤参照ALP检测试剂盒提供的方法:弃除培养基后,PBS清洗2遍,加入含有1% Triton X-100的细胞裂解200 μL,冰上裂解30 min,低温离心机4 ℃、12 000 r/min离心15 min。取上清液用BCA蛋白试剂盒测定蛋白浓度,用ALP检测试剂盒在酶标仪波长520 nm处检测其A值,计算碱性磷酸酶活性。
2.4成骨细胞分化相关因子mRNA水平表达情况的测定 成骨细胞分化相关因子ALP、骨钙素(osteocalcin, OCN)、骨桥蛋白(osteopontin, OPN)及Runt相关转录因子2(Runt-related transcription factor 2, Runx2)是成骨分化实验重要的检测指标。本实验将前成骨细胞按1×108cells/L密度接种2 mL于6孔板中培养,待细胞基本融合后,实验分为对照(control)组,BBR组,BBR+LY249002组和LY249002组,BBR+LY249002组及LY249002组加入含抑制剂(10 mmol/L LY294002)的无血清培养基预处理1 h,吸净培养液,后分别加入含药(5 mg/L BBR)培养基和普通培养基,培养48 h,后用PBS洗2遍,加入200 μL TRIzol reagent提取细胞总RNA。逆转录试剂盒购于TaKaRa,每10 μL的逆转录体系含总RNA 600 ng。Real-time PCR分析采用SYBR Green real-time PCR试剂盒,引物如表1所示,反应条件: 95 ℃ 3 min; 95 ℃ 15 s, 60 ℃ 30 s,共40个循环。GAPDH作为内参照,数据使用2-ΔΔCt方法进行分析。

表1 Real-time PCR引物序列
2.5Western blot检测PI3K/Akt通路相关蛋白的表达 细胞按1×108cells/L的密度接种4 mL于直径为60 mm的培养皿中,待细胞融合至80%后,对各实验组(对照组、BBR组、BBR+LY249002组和LY249002组)做相应的处理,药物干预48 h后,用PBS洗2遍,加入200 μL的细胞蛋白裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂),冰上裂解30 min。4 ℃、12 000×g离心15 min,收集上清液。用BCA蛋白试剂盒测定蛋白浓度,加入上样缓冲液在100 ℃加热10 min进行蛋白变性。每孔加入等量的蛋白质(10 μg)进行10% SDS-PACE,200 mA转膜120 min。QuickBlockTM封闭液封闭30 min,加入Ⅰ抗4 ℃条件下孵育过夜,TBST洗膜3次,首次15 min,其余10 min,加入Ⅱ抗孵育1 h,TBST清洗3次。用ECL进行发光显影,通过蛋白条带灰度分析进行定量测定。
2.6茜素红S染色及半定量测定 MC3T3-E1细胞按2×107cells/L的密度接种1 mL于24孔板中,普通培养基培养24 h,分为4个处理组(对照组、BBR组、BBR+LY249002组和LY249002组),经过药物和抑制剂处理以后加入细胞诱导分化培养基(10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸)培养21 d,培养基每2 d换一次,诱导分化完成后,PBS冲洗2遍,用70%乙醇固定1 h,后PBS冲洗3遍,用茜素红S染液(40 mmol/L,pH 4.2)37 ℃染色1 h。染色完成后用无钙、镁离子的PBS冲洗5遍,显微镜下观察矿化结节形成情况。用100 nmol/L的氯化十六烷基吡啶溶液溶解染色后的矿化结节,并用酶标仪在波长为540 nmol/L处测定各实验组的A值。
3 统计处理
采用SPSS 20.0软件进行单因素方差分析,结果以均值±标准差(mean±SD)表示。以P<0.05为差异具有统计学意义。
结 果
1 盐酸小檗碱在一定浓度内对MC3T3-E1细胞活性无影响
CCK-8实验结果显示,与对照组比较,不同浓度盐酸小檗碱干预后,细胞活性没有明显差异,见图1。
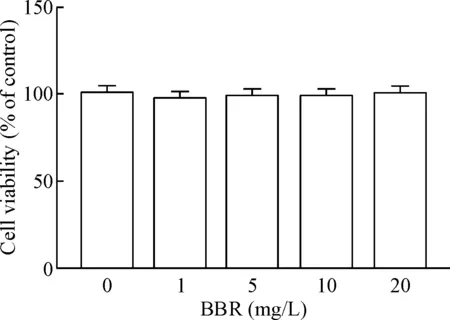
Figure 1.Effects of BBR at different concentrations on the viabi-lity of MC3T3-E1 cells. Mean±SD.n=3.
图1不同浓度盐酸小檗碱对MC3T3-E1细胞活性的影响
2 盐酸小檗碱增加前成骨细胞ALP活性
MC3T3-E1细胞经不同浓度的盐酸小檗碱培养3 d后,5 mg/L BBR组的ALP活性明显高于对照组(P<0.01);加药培养7 d,与对照组相比,不同浓度BBR组的ALP活性都有增加,其中5 mg/L BBR组的ALP活性最高,因此,后续实验中BBR组均采用5 mg/L这一浓度,见图2。
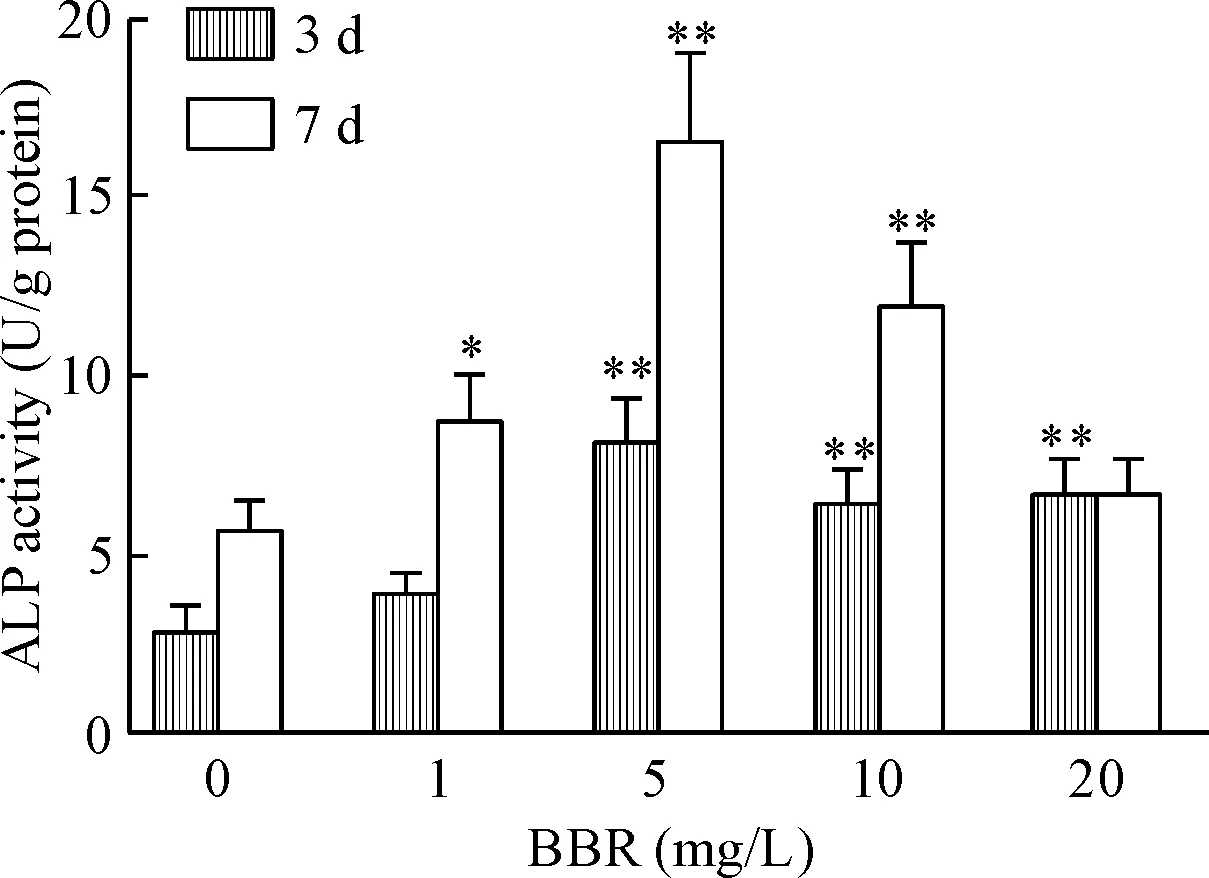
Figure 2.Effects of BBR at different concentrations on ALP activity in MC3T3-E1 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 mg/L group at the same time.
图2不同浓度盐酸小檗碱对MC3T3-E1细胞ALP活性的影响
3 盐酸小檗碱促进MC3T3-E1细胞成骨分化相关因子的表达,其作用被LY249002抑制
与对照组相比,BBR处理显著提高MC3T3-E1细胞ALP、OCN、OPN和Runx2的mRNA表达(P均<0.01);与BBR处理组相比,BBR+LY294002组与LY294002组的成骨分化相关因子的mRNA表达均明显减低(P<0.01),见图3。
4 盐酸小檗碱促进MC3T3-E1细胞p-Akt蛋白的表达,其作用被LY249002抑制
Western blot分析显示,与对照组相比,BBR组p-Akt蛋白表达显著增加(P<0.01),而BBR+LY294002组与LY294002组p-Akt的表达均明显降低(P<0.01),见图4。说明盐酸小檗碱能促进Akt磷酸化,激活PI3K/Akt信号通路,而LY294002能抑制盐酸小檗碱对PI3K/Akt信号通路的激活作用。
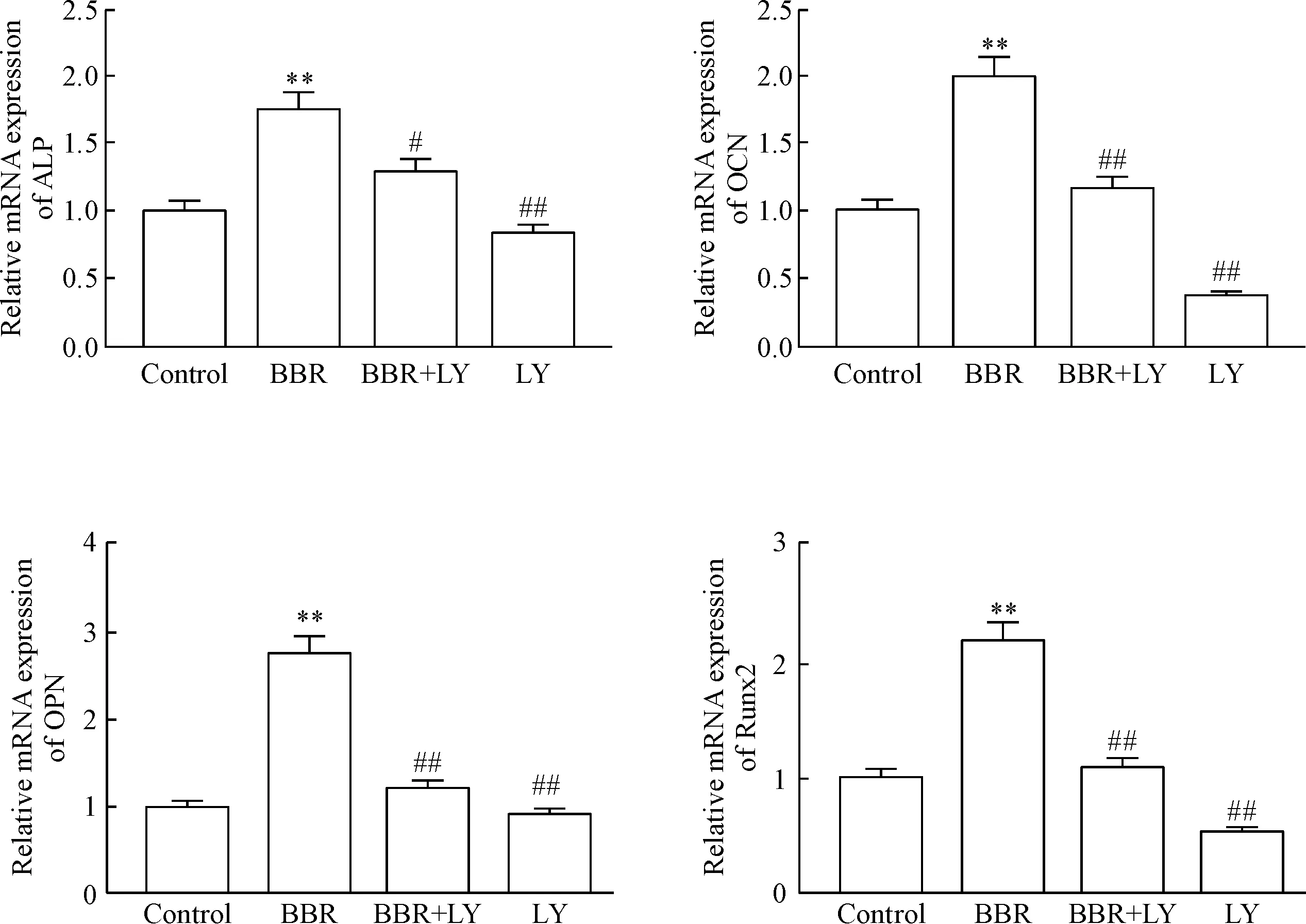
Figure 3.Effects of BBR and PI3K/Akt pathway inhibitor LY249002 (LY) on the mRNA expression of the molecules related to osteogenic differentiation in MC3T3-E1 cells. Mean±SD.n=3.**P<0.01vscontrol group;#P<0.05,##P<0.01vsBBR group.
图3盐酸小檗碱与PI3K/Akt信号通路抑制剂LY249002对MC3T3-E1细胞成骨分化相关因子mRNA表达的影响
5 盐酸小檗碱促进MC3T3-E1细胞的矿化,其作用被LY249002抑制
经矿化诱导培养基培养21 d,茜素红S染色后矿化结节呈红色。与对照组相比,BBR组钙结节形成明显;与BBR处理相比,BBR+LY294002组及抑制剂LY294002处理组细胞钙沉积面积明显减少。溶解矿化结节进行定量分析,检测数据表明,BBR组矿化结节溶解液的吸光度明显高于对照组;BBR+LY294002组及LY294002处理组矿化结节溶解液的吸光度明显低于BBR组(P<0.01),见图5。这说明盐酸小檗碱能促进前成骨细胞的矿化,而LY294002能抑制盐酸小檗碱促进前成骨细胞的矿化作用。
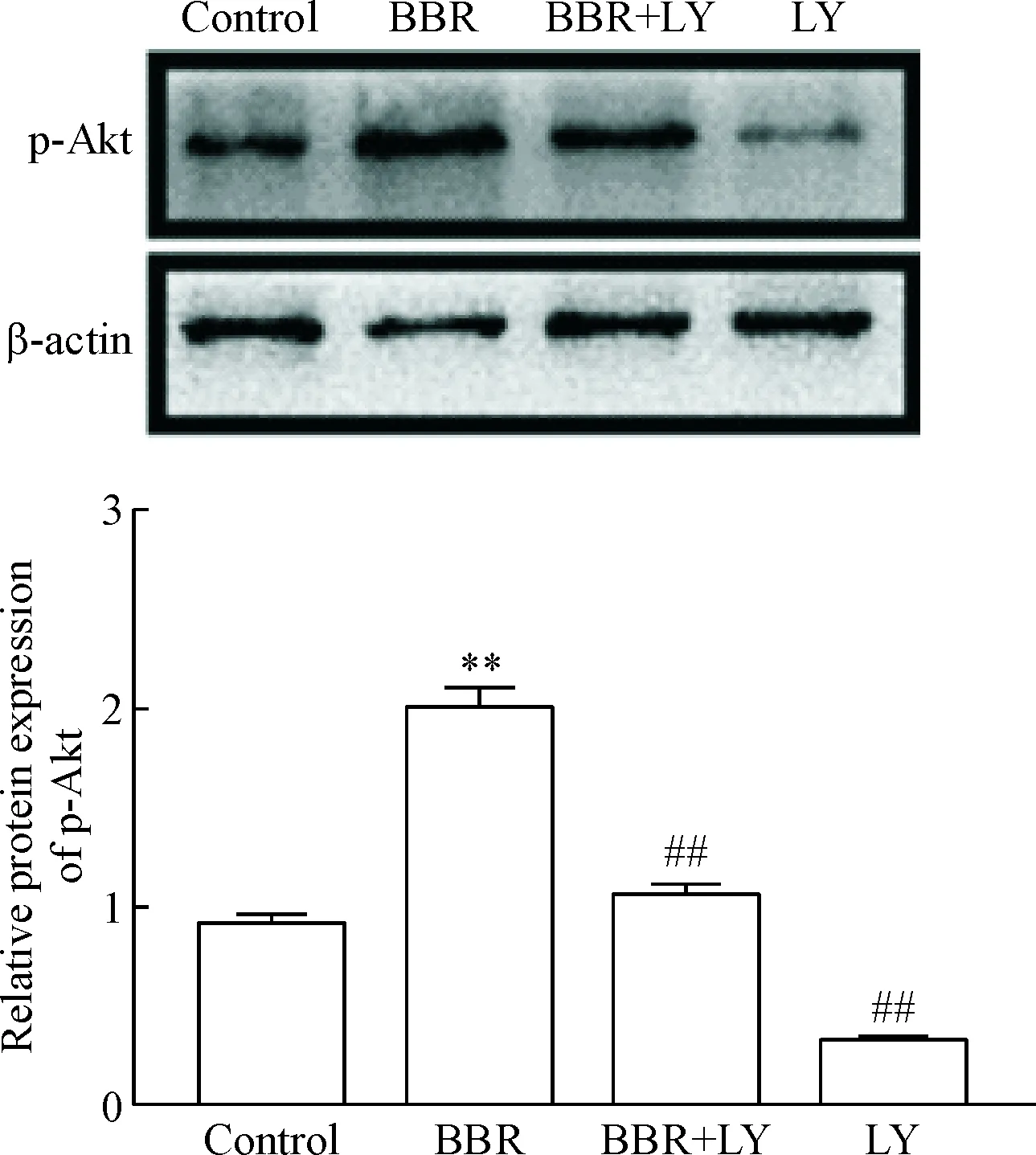
Figure 4.Effects of BBR and PI3K/Akt pathway inhibitor LY249002(LY) on the expression of p-Akt protein associated with PI3K/Akt signaling pathway in MC3T3-E1 cells. Mean±SD.n=3.*P<0.01vscontrol group;##P<0.01vsBBR group.
图4盐酸小檗碱与PI3K/Akt信号通路抑制剂LY249002对MC3T3-E1细胞PI3K/Akt信号通路相关蛋白p-Akt表达的影响
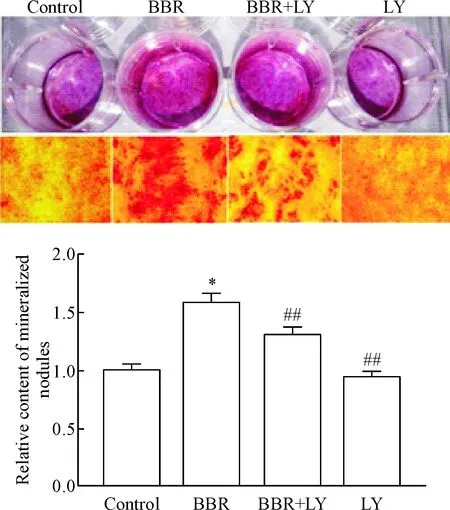
Figure 5.Effects of BBR and PI3K/Akt pathway inhibitor LY249002(LY) on mineralization of MC3T3-E1 cells (alizarin red S staining, ×40). Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsBBR group.
图5盐酸小檗碱与PI3K/Akt信号通路抑制剂LY249002对MC3T3-E1细胞矿化的影响
讨 论
骨质疏松症是全球范围内日益严重的公共健康问题,其防治与愈后也受到国内外学者的高度关注,然而,目前用于治疗骨质疏松的药物存在一定的副作用,以及疗效受其他药物影响,从而一定程度上限制其使用。因此寻求和研发安全,有效的抗骨质疏松药物是目前亟待解决的问题。
BBR是一种从中草药中分离出来的异喹啉类生物碱[14],具有多种药理作用,包括抗菌[15]、抗肿瘤[16]、抗炎[17]、抗氧化及抗凋亡[18]等,最新研究发现BBR可在抗骨质疏松中发挥重要作用[19]。有研究表明BBR可通过介导p38 MAPK/Runx2信号通路直接促进骨髓间充质干细胞(mesenchymal stem cells, MSCs)的成骨分化[5]。另一项研究指出,BBR不仅可以通过增强Runx2的表达,还可以通过激活经典的Wnt/β-catenin信号通路来刺激MSCs的成骨分化[20]。在本研究中,我们发现BBR可能通过激活前成骨MC3T3-E1细胞中的PI3K/Akt信号通路,从而促进前成骨细胞的分化和钙化。为阐明BBR对前成骨细胞分化的调控作用,我们检测了不同浓度BBR对前成骨细胞碱性磷酸酶活性的影响,此外,本实验还对成骨细胞分化相关分子ALP、OCN、OPN和Runx2进行了研究。成骨细胞分化相关分子中, Runx2属于转录因子Runx家族成员,是成骨细胞分化和骨形成最关键的转录因子之一[21],它可以有效地启动主要骨基质蛋白基因的表达。
据报道,Runx2能够改善PI3K信号通路的活性,增加p85、p110β和Akt的蛋白表达,同时PI3K/Akt信号通路又可以改善Runx2和Runx2转录所依赖的DNA分子结合[22],它们在成骨细胞分化调控中相互依赖。此外,Runx2可以通过与启动子结合,上调成骨基因OPN和OCN的表达来调控成骨细胞的分化[23]。成骨细胞分化过程分为2个阶段,在第一阶段,ALP的表达促进细胞分化,ALP是成骨细胞分化早期最常用的标志物之一,同时它也是一种重要的酶,能催化和上调成骨细胞分化基因OPN的表达[24];在第二阶段,通过钙沉积而使基体矿化,在原始软骨周围形成一层海绵状的骨组织,然后海绵状骨充满骨基质,成为致密骨,从而增进骨的钙化使硬度增加[25]。因此,ALP活性作为早期分化标志物,OCN是成骨细胞分化的终末标志,代表成骨细胞的成熟和基质矿化过程。本研究发现,BBR有明显增强MC3T3-E1细胞ALP活性与增加MC3T3-E1细胞钙结节形成的作用,在药物浓度为5 mg/L时作用最为明显。Real-time PCR分析显示,BBR增加了ALP、OPN、OCN和RUNX2的mRNA表达。然而,PI3K/Akt抑制剂LY294002抑制了该药物的促进作用,表明BBR刺激MC3T3-E1成骨分化的能力可能通过PI3K/Akt信号通路参与调节。
PI3K/Akt信号通路在细胞增殖、分化、黏附和凋亡中起着重要作用[26]。Akt是PI3K/Akt信号通路的关键蛋白之一,作为PI3K下游关键的激酶,是细胞增殖、生长和存活的主要介导因子[27]。p-Akt作为Akt激活后的介导物质,通过激活PI3K/Akt信号通路下游的动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),从而干扰细胞凋亡并促进增殖和运动[28]。PI3K/Akt信号通路在神经细胞以及心肌细胞缺血保护中起着重要作用[29]。此外,许多研究表明PI3K/Akt信号通路与骨组织代谢之间存在密切关系, 在成骨细胞中,活化PI3K/Akt信号通路能刺激细胞的增殖和分化,同时也能抑制细胞凋亡[30]。在治疗骨质疏松症的药物中,很多药物的作用通过对PI3K/Akt通路的调控来完成,如丹参素通过活化P13k/Akt通路减少骨质疏松大鼠中成骨细胞的凋亡[31];淫羊藿苷通过调节PI3K/Akt通路对糖皮质激素引起的骨质疏松症具有一定的防治作用[6]。为了探究PI3K/Akt通路是否在BBR促进MC3T3-E1细胞分化和矿化过程中起着重要作用,我们在MC3T3-E1细胞干预中使用PI3K/Akt通路特异性抑制剂LY294002,Western blot结果表明与对照组相比,BBR组促进了MC3T3-E1细胞p-Akt蛋白的表达,而LY294002预处组p-Akt蛋白的表达明显下降。同样,LY294002预处理组,ALP、OCN、OPN和Runx-2的mRNA表达也有明显下降趋势,但BBR组的mRNA表达明显增加。这些结果表明PI3K/Akt通路可能在BBR对MC3T3-E1细胞的分化和钙化的调控中起着重要作用。
综上所述,BBR具有促进前成骨细胞分化和矿化的作用,其作用机制可能是通过激活PI3K/Akt信号通路来完成。因此,BBR有治疗骨质疏松症的潜能,为临床使用BBR治疗骨质疏松提供相应的实验依据,但该信号通路下游的调节机制尚有待进一步研究。

