SD大鼠脊髓损伤后微环境中髓鞘相关抑制因子的表达
贾叙锋, 龙 苗, 戢 勇, 黄光平, 周 玉, 冯大雄
(1. 简阳市人民医院骨科, 简阳 641400, 2. 西南医科大学附属医院脊柱外科, 泸州 646000)
脊髓损伤(SCI)常造成神经元坏死凋亡,导致脊髓功能永久性障碍,是创伤后残疾的重要诱因,因此, 了解SCI后再生机制,对指导临床,降低致残率具有重要意义。既往报道[1-3]证实勿动蛋白-A(neurite outgrowth inhibitor-A,Nogo-A)、髓鞘相关糖蛋白(myelin associated glycoprotein,MAG)、少突胶质细胞髓鞘糖蛋白(oligodendrocyte myelin glycoprotein,OMgp)等髓鞘相关抑制因子是SCI后轴突再生的关键因子,通过与受体结合,激活下游信号转导通路,抑制轴突再生,在抑制脊髓轴突再生过程中发挥重要作用,但临床对上述因子表达规律的研究尚少见,本实验通过大鼠试验观察SCI后髓鞘相关抑制因子的表达规律,为临床干预提供参考,现报道如下。
1 材料与方法
1.1 实验动物
选取清洁级雌性SD大鼠, 125只, 体质量200~220 g, 由泸州医学院动物实验中心 [SCXK(川)2013-17]提供, 在20 ℃、30%相对湿度环境下饲养于屏障设施[SYXK(川)2013-065], 适应性饲养1周, 制作SCI动物模型。本实验经泸州医学院实验动物使用与管理委员会批准[IACUC(川)2014-13], 实验过程基于3R原则对实验动物给予人道主义关怀。
1.2 实验动物分组
采用随机数字表分为5组,每组各25只。A组为假手术组,B、C、D组按照改良Allen’s法,根据致伤势能和高度大小依次为B组[20 g×5 cm,致伤势能100 gcf (gram-cm force)],C组(20 g×10 cm,致伤势能200 gcf),D组(20 g×15 cm,致伤势能300 gcf),E组为脊髓全切组。每组分别在术后1 d、5 d、7 d、14 d、28 d五个时间点观察,每个时间点5只大鼠。
1.3 主要实验试剂及仪器
戊巴比妥钠(EINECS号: 261-776-6)购自美国Sigma公司; RZ裂解液购自天根生化科技(北京)有限公司; 紫外可见分光光度计购自武汉集思仪器设备有限公司(型号UV-1801); 电泳仪购自美国Bio-Rad公司; Fresco低温冷冻离心机购自美国Thermolyne公司; 一抗和二抗试剂盒均购自武汉博士德生物制品有限公司; 染色试剂盒购自河北博海生物工程有限公司。撞击器由本院自制,主要包括SDQ307射钉枪、撞击杆(长19 cm,直径0.8 cm)、圆形撞击头(半径1 cm)、撞击杆套筒(长25 cm,内径2.4 cm)及挡板(长3.5 cm)5个部分,材料均为优质钢材制成,撞击器撞击力采用CL型拉压力传感器和DH5932型数据采集记录仪测定。
1.4 实验方法
1.4.1 Allen’s SCI模型的构建 以体积分数3%戊巴比妥钠进行腹腔注射麻醉,1.0 mL/kg,麻醉满意后俯卧固定,以胸椎最大弯曲处为中心,做长约3~5 cm的切口,暴露T9段脊髓约3 mm×4 mm。A组仅进行脊髓暴露, 不损伤脊髓。B、C、D组用自制撞击器分别以20 g×5 cm, 致伤势能100 gcf;20 g×10 cm,致伤势能200 gcf; 20 g×15 cm,致伤势能300 gcf模式致伤大鼠T9段脊髓,形成不同致伤程度的急性SCI模型,设置冲击棒直径为3 mm。E组将暴露的T9段脊髓用小尖刀反复完全切割4~5次。所有模型动物均单只隔离,常规标准饲养(图1)。
1.4.2 Western blotting分析 将Western和IP细胞裂解液溶解混匀, 在实验前加入适量裂解液备用,组织切片后, 以20 mg组织+100 μL裂解液比例配制,充分裂解,4 ℃下离心20 min, 4 000 r/min, 取上清液1 mL。用紫外分光光度法检测样本280 nm处的吸光度,计算蛋白浓度。测定蛋白分子量后配制10%分离胶,浓缩胶浓度5%。在160 V分离胶恒压、90 V/20 min浓缩胶恒压条件下进行电泳,结束后以300 mA恒定直流、0.45 μm微孔径硝酸纤维素(NC)膜进行转膜,1 h后染色,用封闭液封闭1 h,室温下一抗孵育10 min,TBST洗膜5 min/次,共3次,再进行二抗孵育,TBST洗膜5 min/次,共3次,完成后暗室曝光,定影。蛋白条带灰度值采用Adobe PhotoshopCS5软件分析,以GAPDH作为内参蛋白,相对分子表达量=目的蛋白条带灰度值/GAPDH条带灰度值。

图1 SD大鼠SCI模型的制作过程Figure 1 The model of spinal cord injury in SD rats
1.4.3 观察指标及方法 观察大鼠的死亡率、存活时间等。分别在建模前和术后1 d根据脊髓运动功能评定标准(Basso-Beattle-Bresnahan,BBB)记录大鼠后肢运动功能[4],BBB评分范围0~21分,评分越高,运动功能越好。
1.5 统计学方法
选用SPSS19.0软件对数据进行处理, 计量资料以表示,组间多时点对比采用重复测量的方差分析, 单一时点的对比采用多变量的方差分析,两两对比采用LSD检验, 计数资料以(%)表示, 组间比较行卡方检验, 以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察
造模后SD大鼠死亡24只, 死亡率19.20%(24/125),死亡均发生在建模手术1 d以后,各组间死亡率差异显著(X2=17.739,P=0.001),以E组死亡率为最高,详见表1。
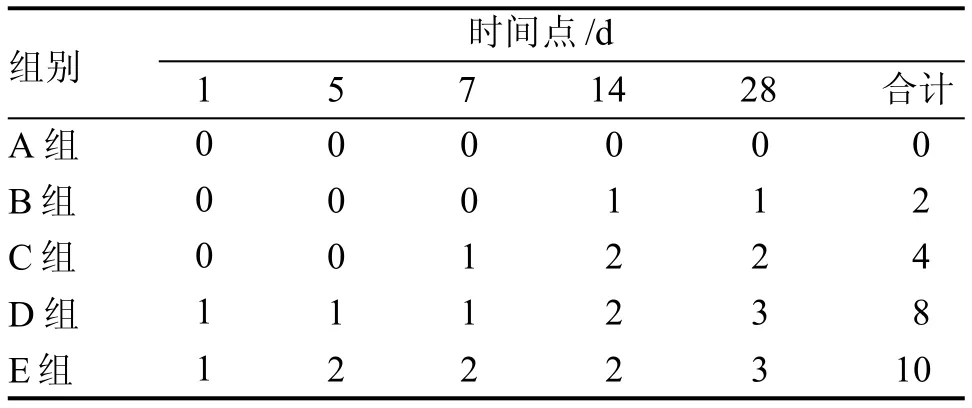
表 1 SD大鼠各组不同时间点的死亡数Table 1 Mortalities at different time points in the SD rats of each group
2.2 手术建模前后运动功能比较
A组手术前后BBB评分差异无统计学意义(P>0.05),B、C、D及E组,4组术后1 d时BBB功能评分较术前均显著降低(P<0.05)(表2)。
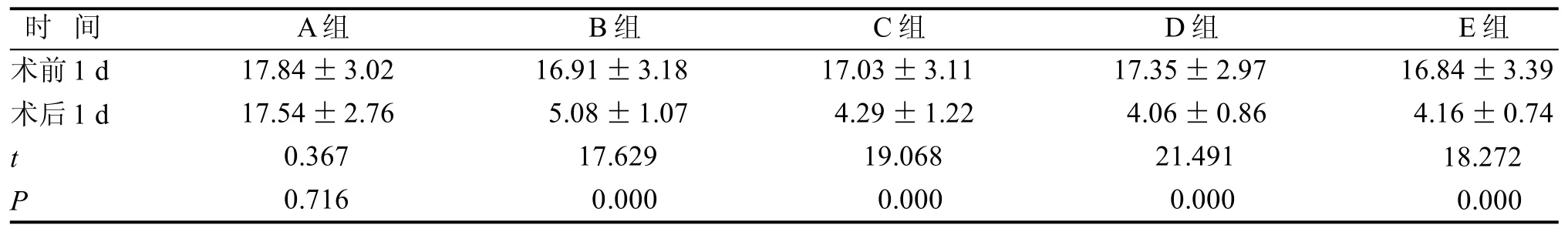
表 2 手术建模前后运动功能评分比较Table 2 The comparison of motor function scores before and after operation modeling
2.3 组织髓鞘相关抑制因子的表达
B、C、D、E各组SCI后1 d即可见Nogo-A、MAG、OMgP 表达(图2),Nogo-A和MAG的表达在7 d表达最高, 14 d后逐步降低,到28 d后逐渐恢复到A组水平。MAG和Nogo-A在7 d相对表达量与本组其他时间点比较,差异有统计学意义(P<0.05)。OMgp 在 SCI后 5 d后达到高峰, 到 14 d后逐渐恢复至A组水平,在5 d的相对表达量与本组其他时间点比较,差异有统计学意义(P<0.05)。随致伤势能增高,Nogo-A、MAG、OmgP 时点表达呈上升趋势,D、E组同时间表达量比较差异无统计学意义(P>0.05)(表3)。
3 讨论
SCI为常见脊柱疾病,其发病机制目前认为与神经元死亡有关,可导致损伤平面下脊柱功能不同程度的受损,而目前SCI的相关分子生物学研究较少。SCI后轴突生长抑制分子表达是影响中枢神经系统轴突再生的关键因素,Nogo-A、MAG及OMgP均由少突胶质细胞表达在髓鞘与轴突相邻的膜表面,存在于脊髓白质中,以往研究提示轴突生长抑制因子在SCI后有不同程度表达[5]。本研究利用动物模型进一步分析Nogo-A、MAG、OMgp在SCI后表达规律。Allen’s脊髓撞击损伤模型是目前临床较为成熟且常用的动物实验模型,该模型模拟实际损伤环境,能量化致伤势能强度,与人类SCI一致性满意,且具有较高的重复性。SD大鼠较其他鼠种具有较高的抗病性,且对试验打击耐受性强[6,7],本实验以SD大鼠为试验对象,建立Allen’s大鼠模型,结果显示B、C、D、E四组术后1 d时BBB功能评分较术前显著降低,提示建模成功,建模手术成功后采用Western blotting印迹法分析Nogo-A、MAG及OMgp在SD大鼠SCI中的相对表达量,并通过对比损伤后不同致伤势能和不同时点的分子表达量,总结其表达规律,为指导临床相关治疗提供可靠依据。
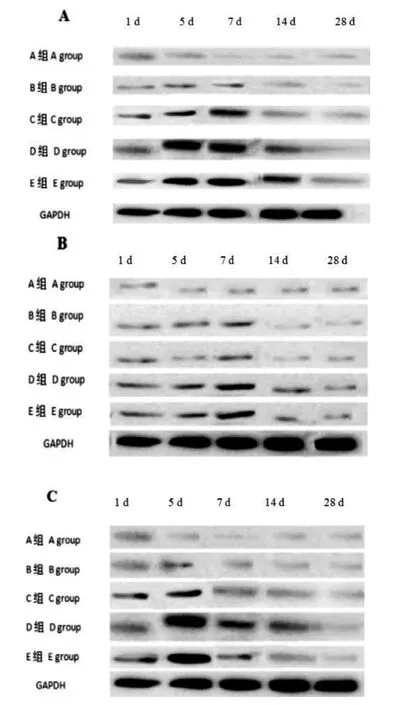
图 2 各组大鼠MAG、NOGO-A、OMgP在致伤后各个时间点表达的Western blotting分析Figure 2 Western blotting analysis on expression of MAG, NOGO-A, OMgP in each time point after spinal cord injury(SCI) in each group

表 3 各组大鼠SCI后MAG、NOGO-A、Omgp相对表达水平Table 3 The expression of MAG、NOGO-A、Omgp in spinal cord tissue after SCI by Western blotting
Nogo定位于细胞内质网膜,属髓鞘相关蛋白,中枢神经系统以Noga-A最为多见,可抑制神经元修复和再生,促进神经细胞再生[8],本研究显示在SCI后1 d即有Nogo-A表达,SCI后 5 d开始上升,7 d后达峰值,14 d后逐步降低。OMgp属中枢神经系统轴突抑制因子,动物试验证实OMgp参与中枢神经系统发育和损伤[9],SCI发生后Nogo-A、MAG及OMgP表达量均显著增高,在抑制轴突生长中作用显著[10,11]。MAG属第一髓鞘相关蛋白,既往报道[12,13]多注重其在启动髓鞘化中的作用,MAG通过介导神经细胞和胶质细胞相互作用,促进神经细胞和髓鞘膜的形成。但近年来其作用的双重性逐渐引起临床重视,MAG可通过p75NTR和NgR受体及GTP酶Rho信号分子完成抑制作用[14,15],本研究也显示在脊髓损伤发生后MAG呈高表达,并在损伤后1周达到峰值,这可能为今后SCI后临床干预时间提供思路。
OMgp是高度糖基化的花生凝集素结合蛋白, 位于髓鞘及少突胶质细胞的外表面, 由成熟的少突胶质细胞表达, 定位于胞膜。Wang等[16]和Kottis等[17]研究表明OMpg通过抑制髓鞘形成和加快生长锥崩解发挥抑制轴突生长作用。分子试验[18,19]进一步分析其可能机制, 表明OMgp能干扰有丝分裂信号传导,进而抑制生长锥接触和表达和少突胶质细胞增值, 使神经原纤维生长变慢。本研究采用Western blotting方法检测到OMgp在SCI后1 d有表达,5 d达峰值,28 d时恢复到假手术组水平,说明Nogo-A、MAG和OMgp三种蛋白在SCI后5~7 d呈现高表达,这可为临床治疗方案的制定和疗效评估提供依据。
本次实验改良Allen’s模型和全横断SCI模型,应用Western blotting印迹分析法观察了A、B、C、D、E组的Nogo-A、MAG和OMgp三种髓鞘相关抑制因子的表达,初步研究了SCI后髓鞘相关抑制因子(Nogo-A、MAG和OMgp)在SCI后5~7 d表达最高,实验组中C组、D组更能模拟人SCI模型。SCI后5~7 d的脊髓提取液可以模拟髓鞘相关抑制因子对轴突生长抑制的微环境。为干预这些抑制因子提供了时机选择, 在髓鞘抑制因子表达高峰之前予以干预, 效果可能更好。
本研究仍存在一定局限性, 如观察周期为28 d,时间较短,难以评价髓鞘抑制因子在更长时间段的表达规律,仍需后期完善研究以获得更为可靠的依据。另外, 本研究中大鼠死亡率为19.2%, 与既往报道相似[20]。大鼠死亡可能与损伤高位脊髓有关,研究结果中也显示E组死亡率最高,另外,损伤后尿路感染和尿潴留造成排尿不畅和膀胱破裂,也可能增加死亡风险,因而对于有排尿不畅者,在建模后应通过常规抗感染和膀胱穿刺干预降低死亡风险。本研究中模拟的SCI模型与临床中所见的SCI相比仍有一定的差异,探求理想的SCI模型仍是今后SCI研究的重点。

