Mn-Si金属间化合物多孔材料的制备
李文浩,贺跃辉,康建刚
Mn-Si金属间化合物多孔材料的制备
李文浩,贺跃辉,康建刚
(中南大学 粉末冶金国家重点实验室,长沙 410083)
以Mn、Si元素粉末为原料,用反应合成方法制备Mn-Si金属间化合物多孔材料,表征各烧结温度所对应的孔结构、膨胀率和微观形貌,研究烧结过程中孔隙产生的机理。结果表明:在Mn-Si金属间化合物多孔材料的制备过程中烧结体发生明显的体积膨胀,烧结温度在800 ℃之前时膨胀率和开孔隙率随着温度的升高不断增大,800 ℃以后,膨胀率和开孔隙率均呈下降趋势;在最终烧结温度1040 ℃下得到开孔隙率为47.60%、平均孔径为11.97 μm、孔结构均匀的多孔材料。探讨多孔材料的造孔机理,主要为压制孔隙的演变,成型剂的脱除,以及Mn元素和Si元素在扩散反应中不同扩散速度引起的Kirkendall效应。
Mn-Si;多孔材料;金属间化合物;造孔机理
多孔材料由于其特殊的孔结构,有着高的比表面积、高透过率、以及良好的吸附性等优良性能。目前多孔材料已广泛应用在生物、医药、化工、冶金、环境保护等领域[1−4]。多孔材料按材料类型主要可以分为两类,有机多孔材料和无机多孔材料,无机多孔材料又可分为陶瓷多孔材料和金属多孔材料[5]。有机多孔材料不能适应高温高压的工作环境,不耐有机溶剂,使用环境受到较大的局限,一般仅用于工作条件较柔和的场合[6]。金属多孔材料有着良好的力学性能和抗热震性能,以及较好的机械加工性能和焊接性能,易于实现工件的复杂形状以及加工和组装。但由于金属的特性,金属多孔材料往往不耐酸碱,且在高温下易氧化。不能适应强酸碱性的工况[7]。陶瓷多孔材料热稳定性好,能适应高温工况,但焊接性能和机械加工性能较差,不利于工件的成型和组装[8]。金属间化合物不同于金属和陶瓷,具有金属键和共价键的混键结构,使得金属间化合物多孔材料兼有陶瓷、金属多孔材料的优点,有着优异的力学性能,抗高温、抗酸碱性能良好,机械加工性能也优于陶瓷多孔材料的[8−11]。
Mn和Si存在多种二元金属间化合物,由于其高的导电性和特殊的磁学性能而被广泛研究,且部分具有半导体的性能。已有报道Mn-Si的热电材料、半导体材料[12−14]。但多关注于致密体的性能研究,Mn-Si多孔材料却鲜有报道。已有报道表明,多孔结构能降低热电材料的热导率,提升热电性能[15−16],多孔半导体材料作为锂电池电极材料能缓解体积膨胀对活性物质的破坏,有效提升电池的循环和倍率性能[17−19]。因此,有必要对Mn-Si多孔材料的制备技术与造孔机理进行研究。
本文作者以Mn、Si元素粉末为原料,通过固相反应烧结制备出多孔材料,得到孔结构均匀,孔隙率高的Mn-Si金属间化合物多孔材料。并对反应烧结Mn-Si多孔金属间化合物在烧结过程中的物相演变以及成孔机理进行了研究。揭示了Mn-Si多孔材料的形成过程和特征,为分段反应烧结制备Mn-Si多孔材料的孔隙形成提供了理论依据。
1 实验
实验原料为纯度为99.8%、粒度分别为<75 μm、<15 μm的Mn粉和Si粉,成分配比为(Mn):(Si)= 7:3,用100 MPa的压力将其模压成直径30 mm厚度为3 mm的圆形压坯,将压坯至于真空度为1×10−3Pa的钼发热体真空烧结炉中进行分段式无压反应烧结。烧结温度分别为400、600、700、750、800、900、1000和1040 ℃,每个温度段保温1 h,烧结过程的升温速度为2.5 ℃/min。
用Archimedes定律法测试试样的孔隙度(开孔隙度)。用D/MAX−3A型X射线衍射仪(XRD)分析Mn-Si多孔材料合成过程中的相变及相组成,用SJM−6360VL型扫描电镜(SEM)观察Mn-Si多孔材料的孔形貌和成分能谱分析。用FBP-3Ⅲ型多孔材料性能检测仪表征Mn-Si系多孔材料的透气度、最大孔径、平均孔径。
2 实验结果
2.1 烧结过程的物相演变
图1所示为压制压坯在分段烧结过程中不同烧结温度下的XRD谱。可知当烧结温度为400 ℃时,烧结体中只存在Mn和Si的单质,Mn和Si之间还未开始发生化合反应。烧结温度升高至600 ℃时,对应的XRD谱中除了Mn,Si两种单质峰外,开始出现了MnSi峰,由此可见MnSi是烧结过程中,最先生成的金属间化合物中间相。当继续升高温度至700 ℃,XRD谱和620 ℃时的类似,主要过程为反应物Mn、Si的消耗和金属间化合物MnSi的生成;当烧结温度为750 ℃时,烧结体中单质Mn、单质Si、MnSi和Mn5Si3四相共存;当温度升至800 ℃时,Si和MnSi的物相衍射分析峰消失,Mn3Si的峰出现。1040 ℃保温后,烧结体只存在两相Mn5Si3、Mn3Si。

图1 Mn-Si多孔金属间化合物分段烧结过程中不同烧结温度的XRD谱
X射线衍射分析结果表明,在烧结过程中,金属间化合物的生成顺序是MnSi、Mn5Si3、Mn3Si。发生的化学反应[20]为:
Mn+Si=MnSi (1)
2Mn+3MnSi=Mn5Si3(2)
5Mn+3Si=Mn5Si3(3)
4Mn+Mn5Si3=3Mn3Si (4)
计算了上述各反应在各个温度下的标准吉布斯自由能,结果示于表1,上述反应的Δ均小于0,在热力学上是允许发生的。在Mn5Si3的生成过程中,反应(2)和反应(3)同时存在。据文献[21]报道,在Mn与Si的扩散反应中,Si在MnSi中的扩散速度较大,作为MnSi中的主导扩散元素,Si从MnSi中扩散至Mn和MnSi的界面处与Mn反应。750 ℃的XRD谱中Si峰明显低于700 ℃时的,也说明了Mn5Si3的生成过程中存在Si的消耗。

表1 Mn-Si化合物生成的反应方程式的标准吉布斯自由能
烧结体的最终成分包含两相,Mn3Si和Mn5Si3。根据Mn-Si二元相图,Mn5Si2在850℃下稳定存在。LUKASHENKO等[22]在研究中指出Mn5Si2可能是含有微量第三元素的结构,Si含量在25%~37.5%(摩尔分数)时,只有Mn5Si3和Mn3Si处在热力学稳定状态。本研究中,在各个温度区间均未出现Mn5Si2。
2.2 烧结体膨胀率和开孔隙率的变化
如图2所示,烧结体在整个烧结过程中,都处于膨胀状态。根据膨胀曲线的斜率变化可将膨胀过程分为3个阶段,第Ⅰ个阶段为400~600 ℃,曲线斜率较小,烧结体随着温度的升高较缓慢的发生膨胀,并在600 ℃时达到1%,此阶段内烧结体的膨胀量占最大膨胀量的9%。第Ⅱ阶段为600~800 ℃,曲线斜率较大,烧结体快速膨胀,并在800 ℃时达到最大膨胀率11.06%,此阶段内烧结体的膨胀量占最大膨胀量的91%。第Ⅲ阶段为800~1040 ℃,曲线斜率<0,烧结体致密化,膨胀率开始减小。
从XRD分析中可以知道,第一阶段的膨胀行为和第二阶段的膨胀行为所处的温度区间都伴随着相变过程。而在800 ℃后烧结体几乎没有相变。此时对应的是膨胀曲线的第三阶段,烧结体开始收缩,发生致密化。可以推断扩散、相变过程是烧结体膨胀行为的主要原因。在反应中存在的4个反应的体积变化如下所示:

图2 Mn-Si 多孔材料合成过程中体积膨胀与烧结温度的关系
Δ1=−26.5% (5)
Δ2=+3.66% (6)
Δ3=−18.31% (7)
Δ4=−5.02% (8)
式中:Δ1、Δ2、Δ3、Δ4分别对应前述的反应(1)、(2)、(3)、(4),其中,Δ1、Δ3和Δ4都为负值,在相变反应后生成物体积较反应物减小,只有Δ2为较小的正值,在该相变反应中,生成物相比较反应物有着较小的体积膨胀。纵观整个烧结过程的相变过程,可以推断,烧结体的膨胀行为并非生成物和反应物密度之差而导致的。
图3所示为各个温度下烧结体开孔隙率变化曲线,孔隙率的变化趋势与膨胀率的变化保持高度的一致,同样可以根据斜率将曲线分为3个部分。如图3所示,曲线的第Ⅰ部分温度区间为400~600 ℃,此时烧结体开孔隙率缓慢上升,第Ⅱ部分温度区间为600~800 ℃,此时烧结体开孔隙率快速提升,第Ⅲ部分温度区间为800~1040 ℃,开孔隙率开始下降,烧结体致密化。
开孔隙率的最高点和膨胀率的最大值都出现在800 ℃的位置,且都在800 ℃后开始下降。600~800 ℃是开孔隙率升高最快的温度区间,也恰好是烧结体膨胀速度最快的温度区间。这进一步说明了烧结体的膨胀行为是由烧结过程中扩散、相变引起的孔隙变化导致的。

图3 Mn-Si金属间化合物多孔材料开孔隙率与烧结温度的关系
图4所示为各个烧结温度下SEM像。可以看出600 ℃和700 ℃时,孔隙主要由原始粉末的堆积空隙组成。温度升至800 ℃时,多孔骨架已经基本形成,孔隙率明显提高,孔径增大。颗粒与颗粒之间通过扩散反应形成冶金结合。800~1040 ℃为经典的致密化过程,烧结体开始收缩,膨胀率从11.06%降至4.67%。
如图5所示,在后续的烧结过程中,随着加热温度的升高,烧结体的最大孔径、平均孔径、透气度、都在提升。烧结体到达最终温度1040 ℃时,有着较好的冶金结合,得到开孔隙率为47.6%,最大孔径和平均孔径分别为14.87 μm、11.97 μm的多孔材料。此时所有粉末颗粒都已反应完全,该温度下的XRD谱也证实了已经没有单质的存在。在该温度下SEM像可以观察到均匀的多孔结构。
2.3 孔隙形成过程及机理
从先前的XRD物相分析中得知,在400 ℃之前,Mn和Si的化合反应还未发生,此时孔隙主要是由压制压坯中留存的孔隙和成型剂脱除时产生的孔隙组成。Mn和Si在烧结过程中首先生成的金属间化合物是MnSi,如图6(a)所示,能谱结果显示为单质Mn,为单质Si,为MnSi。Mn和Si在烧结过程中,相互扩散,并首先形成了MnSi金属间化合物,此结果与XRD结果相符合。可以发现,MnSi在Mn和Si颗粒的界面上生成、并且MnSi金属间化合物和Mn颗粒之间存在孔洞。600~700 ℃烧结时开孔隙率的大量提升,正是MnSi大量生成的温度区间,此时开孔隙率大量增加。据文献报道,在MnSi的生成中,Mn的扩散占主导[21],这些孔洞是由于Mn的扩散速度大于Si发生Kirkendall效应而导致的[23−25]。随着烧结温度升高,扩散继续发生,从700 ℃的SEM像(见图6(b),(c))中可以观察到Mn颗粒与MnSi之间出现了较大的空隙区域。这是由于随着扩散的进行,Kirkendall孔不断生成、长大,最终连通形成的。

图4 不同烧结温度下Mn-Si多孔材料的表面形貌

图5 Mn-Si金属间化合物多孔材料孔结构参数与烧结温度的关系
金属间化合物Mn5Si3的生成,包含两种反应,其一为Mn和MnSi反应生成Mn5Si3。其二是由于在MnSi中Si的扩散较Mn的扩散占主导[21],Si通过MnSi扩散至MnSi与Mn的界面处,与Mn发生反应,生成Mn5Si3。此过程中存在Kirkendall效应,在750 ℃烧结体的SEM像中,在Si颗粒的周围同样可以找到由于Kirkendall效应产生的孔洞。随着温度的升高,扩散继续进行,Mn、Si、MnSi被消耗殆尽,在富Si区形成Mn5Si3,在富Mn区最终形成Mn3Si。图6(e)所示为最终烧结温度下的孔隙形貌。
综上所述,整个烧结过程中,造孔机理主要为主要为压制孔隙的演变,成型剂的脱除,以及Mn元素和Si元素在扩散反应中不同扩散速度引起的Kirkendall效应,孔隙的形成可以分为三个阶段:第一个阶段,化合反应还未发生,如图7(a)所示,孔隙主要由压坯原始颗粒间隙孔组成,随着成型剂的脱除,孔隙率小幅增加;第二个阶段是Mn元素和Si元素发生偏扩散生成MnSi,由于Kirkendall效应,孔隙率显著提升,如图7(b)所示,在Mn和MnSi的界面上产生大量的Kirkendall孔;第三个阶段是Mn5Si3的生成,Si在MnSi中的扩散速率较Mn的大,产生Kirkendall孔。

图6 不同烧结温度下保温1 h后Mn-Si烧结体的背散射SEM像
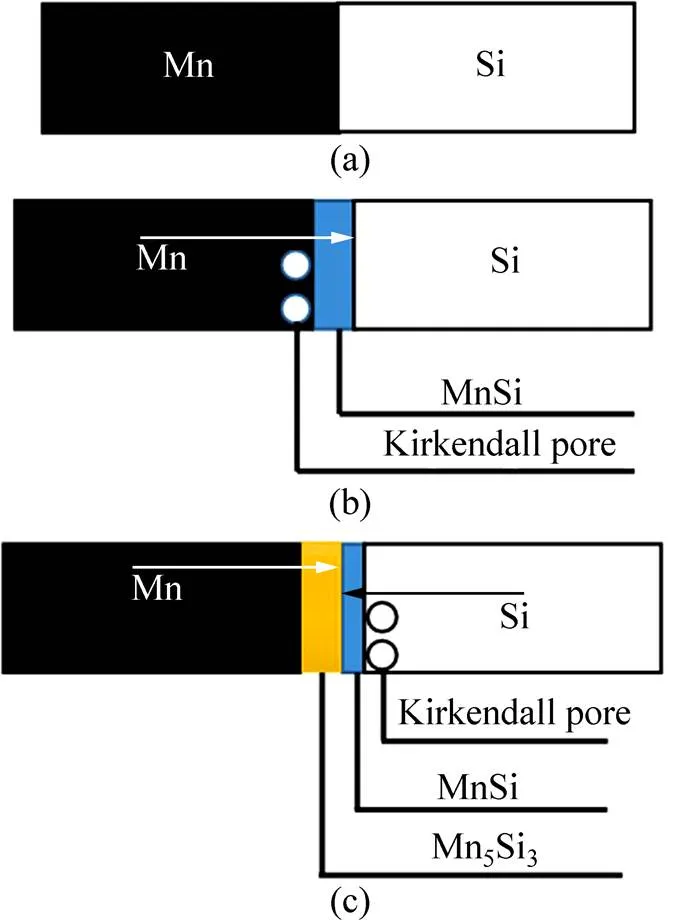
图7 Mn-Si粉末压柸造孔过程
3 结论
1) Mn、Si粉末在成分配比为(Mn):(Si)=7:3的无压反应烧结中首先生成中间相MnSi,然后依次生成Mn5Si3、Mn3Si,并在最终烧结温度1040 ℃后,只存在Mn5Si3、Mn3Si两相,并得到孔隙分布均匀,结构良好,孔隙率为47.60%的金属间化合物多孔材料。
2) Mn-Si金属间化合物多孔材料的造孔机理主要为压制孔隙的演变,成型剂的脱除,以及Mn与Si粉末在扩散过程中扩散速度不同引起的Kirkendall效应。
[1] HERNÁNDEZ N, SÁNCHEZ-HERENCIA A J, MORENO R. Forming of nickel compacts by a colloidal filtration route[J]. Acta Materialia, 2005, 53(4): 919−925.
[2] LÉTANT S E, HART B R. Functionalized silicon membranes for selective bio-organismcapture[J]. Nature Materials, 2003, 2(6): 391−395.
[3] YAMAGUCHI A, UEJO F, YODA T, UCHIDA T, TANAMURA Y, YAMASHITA T, TERAMAE N. Self-assembly of a silica surfactant nanocomposite in a porous alumina membrane[J]. Nature Materials, 2004, 3(5): 337−341.
[4] BRUGGEN B V D, VANDECASTEELE C. Distillation vs. membrane filtration: Overview of process evolutions in seawater desalination[J]. Desalination, 2002, 143(3): 207−218.
[5] JULBE A, FARRUSSENG D, GUIZARD C. Porous ceramic membranes for catalytic reactors—Overview and new ideas[J]. Journal of Membrane Science, 2001, 181(1): 3−20.
[6] 李婷婷, 彭超群, 王日初, 王小锋, 刘 兵, 王志勇. Fe-Al、Ti-Al和Ni-Al系金属间化合物多孔材料的研究进展[J]. 中国有色金属学报, 2011, 21(4): 784−795. LI Ting-ting, PENG Chao-qun, WANG Ri-chu, WANG Xiao-feng, LIU Bing, WANG Zhi-yong. Rwsearch progress in porous Fe-Al,Ti-Al and Ni-Al intermetallic compound porous materials[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(4): 784−795.
[7] HEIKKINEN M S A, HARLEY N H. Experimental investigation of sintered porous metal filters[J]. Journal of Aerosol Science, 2000, 31(6): 721−738.
[8] HE Y H, JIANG Y, XU N P, ZOU J, HUANG B Y, LIU C T, LIAW P K. Fabrication of Ti-Al micro/nanometer-sized porous alloys through the Kirkendall effect[J]. Advanced Materials, 2010, 19(16): 2102−2106.
[9] KUMARAN S, CHANTAIAH B, SRINIVASA R T. Effect of niobium and aluminium additions in TiAl prealloyed powders during high-energy ball milling[J]. Materials Chemistry & Physics, 2008, 108(1): 97−101.
[10] LANG F, YU Z, GEDEVANISHVILI S, DEEVI S C, HAYASHI S, NARITA T. Sulfidation behavior of Fe-40Al sheet in H-HS mixtures at high temperatures[J]. Intermetallics, 2004, 12(5): 469−475.
[11] AMAYA M, ESPINOSA-MEDINA M A, PORCAYO- CALDERON J, MARTINEZ L, GONZALEZ-RODRIGUEZ J G. High temperature corrosion performance of FeAl intermetallic alloys in molten salts[J]. Materials Science & Engineering A, 2003, 349(1/2): 12−19.
[12] YANG Z, GU Y, CHEN L, SHI L, MA J, QIAN Y. Preparation of Mn5Si3nanocages and nanotubes by molten salt flux[J]. Solid State Communications, 2004, 130(5): 347−351.
[13] OKADA S, SHISHIDO T, ISHIZAWA Y, OGAWA M, KUDOU K, FUKUDA T, LUNDSTR M T. Crystal growth by molten metal flux method and properties of manganese silicides[J]. Journal of Alloys & Compounds, 2001, 317(1): 315−319.
[14] CHEVALIER P Y, FISCHER E, RIVET A. A thermodynamic evaluation of the Mn-Si system[J]. Calphad-computer Coupling of Phase Diagrams & Thermochemistry, 1995, 19(1): 57−68.
[15] SONG D, CHEN G. Thermal conductivity of periodic microporous silicon films[J]. Applied Physics Letters, 2004, 84(5): 687−689.
[16] DE BOOR J, KIM D S, AO X, HAGEN D, COJOCARU A, F LL H, SCHMIDT V. Temperature and structure size dependence of the thermal conductivity of porous silicon[J]. Epl, 2011, 96(1): 16001.
[17] KANEMITSU Y. Light emission from porous silicon and related materials[J]. Physics Reports, 1995, 263(1): 1−91.
[18] GE M, FANG X, RONG J, ZHOU C. Review of porous silicon preparation and its application for lithium-ion battery anodes[J]. Nanotechnology, 2013, 24(42): 422001.
[19] ANGLIN E J, CHENG L, FREEMAN W R, SAILOR M J. Porous silicon in drug delivery devices and materials[J]. Advanced Drug Delivery Reviews, 2008, 60(11): 1266.
[20] EREMENKO V N, LUKASHENKO G M, SIDORKO V R. Thermodynamic properties of manganese silicides communication 3[J]. Soviet Powder Metallurgy & Metal Ceramics, 1969, 8(2): 140−141.
[21] ZHANG L, IVEY D G. Low temperature reactions of thin layers of Mn with Si[J]. Journal of Materials Research, 1991, 6(7): 1518−1531.
[22] LUKASHENKO G M, SIDORKO V R, KOTUR B Y. Phase constitution and thermodynamic properties of alloys of the Mn-Si system in the range from 25 to 37.5 at.% Si[J]. Soviet Powder Metallurgy & Metal Ceramics, 1981, 20(8): 571−574.
[23] BRINKMANF J A. Mechanism of pore formation associated with the Kirkendall effect[J]. Acta Metallurgica, 1954, 3(2): 140−145.
[24] DONG H X, HE Y H, ZOU J, XU N P, HUANG B Y, LIU C T. Effect of preheating treatment at 575 °C of green compacts on porous NiAl[J]. Journal of Alloys & Compounds, 2010, 492(1/2): 219−225.
[25] SEITZ F. On the porosity observed in the Kirkendall effect[J]. Acta Metallurgica, 1953, 1(3): 355−369.
Fabrication of porous Mn-Si intermetallic compounds
LI Wen-hao, HE Yue-hui, KANG Jian-gang
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Porous Mn-Si material was prepared by reactive synthesis, and the pore structure, expansion rate and microscopic morphologies were characterized, and the mechanism of pore formation in the sintering process was investigated. The results show that the volume of compact increases significantly during the reactive synthesis process. When the sintering temperature is below 800 ℃, the expansion and the open porosity increase with increasing the sintering temperature. However, both the expansion and the open porosity begin to decrease after the temperature rising to 800 ℃. After being sintered at 1040 ℃, a porous material is obtained with a porosity of 47.60%, an average pore size of 11.97 μm, and a uniform pore structure. The main pore formation mechanisms are evolvement of interparticle pores, removal of binder and the Kirkendall effect due to the difference in diffusion rates of Mn and Si.
Mn-Si; porous material; intermetallics; pore formation mechanism
2018-04-24;
2018-09-07
HE Yue-hui; Tel: +86-731-88836144; E-mail: yuehui@csu.edu.cn
10.19476/j.ysxb.1004.0609.2018.09.10
1004-0609(2018)-09-1791-07
TG145
A
2018-04-24;
2018-09-07
贺跃辉,教授,博士;电话:0731-88836144;E-mail:yuehui@csu.edu.cn
(编辑 王 超)

