长期高强度间歇训练对增龄大鼠骨骼肌脂联素/AMPK信号途径和细胞自噬的影响
孙 磊,李方晖
长期高强度间歇训练对增龄大鼠骨骼肌脂联素/AMPK信号途径和细胞自噬的影响
孙 磊,李方晖
南京师范大学 体育科学学院, 江苏 南京 210046
目的:探究8个月高强度间歇训练(HIIT)和持续性耐力训练(MICT)对增龄大鼠骨骼肌脂联素/AMPK信号通路和细胞自噬的影响。方法:选取36只18月龄雌性清洁级SD大鼠随机分为老龄安静对照组(SED组)、老龄持续性耐力组(MICT组)和老龄高强度间歇训练组(HIIT组),共3组,每组12只。MICT组以速度17 m/min进行跑台训练;HIIT组以起始速度为 15 m/min跑台4 min,之后跑台速度增至25 m/min跑台1 min,依次交替进行9个循环;两个运动组跑台时间均为45 min,每周5次,共8个月;SED组大鼠自由摄食但不进行训练。在末次训练后48 h双能X射线测试大鼠体成分。体成分测试后48 h依次测试各组大鼠张力、抓力、最大跑步速度和跑步力竭时间。比色法测定血清和腓肠肌丙二醛(MDA)含量和超氧化物歧化酶2(SOD2)活性;酶联免疫吸附(ELISA)法测定血清和腓肠肌4-羟基壬烯醛(4-HNE),8-羟基脱氧鸟苷(8-OHdG)和胰岛素样生长因子1(IGF-1)含量;ELISA测定血清和脂肪组织中脂联素含量;蛋白免疫印迹法测定腓肠肌脂联素、脂联素受体1、去乙酰化酶3(SIRT3)、腺苷酸活化蛋白激酶(AMPK)和自噬蛋白。结果:1)与SED和MICT组相比,HIIT组大鼠瘦体重%、体脂%、体脂与瘦体重比值%和抓力明显增加;2)与SED组相比,MICT和HIIT组大鼠跑步力竭时间(<0.01)、相对张力(<0.05)和最大跑步速度(<0.01)增加;3)与SED组相比,HIIT和MICT组等大鼠腓肠肌SOD2和IGF-1含量增加(<0.01),血清IGF-1含量下降(<0.01);腓肠肌和血清4-HNE、8-OHdG低于SED组;4)HIIT组大鼠腓肠肌和血清MDA含量均低于MICT和SED组(<0.01);5)蛋白免疫印迹结果显示,与SED组相比,HIIT组和MICT组大鼠脂联素、脂联素受体1、AMPK和SIRT3蛋白表达均显著增加;6)与MICT组相比,HIIT组大鼠腓肠肌AMPK和脂联素受体1蛋白表达增加(<0.05);7)HIIT组大鼠腓肠肌Beclin-1、LC3-I、LC3-II蛋白表达和LC3-II/LC3-I比值均高于SED组;相关性结果显示,跑步力竭时间与腓肠肌脂联素、脂联素受体1、AMPK和LC3-II/LC3-I比值呈正相关。结论:长期高强度间歇训练可能通过IGF-1/SIRT3轴上调骨骼肌SOD2活性水平,防止骨骼肌氧化损伤;同时也可能通过激活脂联素/AMPK信号途径上调衰老骨骼肌自噬活性,从而可抵抗增龄大鼠肌肉质量丢失,并改善大鼠运动表现。
高强度间歇训练;增龄;骨骼肌;脂联素;自噬
前言
骨骼肌是人体进行身体活动的动力源,具有一定的肌肉力量水平是人体进行各种体力活动的基础;然而,随着年龄增长,人体的骨骼肌质量、力量和耐力会出现下降,严重影响生活质量,是老年人群中频发的一种退行性疾病,称之为肌肉衰减征(Sarcopenia)[2]。肌肉衰减征会增加老年人衰老相关疾病的发病几率,严重影响老年人的生活质量[15]。有研究已证实,衰老相关的氧化应激是骨骼肌线粒体数量和机能下降的重要诱因,后者会增加肌细胞凋亡和肌纤维蛋白质水解,造成肌纤维数量减少和肌纤维萎缩[20],引起运动能力下降[33,35,47]。现有研究发现,衰老骨骼肌细胞自噬(Autophagy)活性降低会影响受损和功能异常的线粒体无法从整个线粒体网络中清除,而功能异常的线粒体数目会增加呼吸链电子漏出的活性氧自由基(ROS)水平,进而导致衰老骨骼肌细胞的线粒体氧化损伤和肌纤维蛋白的降解。提示,调控骨骼肌细胞自噬是缓解肌细胞氧化应激和保护衰老骨骼肌的有效策略[13],但调控衰老骨骼肌自噬的具体机制尚不清楚。
腺苷酸活化蛋白激酶(AMP activated protein kinase, AMPK)可通过调控哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin, mTOR)促进细胞自噬[5]。作为一种增进胰岛素敏感性的脂肪因子,脂联素(Adiponectin)能够激活AMPK调控骨骼肌细胞自噬,改善肥胖大鼠骨骼肌胰岛素敏感性和线粒体氧化代谢水平[49];将肥胖小鼠骨骼肌脂联素基因敲除后发现,小鼠骨骼肌氧化应激水平和炎症反应均显著提高,补充脂联素蛋白能经骨骼肌脂联素受体信号缓解骨骼肌氧化损伤[22]。Ren等[36]体外细胞实验发现,脂联素/脂联素受体(Adiponectin receptor)1信号可通过调控细胞自噬抑制过氧化氢诱导的成肌细胞氧化损伤。Inoue等[19]研究也表明,运动通过调控脂联素/脂联素受体1/AMPK信号通路能缓解快速老化小鼠(SAMP10)骨骼肌氧化应激水平,改善线粒体生物发生和抑制骨骼肌细胞凋亡。提示,脂联素/AMPK信号通路在改善衰老骨骼肌功能和维持骨骼肌稳态过程中扮演着重要角色。然而,细胞自噬是否参与脂联素/AMPK信号轴对衰老骨骼肌起到保护效应?
高强度间歇训练(High-intensity interval training, HIIT)被认为是缓解肌肉衰减征更为有效的运动方式[38]。Bell等[9]研究发现,抗阻训练与HIIT刺激老年人肌纤维蛋白质合成的效果相似,但HIIT对肌浆网内蛋白质合成的刺激效应强于抗阻训练。Robinson等[38]研究也发现,与抗阻训练、耐力联合抗阻练习相比,HIIT在提高老年人有氧适能、肌力、骨骼肌代谢功能方面效果更佳。蛋白质组学研究表明,HIIT在改变骨骼肌DNA表观遗传修饰调控基因转录水平表达,促进骨骼肌功能蛋白表达和线粒体生物合成更有优势[38]。HIIT通过激活肥胖大鼠骨骼肌脂联素/AMPK信号通路[31]和细胞自噬[27],进而改善骨骼肌线粒体氧化功能和收缩机能。但是,HIIT是否可通过脂联素/AMPK信号通路调控自噬,降低衰老骨骼肌氧化应激水平,抑制肌肉衰减征的发生?
基于此,本研究通过研究HIIT对18月龄增龄大鼠运动表现、氧化应激、脂联素信号及其自噬蛋白表达的影响,探讨HIIT对肌肉衰减症的保护作用及分子机制。
1 研究对象与方法
1.1 实验动物
实验动物依据我国国家卫生部提出的动物管理条例进行管理和利用,并通过广东省医学动物实验中心伦理委员会批准。选用36只约18月龄清洁级Sprague-Dawley(SD)雌性大鼠,由广东省医学动物实验中心(动物许可证号:SCXK【粤】2013-0002)提供。所有大鼠采用自由摄食,广东省医学动物实验中心提供国家标准啮齿类动物常规饲料及垫料。饲料供给量根据体重增长相应增加,每周更换垫料2~3次,温度20℃~23℃,相对湿度50%~70%,自然光照,笼内保持通风干燥。
1.2 动物分组及运动方案
36只大鼠在实验室适应性喂养2周,之后进行适应跑台1周,随机分为3组,即老龄安静对照组(SED组)、老龄持续性耐力组(MICT组)和老龄高强度间歇训练组(HIIT组),每组12只。直至取材前共12只大鼠被排除:SED组2只(眼睛感染),MICT组4只(2只死于运动无关的原因、2只爪子外伤感染)和HIIT组6只(2只无法坚持训练、2只爪子和2只尾部感染)。动物实验跑台(型号:FD000043)购置于广州飞迪生物科技有限公司。适应性训练后进行正式训练,训练时段为周一至周五的晚间18:30~22:00,周六、周日停训,共8个月。

1.3 体成分
避免最后一次运动带来的急性影响,选择在最后一次训练周期48 h后采用双能X射线测试大鼠体成分。测试前腹腔注射10%水合氯醛(3 ml/kg)麻醉大鼠,将大鼠俯卧放置于XR-36NORLAND型双能X线吸收平台上(Unigamma X-ray Plus, Cerro Maggiore, Milano, Italy),在小动物模式下扫描大鼠,观察的指标包括瘦体重、瘦体重百分比(瘦体重%)、体脂百分比(体脂%)、脂肪/瘦体重百分比(脂肪/瘦体重%)。
1.4 运动表现
1.4.1 张力和抓力测试
运动表现的测试在体成分测试后48 h进行,该时间间歇是为了减少麻醉对运动表现的干扰。运动表现测量包括跑步力竭时间(Exhaustion to time)、张力(Handing time)、抓力(Grip strength)和最大跑步速度(Maximum running speed)。抓力测试仿照Grip Strength Meter(Bioseb, France)使用拉力计和铁丝网自制仪器,将仪器放置于光滑平面上,拉力计端保持固定,将大鼠放于铁丝网上,沿铁丝网的纵轴方向轻轻牵拉大鼠尾部,致其4个爪子抓紧铁丝网,缓慢增加牵拉力度,直至拉力超过大鼠的抓力,大鼠被拉离铁丝网。测试过程中,拉力计自动记录最大抓力值,重复测量3次,取最大值。以该参数与体重比值(N/g)×100用以评价抓力[27]。大鼠肌耐力测试参考Li等[27]采用改良斜板测试(Inclined plane test)方法。具体步骤:在大鼠尾部悬挂350 g重物,将其头上尾下置于倾斜60°、距离地面50 cm高的铁丝网(网眼规格1 cm×1 cm)上,铁丝网下方放置泡沫垫以防大鼠摔伤,如果测试时间少于10 s,则休息 5 min再重新测试,最终记录大鼠在铁丝网上停留时间,该参数与体重(Body weight, BW)的比值(min/g)×100用以评价大鼠张力。
1.4.2 跑步力竭时间和最大跑步速度测定
18月龄大鼠采用递增负荷在动物实验跑台上进行最大跑步速度测试,正式训练开始前,HIIT组和MICT组大鼠在跑台上进行适应性训练,各组大鼠在末次训练后48 h进行一次递增负荷运动实验。方案:进行1 min跑台热身运动(速度20 cm/s)后,起始负荷设定为30 cm/s,之后,每 1 min跑步速度递增5 cm/s,直至力竭。力竭判定标准:动物跟不上预定速度,大鼠臀部压在笼具后壁,后肢随转动皮带后拖达30 s,毛刷刺激驱赶无效;行为特征为呼吸深急,精神疲倦,俯卧位垂头,刺激后无反应,最终记录跑步力竭时间[27]。
适应性训练后48 h进行最大跑步速度测试,所有大鼠在跑台上以20 cm/s的速度开始跑,并以每1 min增加5 cm/s的速度递增,直至大鼠疲劳,以大鼠无法维持一定速度,确定的最终跑台速度作为大鼠最大跑步速度[11]。
1.5 取材
最大跑步速度测试结束后48 h,所有大鼠按照4 ml/kg剂量10%水合氯醛麻醉,腹主动脉取血;断颈处死,将每只鼠的1.5 ml的混合肝素钠的血液标本存放于5 ml的EP管中,先常温静置30 min,最后在4℃环境下静置1 h,紧接着进行15 min离心,转速在3 500 rpm离心之后,抽离血清,将剩余血清和血液分装于冻存管中密封投入液氮后,迅速取出腓肠肌、股四头肌、趾长伸肌、比目鱼肌称重,以每只大鼠不同骨骼肌质量与体重的比值作为骨骼肌指数。红色腓肠肌与人股外侧肌相似,衰老过程呈现氧化应激水平增加和线粒体功能失调[45],因此,本研究分离红色腓肠肌(深层)[7,39]组织作为衰老骨骼肌模型研究。分离出的红色腓肠肌组织[45]和肾周脂肪(白色脂肪)[37]一部分用锡纸包裹分装于-80 ℃冰箱保存。
1.6 氧化应激参数和细胞因子测定
比色法测定腓肠肌和血清中丙二醛(Malondialdehyde, MDA)含量和超氧化物歧化酶2(Superoxide dismutase 2, SOD2)活性,单位分别为: nmol/L和 U/ml;腓肠肌和血清中胰岛素样生长因子-1(Insulin-like growth factor 1,IGF-1)单位分别为:pg/mg和mg/dl;羟基壬烯醛(4-hydroxy-2-nonenal, 4-HNE)和8-羟基脱氧鸟苷(8-hydroxy-deoxyguanosine, 8-OHdG)单位分别为: ng/mg和ng/L。血清和肾周脂肪中脂联素浓度均采用酶联免疫吸附试验(ELISA)进行测定,单位分别为:mg/dl和pg/mg。试剂盒购自南京建成生物工程研究所,操作过程严格按照试剂盒说明操作,每个指标测2次,取均值。
1.7 蛋白免疫印迹检测骨骼肌相关蛋白表达
将上样缓冲液与上述腓肠肌蛋白样品等体积混合煮沸10 min。在垂直电泳仪上用相同体积的15 μg蛋白质样品分别经6%、10%和15%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)分离微管相关蛋白轻链3A/B(Microtubule-associated protein light chain 3 A/B, LC3A/B)、自噬相关蛋白Beclin-1、脂联素、脂联素受体1、去乙酰化酶3(Sirtuin3, SIRT3)、AMPK和甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphatedehydrogenase, GAPDH)后转移于聚偏二氟乙烯膜(PVDF)膜上,以1:1 000兔抗鼠一抗4℃静置孵育过夜,磷酸盐缓冲液(Phosphate buffered solution, PBS)洗涤3次,再以1:1 000辣根过氧化物酶标记的羊抗兔IgG抗体(二抗)于37℃孵育1 h,洗涤后在暗室使用ECL试剂盒发光成像,Image J软件读取各条带的灰度值,GAPDH为内参蛋白。相对表达量=目的蛋白灰度值/GAPDH灰度值。上述抗体均购置美国Cell Signaling Technology公司。
1.8 数据分析
采用SPSS 21.0软件分析数据,Graph Pad Prism(Version 6.07)软件作图。以平均数±标准差(M±SD)表示。对各组大鼠的所有指标均采用单因素方差分析,事后多重比较(Post Hoc Tests)采用Tukey HSD法。采用Pearson相关分析,相关系数用表示。<0.05和<0.01分别表示显著性意义和非常显著性意义。
2 结果
2.1 各组增龄大鼠体成分和骨骼肌指数的变化
与SED组相比,HIIT组大鼠瘦体重%显著增加15%(<0.05,图1B),体脂%显著减少27%(<0.05,图1C)以及体脂/瘦体重%显著降低43%(<0.01,图1D),HIIT组大鼠比目鱼肌指数16%(<0.01,图1E)、腓肠肌指数18%(<0.05,图1F)和趾长伸肌指数22%(<0.05,图1H)显著增加,MICT组大鼠比目鱼肌指数8%(<0.05;图1E)、腓肠肌指数22%(<0.01,图1F)和股四头肌指数16%(<0.05,图1G)显著增加。
2.2 运动对增龄大鼠骨骼肌运动成绩的影响
与SED组相比,HIIT和MICT组大鼠的跑步力竭时间(<0.01,图2A)、最大跑步速度(<0.01,图2D)和张力(<0.05,图2B)显著增加。与SED(<0.01)和MICT(<0.05)组相比,HIIT组大鼠的相对抓力显著增加(图2C)。
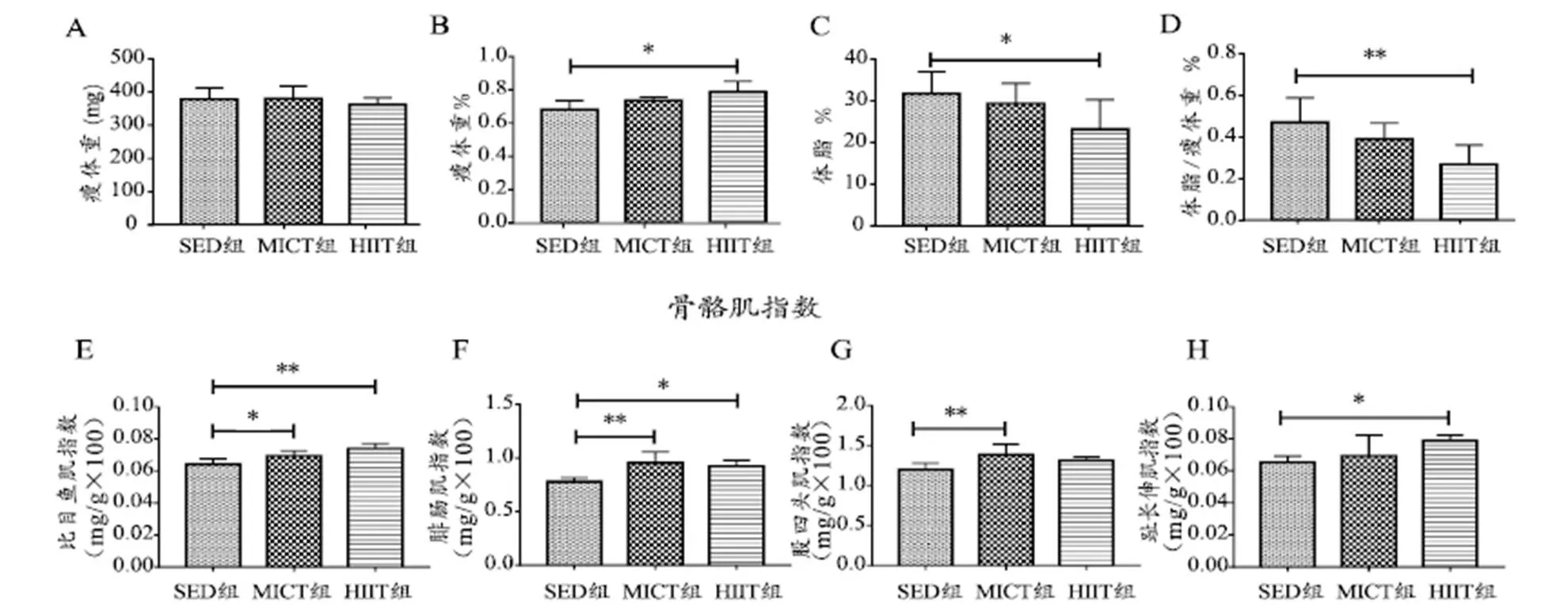
图 1 本研究各组大鼠体成分和骨骼肌指数的变化
Figure 1. Changes of Body Composition and Skeletal Muscle Index
注:*表示<0.05,**表示<0.01,下同。
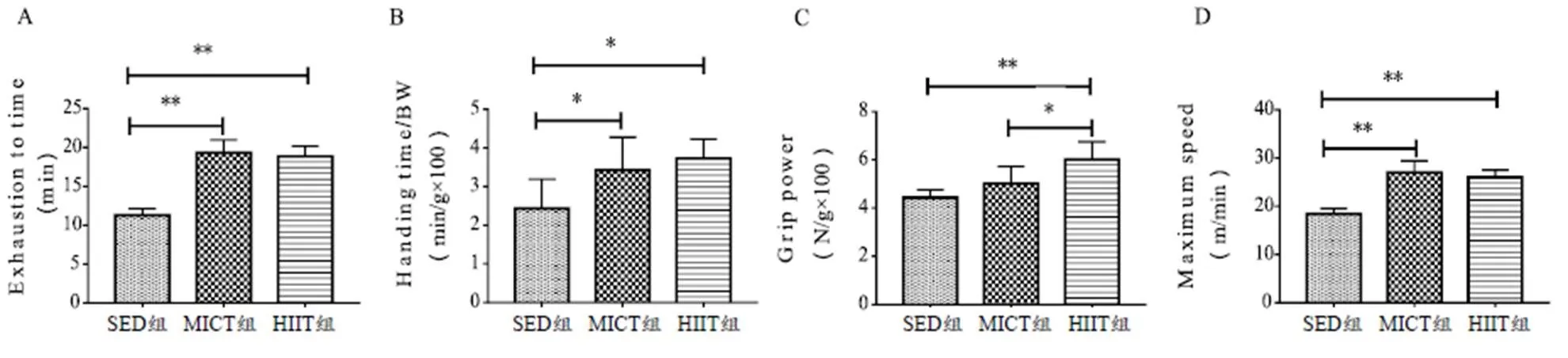
图2 各组大鼠力竭时间、张力、抓力和最大跑步速度的变化
Figure 2.Changes of Exhaustion to Time, Handing Time, Grasping Force and Maximum Running Speed
2.3 HIIT对增龄大鼠骨骼肌氧化应激的影响
与SED组相比,HIIT和MICT组大鼠腓肠肌SOD2活性(图3D)和IGF-1蛋白含量(图3E)显著增加(<0.01),血清中IGF-1含量(图3J)显著降低(<0.01),HIIT组大鼠腓肠肌和血清4-HNE、8-OHdG和MDA显著降低(<0.01),MICT组大鼠4-HNE和8-OHdG显著降低(<0.01)。与MICT组相比,MDA显著降低(<0.01)。
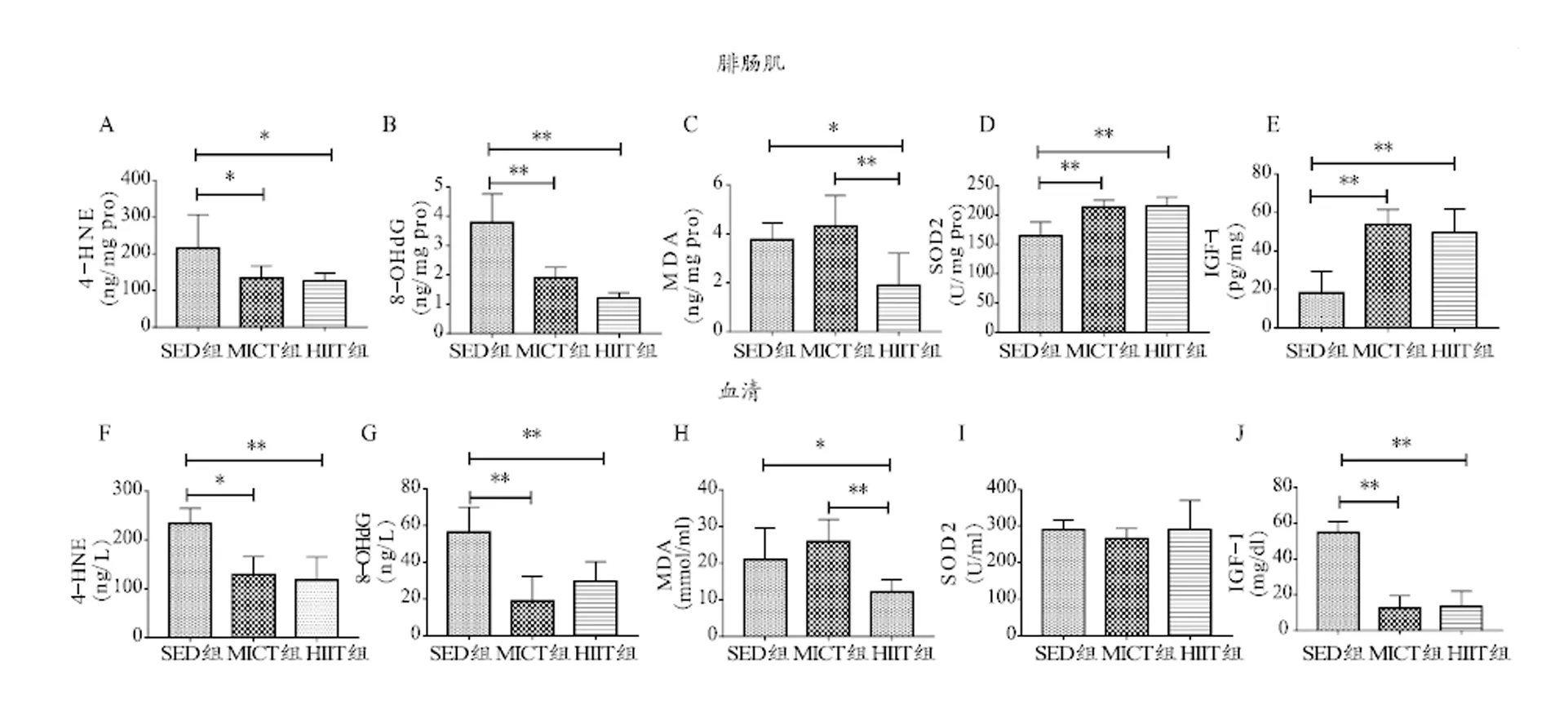
图3 各组大鼠腓肠肌和血清的氧化应激指标和IGF-1的变化
Figure 3. Changes of Oxidative Stress and IGF-1 in Gastrocnemius Muscle and Serum
2.4 HIIT对增龄大鼠骨骼肌自噬活性和相关蛋白表达的改变
与SED组相比,HIIT组大鼠腓肠肌Beclin-1(<0.05)、LC3-I(<0.05)、LC3-II(<0.01)蛋白表达和LC3-II/LC3-I比值(<0.05)显著增加,MICT组大鼠Beclin-1(<0.01)蛋白表达显著增加。与MICT组相比,HIIT组大鼠LC3-II(<0.01)蛋白表达显著增加(图4)。
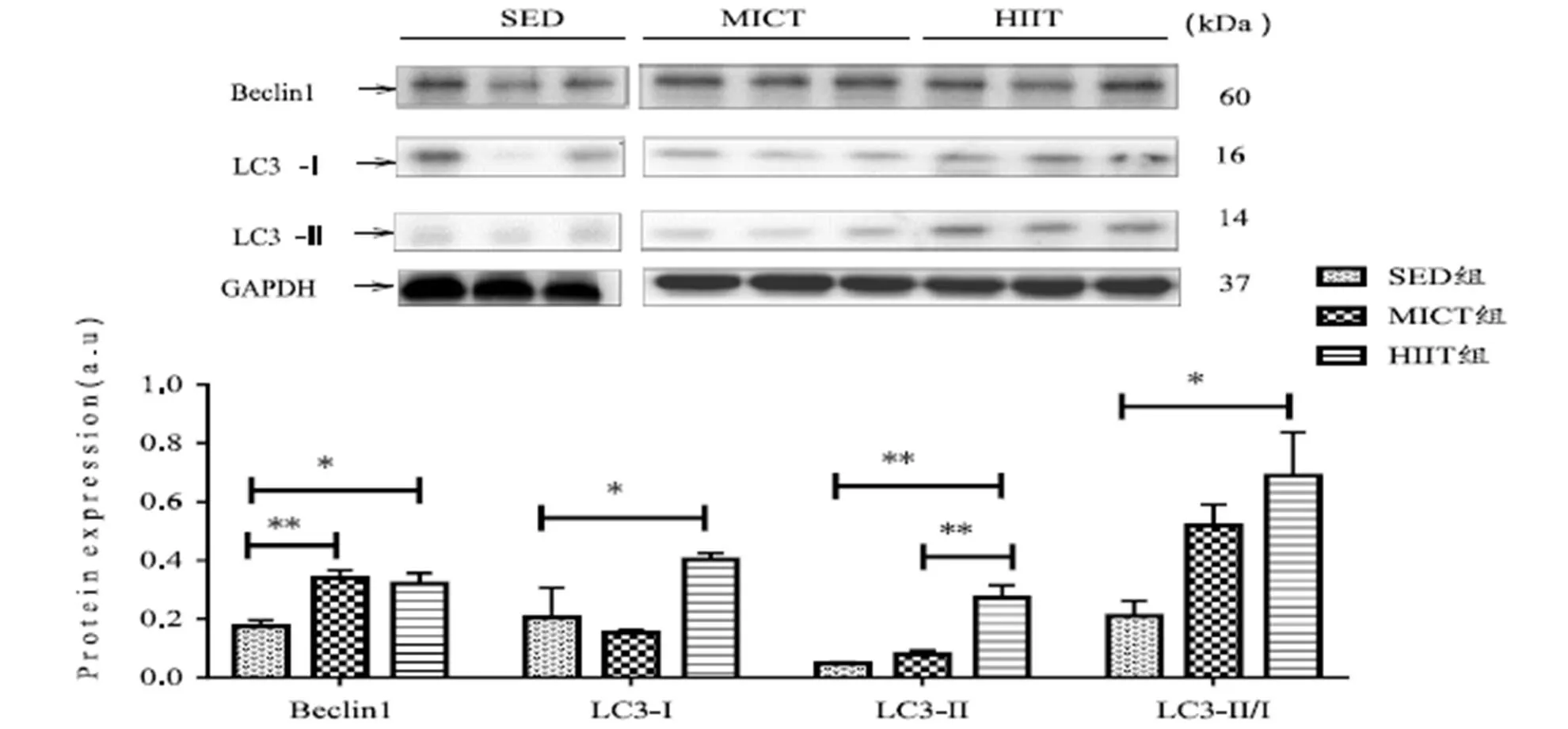
图4 腓肠肌自噬相关蛋白表达
Figure 4. Expression of Autophagy Related Protein in Gastrocnemius Muscle
2.5 HIIT对增龄大鼠骨骼肌、脂肪和血清相关蛋白的改变
与SED组相比,HIIT组大鼠骨骼肌脂联素显著增加(<0.01,图5A),但血清中脂联素显著减少(<0.05,图5B),肾脏脂肪组织中无显著差异(>0.05,图5C)。如图5A所示,与SED组相比,HIIT组大鼠骨骼肌脂联素受体1(<0.01)、AMPK(<0.01)和SIRT3(<0.05)均显著增加,MICT组大鼠骨骼肌脂联素和SIRT3显著增加(<0.05)。与MICT相比,HIIT组大鼠骨骼肌脂联素受体1和AMPK显著增加(<0.05)。
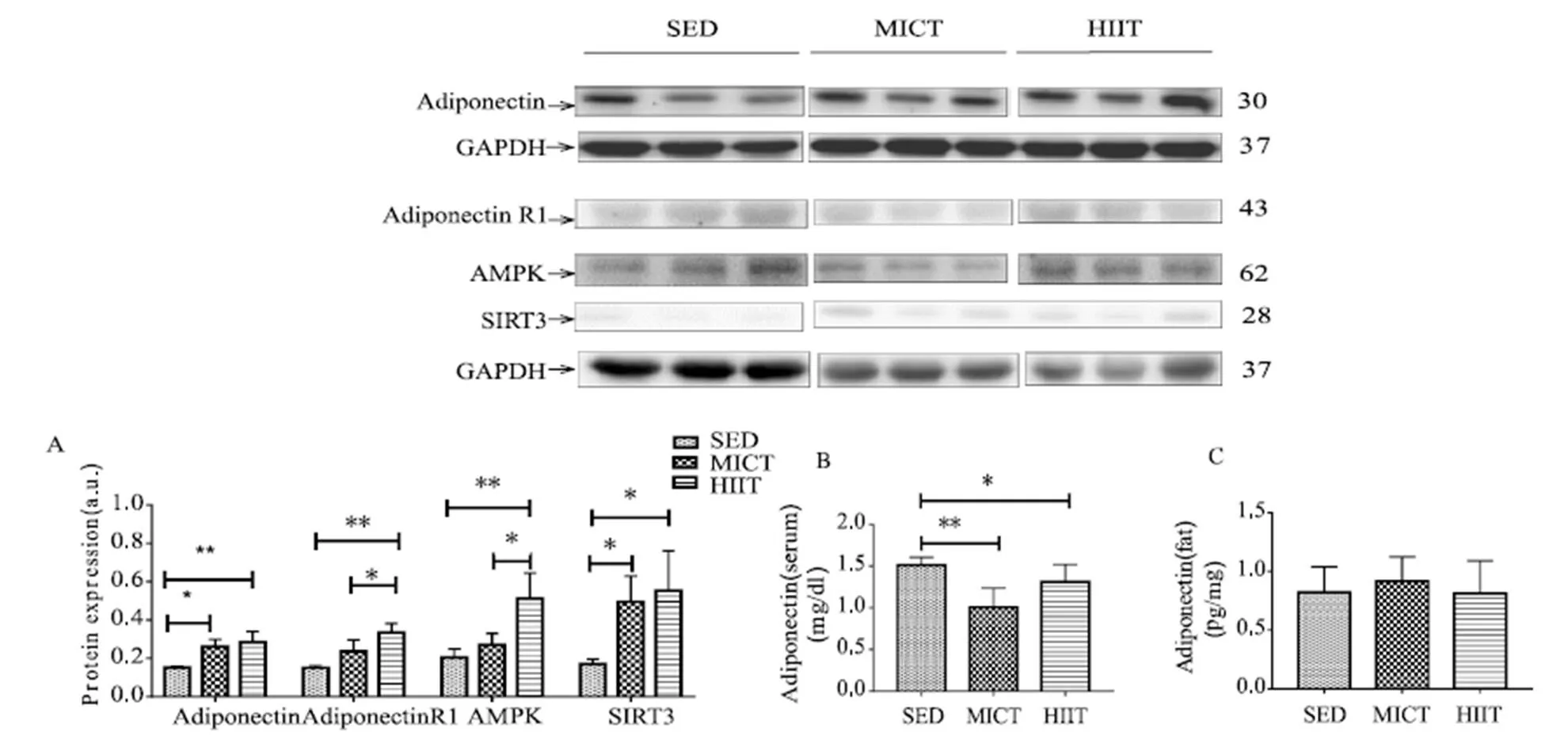
图5 各组大鼠腓肠肌脂联素、脂联素受体1、SIRT3、AMPK及血清和肾周脂肪脂联素变化
Figure 5. Changes of Adiponectin, Adiponectin receptor 1, SIRT3, and AMPK in Gastrocnemius and Adiponectin level in Serum and Adipose Tissue
2.6 相关性分析
如图6所示,跑步力竭时间和最大跑步速度分别与8-OHdG蛋白含量呈负相关,而分别与脂联素、脂联素受体1、SIRT3、IGF-1、SOD2及Beclin-1蛋白含量和LC3-II/LC3-I比值呈正相关。8-OHdG与SOD2、IGF-1呈负相关(<0.05);SOD2与IGF-1(<0.01)、SIRT3(<0.05)、Beclin-1(<0.01)和LC3-II/LC3-I 比值呈正相关。脂联素与脂联素受体1、AMPK、SIRT3、Beclin-1、LC3-II蛋白含量和LC3-II/LC3-I比值呈正相关。脂联素受体1与AMPK、SIRT3、Beclin-1、LC3-I、LC3-II蛋白含量和LC3-II/LC3-I比值(0.05)呈正相关。AMPK与 LC3-I(<0.05)、LC3-II(<0.05)和LC3-II/LC3-I 比值呈正相关。SIRT3与Beclin-1(<0.01)、LC3-II和LC3-II/LC3-I比值呈正相关。
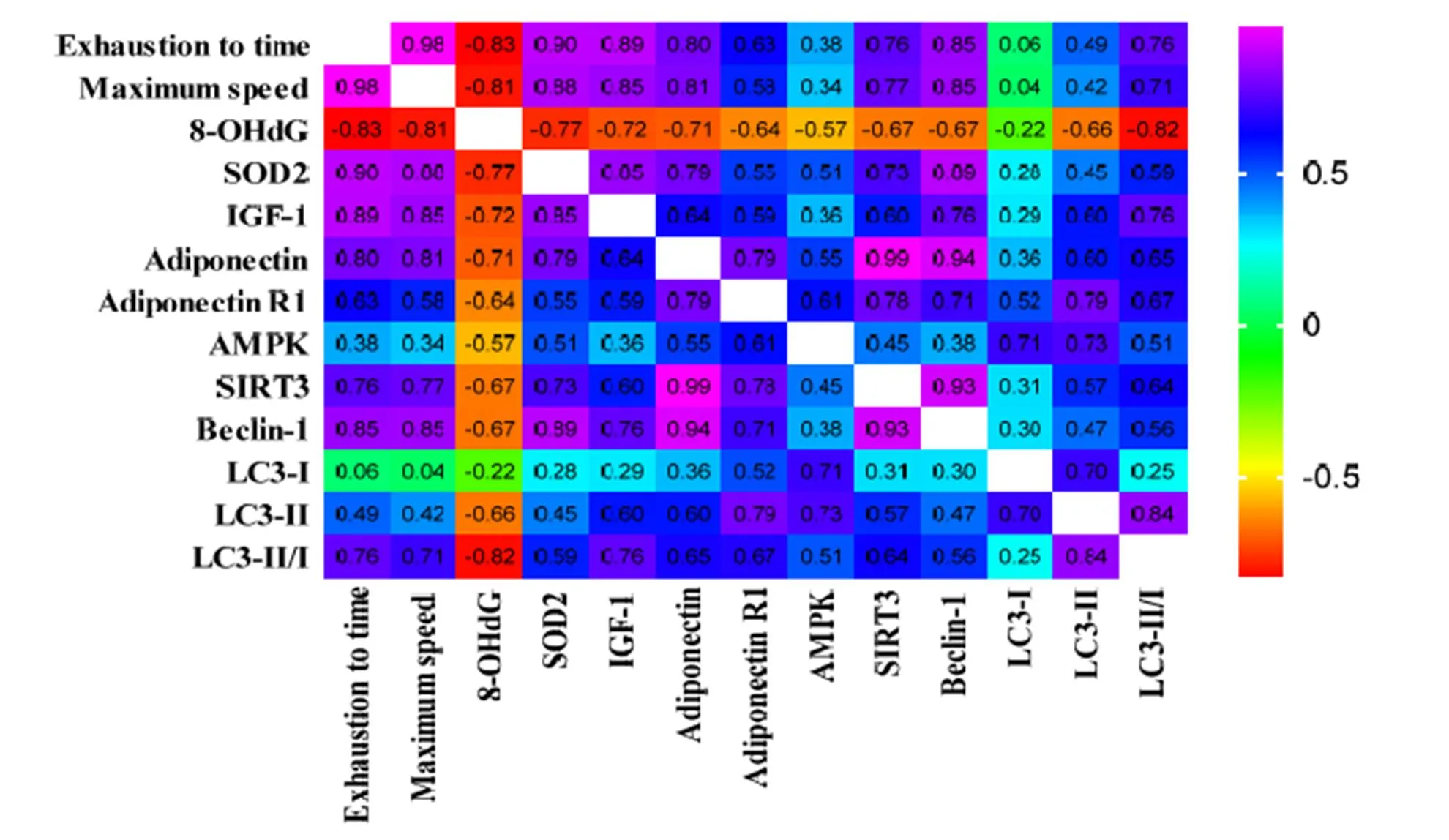
图6 各功能参数之间Pearson相关性分析热图
Figure 6. Heatmap Analysis of Pearson Correlation between Functional Parameters
注:各个参数Pearson相关系数值在热图方格中显示。
3 讨论
3.1 HIIT对增龄大鼠体成分、运动表现和氧化应激的影响
DEXA法用于评定老年人肌肉质量衰减程度,再辅以握力、6 min步行、步速等6种身体活动能力测试是对衰老骨骼肌功能和结构的增龄性变化采用的常规方法[2]。本研究采用DEXA法对增龄大鼠体成分进行分析,同时对大鼠抓力、张力、跑步力竭时间和最大跑步速度进行测定[27]。如图1所示,8个月HIIT能使增龄大鼠瘦体重%增加,体脂%、脂肪与瘦体重比值显著降低,但MICT组大鼠体成分未发生明显变化。与本研究结果一致的是,Søgaard等[43]也发现,6周HIIT能降低老年人内脏脂肪和体脂%,并增加瘦体重占比。这提示,HIIT可抑制增龄过程中瘦体重向脂肪组织的转化。综上可知,相较于MICT,增龄大鼠进行长期HIIT对改善体成分、缓解衰老肌纤维萎缩的效果更有效。
Robinson等[38]最新研究将HIIT与抗阻训练、耐力联合抗阻训练对老年人肌肉衰减征的影响作比较,结果发现,HIIT对提升老年人有氧耐力、肌力、骨骼肌代谢功能优于其他两种运动方式。本研究结果显示,HIIT和MICT对改善大鼠跑步耐力的效果相似,但HIIT组大鼠抓力明显高于MICT组,而MICT对增龄大鼠抓力无显著影响(图2)。这与Seldeen等[40]的研究结果一致,该研究显示,16周HIIT能使增龄大鼠跑步力竭时间和抓力分别增加32.6%和10.9%。Bell等[9]进一步证实,HIIT在增强老年人肌力方面优于抗阻训练和MICT,可能与HIIT刺激肌浆网蛋白质合成有关。综上,HIIT在改善老年人有氧耐力的同时,也可缓解老年人肌纤维萎缩和肌力衰减,提示,HIIT兼具单纯有氧训练和力量训练的叠加效应。
氧化应激在肌肉衰减征发展过程中扮演着重要角色[4,21]。衰老骨骼肌线粒体内呼吸链电子漏出的ROS增加,将导致线粒体氧化损伤、肌纤维凋亡和蛋白质稳态失衡。本研究通过测定大鼠骨骼肌SOD2活性及MDA、4-HNE和8-OHdG含量评价骨骼肌氧化应激水平。SOD2作为线粒体抗氧化系统成员之一,可通过清除线粒体ROS减少脂质、蛋白质和DNA氧化损伤[8]。MDA和4-HNE可表征脂质过氧化程度,其中,MDA是脂质过氧化终产物,4-HNE是脂质氧化形成MDA的中间产物;8-OHdG是ROS直接损伤线粒体DNA片段,DNA链断裂及碱基异常修饰形成的DNA氧化产物,是表征DNA氧化损伤水平的产物[21]。8-OHdG可诱导线粒体膜电位降低和线粒体凋亡通路活化,导致肌纤维数目减少和肌肉萎缩[10]。习惯性运动可抵抗衰老骨骼肌氧化应激损伤[35]。但不同肌纤维类型的抗氧化系统对不同运动方式的反应和适应呈现特异性[3]。李海鹏等[3]研究发现,21周负重爬梯和跑台运动对快速老化小鼠(SAMP8)腓肠肌和胫骨前肌的抗氧化酶活性均有增强作用,然而仅腓肠肌内非酶类抗氧化防御体系发生上调。说明,衰老腓肠肌抗氧化系统对运动干预的适应性更好[3]。本研究结果显示,MICT组和HIIT组大鼠血清和腓肠肌4-HNE、8-OHdG含量低于SED组,且HIIT组大鼠腓肠肌MDA含量低于MICT组(图3)。提示,尽管长期MICT也能抑制增龄大鼠腓肠肌脂质氧化和DNA氧化损伤,但HIIT维持衰老腓肠肌的氧化-抗氧化系统平衡的效应优于MICT。鉴于腓肠肌抗氧化酶SOD2活性变化可推测,HIIT可能依赖非酶类抗氧化防御体系或其他抗氧化酶活性来实现对衰老腓肠肌氧化-抗氧化稳态调节。本研究进一步显示,腓肠肌SOD2活性与跑步力竭时间和最大跑步速度均呈正相关,腓肠肌8-OHdG含量与力竭时间和最大跑步速度呈负相关(图6),提示,长期运动延缓衰老骨骼肌形态和功能衰退可能与骨骼肌抗氧化系统功能增进有关[4,21]。
3.2 HIIT对增龄大鼠骨骼肌细胞自噬活性的影响
细胞自噬作为骨骼肌必需的代偿性内置调节机制,参与骨骼肌线粒体质量控制和线粒体代谢功能网络稳态的维持[6]。自噬体形成过程中,LC3-I需不断形成LC3-II,进而促进自噬体膜的形成,当自噬泡即将闭合时,只有膜结合形式的LC3-II能定位于自噬泡的膜上,故把LC3-II作为自噬体存在的标志,而LC3-II/LC3-I比值可表征自噬活性水平[34]。此外,Beclin-1表达水平也被证实是自噬体形成的正向调控因子[5]。现已发现,衰老骨骼肌细胞自噬水平降低可导致线粒体质量控制体系紊乱,功能异常的线粒体堆积,进而引发呼吸链电子泄漏和ROS生成增加[25,30]。而适度上调自噬水平有利于降解衰老骨骼肌中功能异常的线粒体,维持骨骼肌能量代谢平衡[48]。
Luo等[30]研究发现,9周抗阻运动可提高增龄大鼠腓肠肌Beclin-1和LC3-II蛋白表达及LC3-II/LC3-I比值,进而抑制腓肠肌氧化应激损伤和细胞凋亡。本研究比较了MICT和HIIT两种运动方式对增龄大鼠腓肠肌细胞自噬的影响(图4)。结果发现,HIIT组大鼠腓肠肌Beclin-1、LC3-I、LC3-II蛋白表达及LC3-II/LC3-I比值均增加,但MICT组大鼠腓肠肌仅Beclin-1蛋白表达增加,LC3-II蛋白表达稍有增加,但无统计学意义,这与Kim等[25]的研究结果一致。提示,与MICT相比,HIIT中的短时间大强度训练对于提高骨骼肌自噬活性尤为重要[27,28]。Li等[27,28]也比较HIIT和MICT对青年大鼠不同肌纤维类型自噬活性的影响。结果表明,HIIT能提高比目鱼肌和心肌的自噬活性,但对股外侧肌自噬活性没有影响,而MICT对上述3种肌肉类型的细胞自噬无显著影响[27,28]。提示,骨骼肌自噬适应性改变与肌纤维类型及运动方式均有关。然而,HIIT对增龄大鼠不同肌纤维类型细胞自噬的影响仍需进一步研究。本研究也进一步发现,腓肠肌LC3-II/LC3-I比值与8-OHdG含量呈负相关,但与跑步力竭时间、最大跑步速度及腓肠肌SOD2活性呈正相关(图6),提示,增强自噬活性有利于降低衰老腓肠肌过度的氧化应激水平,抵抗肌纤维萎缩,进而改善大鼠运动表现。
3.3 HIIT对增龄大鼠骨骼肌脂联素/AMPK信号途径和IGF-1/SIRT3轴的影响
脂联素因其具有改善骨骼肌细胞自噬、增强骨骼肌抗氧化能力和线粒体氧化代谢等功能而备受关注[12]。横断面研究发现,健康老年人骨骼肌脂联素敏感性降低将会导致血清脂联素浓度增加,后者与肌肉力量和有氧适能水平衰减有关[23]。细胞模型也表明,骨骼肌脂联素抵抗可诱导肌细胞线粒体功能紊乱和氧化应激损伤,导致肌细胞萎缩[41,46]。骨骼肌脂联素抵抗与肌细胞膜上脂联素受体1蛋白表达及其下游信号分子AMPK活性降低有关[41]。有研究已证实,脂联素/脂联素受体1可通过激活AMPK诱导骨骼肌细胞自噬[14],进而抑制快速老化小鼠骨骼肌细胞氧化应激和凋亡[19]。图5显示,HIIT和MICT组大鼠血清脂联素浓度降低,腓肠肌脂联素蛋白表达增加,但只有HIIT组大鼠腓肠肌脂联素受体1和AMPK蛋白表达增加。提示,HIIT对于刺激增龄大鼠骨骼肌脂联素受体1/AMPK信号通路活化的作用强于MICT。肥胖大鼠模型研究也证实,HIIT能上调肥胖大鼠骨骼肌脂联素和脂联素受体1蛋白及激活下游的AMPK信号通路,进而改善肥胖大鼠骨骼肌氧化代谢水平和运动表现[31]。本研究结果也显示,增龄大鼠腓肠肌脂联素(=0.80)和脂联素受体1蛋白表达(=0.63)与跑步力竭时间呈正相关(图6)。这也间接说明,激活衰老骨骼肌脂联素信号通路可能与大鼠耐力表现改善有关。同时,腓肠肌AMPK与脂联素(=0.55)和脂联素受体1(=0.61)蛋白表达呈正相关,LC3-II/LC3-I比值与脂联素(=0.65)、脂联素受体1(=0.67)和AMPK(=0.51)也呈正相关(图6),由此推测,腓肠肌脂联素/AMPK信号途径可能参与对自噬活性的正向调控作用。然而,该途径是否介导HIIT对衰老骨骼肌自噬的调节作用仍需基因修饰动物实验的直接证实。
作为依赖于烟酰胺腺嘌呤二核苷酸辅酶组蛋白去乙酰化酶家族成员之一,SIRT3主要通过调节线粒体抗氧化酶活性和细胞自噬来维持线粒体稳态[1]。骨骼肌特异性过表达SIRT3可促进慢肌纤维转换和线粒体氧化代谢酶表达,进而增强小鼠有氧耐力[29]。但衰老进程中骨骼肌SIRT3活性和蛋白表达减少将导致运动能力衰减和线粒体功能失调[17,26]。运动可使老年人骨骼肌SIRT3蛋白表达增加,进而加速衰老骨骼肌线粒体生物合成速率[26]。本研究结果显示,HIIT组和MICT组大鼠腓肠肌SIRT3蛋白表达增加(图5),且SIRT3蛋白表达与跑步力竭时间(=0.76)和最大跑步速度(=0.77)呈正相关(图6)。提示,HIIT和MICT抵抗腓肠肌肌纤维萎缩和增强运动耐力可能与腓肠肌SIRT3蛋白表达上调有关。骨骼肌胰岛素抵抗细胞模型研究证实,SIRT3介导AMPK对骨骼肌细胞自噬的正向调控过程[42]。本研究结果也显示,腓肠肌SIRT3与Beclin-1、LC3-II和LC3-II/LC3-I比值呈正相关(图6),说明,SIRT3也可能介导AMPK正向调控衰老骨骼肌自噬活性。综上,HIIT可通过脂联素/脂联素受体1/AMPK/SIRT3信号途径调节腓肠肌细胞自噬活性(图7)。
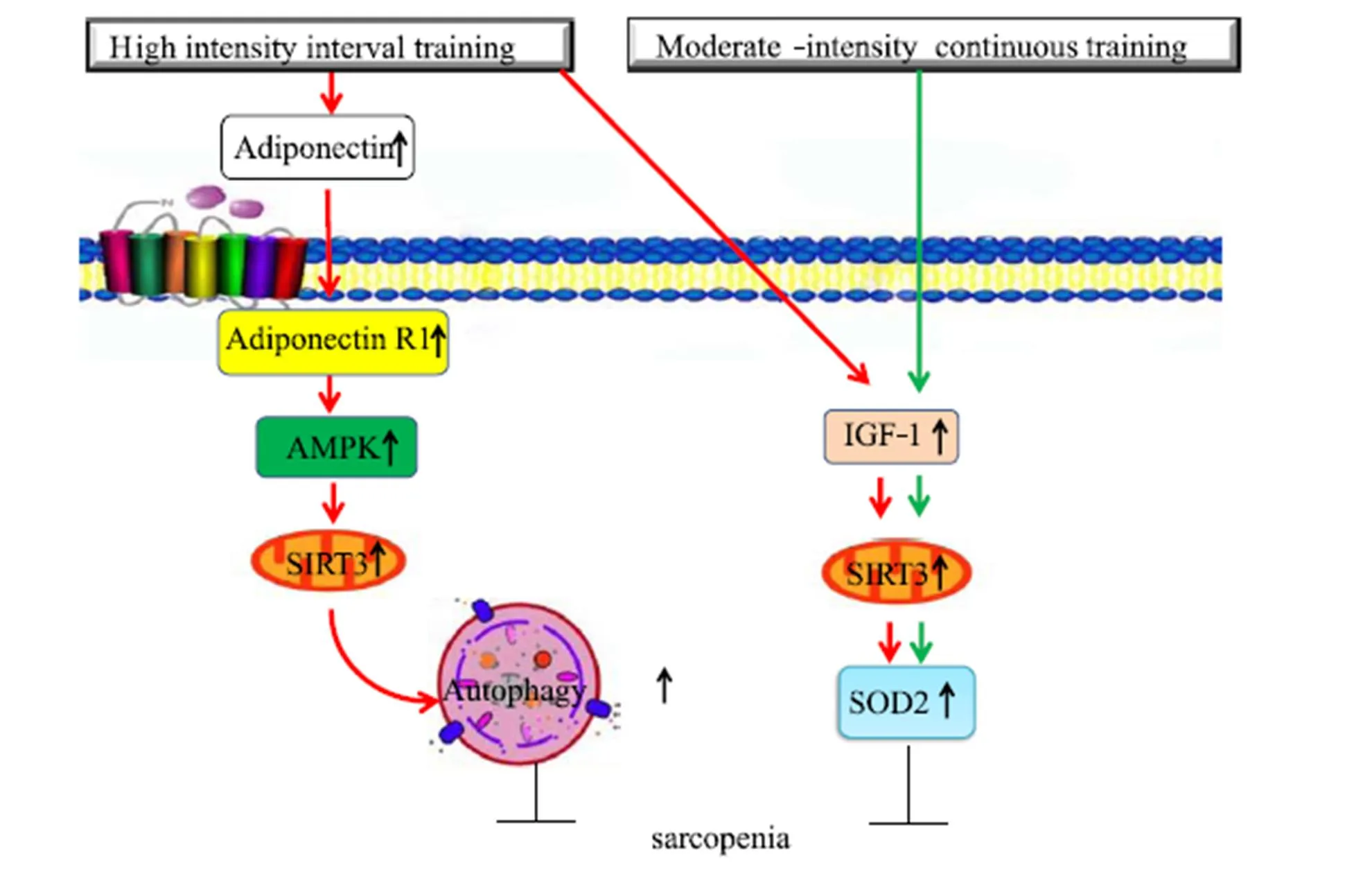
图7 HIIT调控骨骼肌腓肠肌脂联素/AMPK信号途径和自噬的可能机制
Figure 7. Schematic of Relevant Mechanisms in HIIT Regulated Adiponectin/AMPK Signaling and Autophagy
注:红色箭头表示HIIT调节作用;绿色箭头表示MICT调节作用,黑色箭头表示该蛋白表达上调。
Luo等[30]发现,衰老大鼠腓肠肌IGF-1自分泌降低与肌细胞氧化应激和肌细胞凋亡率增加有关。细胞模型证实,IGF-1能增强肌细胞的抗氧化应激能力[50]。抗阻运动和自主转轮运动能增加老龄大鼠腓肠肌中IGF-1蛋白表达,进而提升腓肠肌抗氧化活性并降低氧化应激损伤,保护衰老骨骼肌结构和功能[24,30]。本研究通过比较MICT和HIIT对衰老腓肠肌IGF-1自分泌的影响,结果也发现,与SIRT3和SOD2相似,MICT和HIIT可同等程度地促进衰老腓肠肌分泌IGF-1(图3E)。这与Muñoz等[32]的研究结果一致,他们发现,长期运动通过促进衰老大鼠大脑黑质神经元SIRT3和IGF-1蛋白表达,降低多巴胺能神经元氧化应激损伤。文献证实,骨骼肌自分泌IGF-1可通过激活PI3K/Akt/PGC-1α信号通路来促进骨骼肌SIRT3蛋白表达[16,44],后者可提升线粒体SOD2活性和蛋白表达。图6显示,腓肠肌IGF-1与SIRT3蛋白含量(=0.60)和SOD2活性(=0.85)呈正相关。推测,HIIT和MICT可能通过激活IGF-1/SIRT3轴提高腓肠肌SOD2活性,进而降低脂质过氧化和DNA氧化损伤。然而,骨骼肌自分泌IGF-1调控SIRT3蛋白表达及其具体机制有待进一步揭示。
4 结论
长期高强度间歇训练可能通过IGF-1/SIRT3轴上调骨骼肌SOD2活性水平,防止骨骼肌氧化损伤,同时也可能通过激活脂联素/AMPK信号途径上调衰老骨骼肌自噬活性,从而可抵抗增龄大鼠肌肉质量丢失,并改善大鼠运动表现。
[1] 李方晖,曹伟,赵军,等. 去乙酰化酶的功能及其在体育科学中的应用[J]. 体育学刊, 2011, 18(6):138-144.
[2] 李海鹏,刘宇,黄灵燕,等. 两种肌肉衰减症的国际共识在上海社区老年女性研究中的应用[J]. 中国体育科技, 2017, 53(4):106-113.
[3] 李海鹏. 运动对Sarcopenia关联的抗氧化能力及线粒体介导的细胞凋亡信号通路的影响[D]. 上海:华东师范大学, 2009.
[4] 孟思进,余龙江,雷玲. 氧化应激在衰老性肌萎缩中的作用机理与运动干预探讨[J]. 武汉体育学院学报, 2010, 44(1):73-76,82.
[5] 漆正堂,丁树哲. 运动适应的细胞信号调控:线粒体的角色转换及其研究展望[J]. 体育科学, 2013, 33(7):65-69.
[6] 钱帅伟,罗艳蕊,漆正堂,等. 细胞自噬的分子学机制及运动训练的调控作用[J]. 体育科学, 2012, 32(1):64-70.
[7] 田野.运动生理学高级教材[M]. 北京:高等教育出版社, 2003.
[8] 王立丰,李海鹏,王静,等. 抗阻训练对小鼠骨骼肌DNA损伤、脂质过氧化及抗氧化能力的影响[J].体育学刊,2010,17(8):107-111.
[9] BELL K E, SÉGUIN C, PARISE G,Day-to-daychanges in muscleproteinsynthesis in recovery from resistance, aerobic, and high-intensityintervalexercise in oldermen[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(8):1024-1029.
[10]CAKATAY U, AYDIN S, YANAR K,. Gender-dependent variations in systemic biomarkers of oxidative protein, DNA, and lipid damage in aged rats[J]. Aging Male, 2010, 13(1):51-58.
[11]CARNEIRO-JÚNIOR M A, PRÍMOLA-GOMES T N, QUINTÃO-JÚNIOR J F,. Regional effects of low-intensity endurance training on structural and mechanical properties of rat ventricular myocytes[J]. J Appl Physiol (1985), 2013, 115(1):107-115.
[12]CHINA S P, PAL S, CHATTOPADHYAY S,Globular adiponectin reverses osteo-sarcopenia and altered body composi-tion in ovariectomized rats[J]. Bone,2017, 105:75-86.
[13]FILOMENI G, DE ZIO D, CECCONI F.Oxidative stress and autophagy: the clash between damage and metabolic needs[J]. Cell Death Differ, 2015, 22(3):377-388.
[14]GAMBERI T, MODESTI A, MAGHERINI F,.Activation of autophagy by globularadiponectin is required for muscledifferentiation[J]. Biochim Biophys Acta, 2016, 1863(4):694-702.
[15]GARCÍA-PRAT L, MARTÍNEZ-VICENTE M, PERDIGUERO E,Autophagy maintains stemness by preventing senescence[J]. Nature, 2016, 529(7584):37-42.
[16]HADEM I K, SHARMA R. Age- and tissue-dependent modula-tion of IGF-1/PI3K/AKT protein expression by dietary restriction in mice[J]. Horm Metab Res, 2016, 48(3):201-206.
[17]HEBERT S L, MARQUET-DE ROUGÉ P, LANZA I R,. Mitochondrial aging and physical decline: insights from three generations of women[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(11):1409-1417.
[18]HEISKANEN M A, LESKINEN T, HEINONEN I H,Rightventricularmetabolicadaptations to high-intensityinterval and moderate-intensitycontinuoustraining in healthymiddle-agedmen[J]. Am J Physiol Heart Circ Physiol, 2016, 311(3):H667-675.
[19]INOUE A, CHENG X W, HUANG Z,Exerciserestoresmusclestemcellmobilization, regenerativecapacity and musclemetabolicalterationsviaadiponectin/AdipoR1activation in SAMP10mice[J]. J Cachexia Sarcopeni, 2017, 8(3):370-385.
[20]JANG Y C, VAN REMMEN H. The mitochondrial theory of aging: insight from transgenic and knockout mouse models[J]. Exp Gerontol, 2009, 44(4):256-260.
[21]JI L L, LEICHTWEIS S.Exercise and oxidative stress: Sources of free radicals and their impact on antioxidant systems[J]. Age (Omaha), 1997, 20(2):91-106.
[22]JORTAY J, SENOU M, ABOU-SAMRA M,.Adiponectin and skeletalmuscle: pathophysiologicalimplications in metabolicstress[J]. Am J Pathol, 2012, 181(1):245-256.
[23]KARVONEN-GUTIERREZ C A, ZHENG H, MANCUSO P,. Higher leptin and adiponectin concentrations predict poorer performance-based physical functioning in midlife women: the Michigan study of women's health across the nation[J]. J Gerontol A Biol Sci Med Sci, 2016, 71(4):508-514.
[24]KIM J H, KWAK H B, LEEUWENBURGH C,. Lifelong exercise and mild (8%) caloric restriction attenuate age-induced alterations in plantaris muscle morphology, oxidative stress and IGF-1 in the Fischer-344 rat[J]. Exp Gerontol, 2008, 43(4):317-329.
[25]KIM Y A, KIM Y S, OH S L,.Autophagic response to exercise training in skeletal muscle with age[J]. J Physiol Biochem, 2013, 69(4):697-705
[26]LANZA I R, SHORT D K, SHORT K R,.Enduranceexercise as a countermeasure for aging[J]. Diabetes, 2008, 57(11):2933-2942.
[27]LI F H, LI T, AI J Y,Beneficialautophagicactivities, mitochondrialfunction, and metabolicphenotypeadaptationspromoted by high-intensityintervaltraining in a ratmodel[J]. Front Physiol, 2018, 9:571.
[28]LI F H, LI T, SU Y M,.Cardiac basal autophagic activity and increased exercise capacity[J]. J Physiol Sci, 2018. [Epub ahead of print]
[29]LIN L, CHEN K, ABDEL KHALEK W,.Regulation of skeletalmuscleoxidativecapacity and musclemass by SIRT3[J]. PLoS One, 2014, 9(1):e85636.
[30]LUO L, LU A M, WANG Y,.Chronic resistance training activates autophagy and reduces apoptosis of muscle cells by modulating IGF-1 and its receptors, Akt/mTOR and Akt/FOXO3a signaling in aged rats[J]. Exp Gerontol, 2013, 48(4):427-36.
[31]MARTINEZ-HUENCHULLAN S F, MAHARJAN B R, WILLIAMS P F,Differentialmetaboliceffects of constantmoderateversushighintensityintervaltraining in high-fatfedmice: possiblerole of muscleadiponectin[J]. Physiol Rep, 2018, 6(4):e13599.
[32]MUÑOZ A, CORRÊA C L, LOPEZ-LOPEZ A,.Physicalexerciseimprovesaging-relatedchanges in angiotensin, IGF-1, SIRT1, SIRT3 and VEGF in the substantianigra[J]. J Gerontol A Biol Sci Med Sci, 2018. [Epub ahead of print]
[33]SALLAM N, LAHER I. Exercise modulates oxidative stress and inflammation in aging and cardiovascular diseases[J]. Oxid Med Cell Longev, 2016, 2016:7239639.
[34]OGURA Y, IEMITSU M, NAITO H,.Single bout of running exercise changes LC3-II expression in rat cardiac muscle[J]. Biochem Biophys Res Commun, 2011, 414(4):756-760.
[35]RADÁK Z, CHUNG H Y, NAITO H,. Age-associated increase in oxidative stress and nuclearfactorkappaBactivation are attenuated in ratliver by regularexercise[J]. FASEB J, 2004, 18(6):749-750.
[36]REN Y, LI Y, YAN J,. Adiponectinmodulatesoxidativestress-inducedmitophagy and protectsC2C12myoblastsagainstapoptosis[J].Sci Rep, 2017, 7(1):3209.
[37]RENEAU J, GOLDBLATT M, GOULD J,. Effect of adiposity on tissue-specific adiponectin secretion[J]. PLoS One, 2018, 13(6):e0198889.
[38]ROBINSON M M, DASARI S, KONOPKA A R,.Enhanced protein translation underlies improved metabolic and physical adaptations to different exercise training modes in young and old humans[J]. Cell Metab, 2017, 25(3):581-592.
[39]SCHIAFFINO S, REGGIANI C.Fibertypes in mammalianskeletal muscles[J]. Physiol Rev, 2011, 91(4):1447-1531.
[40]SELDEEN K L, LASKY G, LEIKER M M,.High intensity interval training improves physical performance and frailty in aged mice[J]. J Gerontol A Biol Sci Med Sci, 2018, 73(4):429-437.
[41]SENTE T, VAN BERENDONCKS A M, HOYMANS V Y,.Adiponectin resistance in skeletal muscle: pathophysiological implications in chronic heart failure[J]. J Cachexia Sarcopeni , 2016, 7(3):261-274.
[42]SHI L, ZHANG T, ZHOU Y,.Dihydromyricetinimprovesskeletal muscleinsulin sensitivity by inducingautophagyvia the AMPK-PGC-1α-Sirt3 signaling pathway[J]. Endocrine, 2015, 50(2):378-389.
[43]SØGAARD D, LUND M T, SCHEUER C M,.High-intensity interval training improves insulin sensitivity in older individuals[J]. Acta Physiol (Oxf), 2018, 222(4):e13009.
[44]SONG C, ZHAO J, FU B,. Melatonin-mediated upregulation of Sirt3 attenuates sodium fluoride-induced hepatotoxicity by activating the MT1-PI3K/AKT-PGC-1α signaling pathway[J]. Free Radic Biol Med,2017, 112:616-630.
[45]STARON R S, HAGERMAN F C, HIKIDA R S,. Fiber type composition of the vastus lateralis muscle of young men and women[J]. J Histochem Cytochem, 2000, 48(5):623-629.
[46]VAN BERENDONCKS A M, BECKERS P, HOYMANS V Y,. Exercise training reduces circulating adiponectin levels in patients with chronic heart failure[J]. Clin Sci (Lond), 2010, 118(4):281-289.
[47]VILELA T C, EFFTING P S, DOS SANTOS PEDROSO G,.Aerobic and strengthtraininginducechanges in oxidativestressparameters and elicitmodifications of various cellularcomponents in skeletalmuscle of agedrats[J]. Exp Gerontol, 2018, 106:21-27.
[48]WOHLGEMUTH S E, SEO A Y, MARZETTI E,.Skeletal muscle autophagy and apoptosis during aging: effects of calorie restriction and life-long exercise[J]. Exp Gerontol, 2010, 45(2):138-148.
[49]XU A, SWEENEY G.Emergingrole of autophagy in mediatingwidespreadactions of ADIPOQ/adiponectin[J]. Autophagy, 2015, 11(4):723-724.
[50]YANG S Y, HOY M, FULLER B,. Pretreatment with insulin-like growth factor I protects skeletal muscle cells against oxidative damage via PI3K/Akt and ERK1/2 MAPK pathways[J]. Lab Invest, 2010, 90(3):391-401.
Effects of Long-term High-intensity Interval Training on Adiponectin/AMPK Signaling Pathway and Autophagyin Skeletal Muscle of Aged Rats
SUN Lei, LI Fang-hui
Nanjing Normal University, Nanjing 210046, China.
Objective:To investigate the effects of 8-month high-intensive intervel training (HIIT) and moderate-intensity continuous training (MICT) on adiponectin/AMPK pathway and autophagy in skeletal muscle of aged rats. Methods: 36 female Sprague Dawley rats at 18 months old were selected randomly and divided into three groups: sedentary control (SED), moderate-intensity continuous training (MICT), and high-intensity intervel training group (HIIT), 12 rats per group. HIIT consisted of 9 intervals of 5-minute running on treadmill (1 minutes at 25 m/min and 4 minutes at 15 m/min), MICT consisted of 45 min of continuous exercise at a moderate intensity (17 m/min) per day, 5 times per week for 8 months, SED group were fed freely but not trained.The body composition was measured by dual-energy X-ray at 48 h after the last training. Handing time, grip strength, maximum running speed, and exhaustion to time were measured 48 h after body composition test. Malonylaldehyde (MDA) and superoxide dismutase 2 (SOD2) levels of gastrocnemius were measured, and levels of 4-hydroxynonenal (4-HNE), 8-hydroxydeoxyguanosine (8-OHdG), and insulin-like growth factor 1 (IGF-1) of gastrocnemius were assessed using ELISA. Western blotting was used to evaluate the protein expression of adiponectin, adiponectin receptor 1, sirtuin 3 (SIRT3), adenosine 5-monophosphate-activated protein kinase (AMPK), and autophagy (Beclin-1, LC3-I, LC3-II). Results: Compared with the SED and MICT groups, the percent lean, the percent body fat, and body fat to lean mass ratio of HIIT group were significantly increased. HIIT resulted in a larger improvement in grip strength related to MICT group, with similar increase in inclined plane performance, maximum running speed, and exhaustion to time as compared with the SED group. The protein expression of SOD2 and IGF-1 in the gastrocnemius significantly increased, while the serum IGF-1 levels significantly decreased in both HIIT and MICT groups when compared with the SED group (P<0.01). The gastrocnemius and serum levels of 4-HNE and 8-OHdG in the HIIT and MICT groups were lower than those in SED group. Gastrocnemius and serum MDA levels in HIIT group were lower than those in MICT and SED groups (P<0.01). HIIT group showed a significant elevation in adiponectin, adiponectin receptor 1, AMPK, and SIRT3 protein content as compared with the SED group. HIIT group experienced higher protein expression of AMPK and adiponectin receptor 1 compared with the MICT group (P<0.05). Additionally, HIIT group showed a significant elevation of Beclin-1, LC3-I, LC3-II protein expression, and LC3-II/LC3-I ratio compared with the SED group. Correlation analysis showed that exhaustion to time were positive with adiponectin, adiponectin receptor 1, AMPK, and LC3-II/LC3-I ratio, respectively. Conclusions: Long-term high-intensity intervel training upregulate the SOD2 activity may be via IGF-1/SIRT3 axis, preventing skeletal muscle oxidative stress, furthermore, it may also upregulate the autophagic activity by activiting adiponectin/AMPK pathway, attenuating the loss of muscle mass and improving the physical performance in aged rats model.
G804.7
A
1000-677X(2018)11-0050-10
10.16469/j.css.201811005
2018-09-13;
2018-11-02
国家自然科学基金青年项目(31500961); 广东省省级科技计划项目(2014A020220015); 江苏省高等学校自然科学资助项目(18KJB180011)。
孙磊,男,在读硕士研究生,主要研究方向为运动与抗衰老,E-mail: slyouknow@163.com。
李方晖,男,副教授,博士,主要研究方向为运动抗衰老机制研究,E-mail: 12356@njnu.edu.cn。

