豌豆根瘤菌gshR基因的抗氧化和共生固氮作用
程国军,谢 婧,殷 杰,彭 杨
(中南民族大学 生命科学学院, 武汉 430074)
谷胱甘肽还原酶(GshR)是一个约为125 kDa的蛋白质,广泛存在于细胞核、线粒体、过氧化物酶体和内质网中,在保护生物体方面起关键作用[2].GshR是依赖NADPH的氧化还原酶家族的一员,是在抗坏血酸-谷胱甘肽(ASA-GSH)循环中作为ROS解毒至关重要的抗氧化酶.高效的GshR可维持细胞中GSH/GSSH处于高值,对GSH抗氧化剂的功能非常重要[3].Ku M等[4]发现白色念珠菌gshR基因突变株丧失硫氧还蛋白1、2的基因活性,细胞成丝情况、抗氧化性质及丙酮醛含量明显下降,以致无法存活.将谷胱甘肽还原酶编码基因导入大肠杆菌后转入载体,在H2O2环境下表达的GshR融合蛋白活性高于自然条件下4倍,表明GshR蛋白在机体处于不利环境时有解毒作用.李智燕等[5]对天蓝苜蓿和紫花苜蓿根瘤菌CAT(过氧化氢酶)、GshR等抗氧化酶系研究表明在高浓度铝作用下,GshR失去防御能力而被破坏,活性降低.马占强等[6]人对苜蓿中华根瘤菌Sinorhizobiummeliloti研究表明该菌株可通过提高SOD(超氧化物歧化酶)、GshR等酶的活性,降低铜离子的毒害效应.Muglia C等[7]构建了热带根瘤菌RhizobiumtropiciGSH合成酶基因缺失突变株,该突变株接种菜豆宿主,形成低固氮活性的不正常根瘤.
豌豆根瘤菌3841gshR基因编码谷胱甘肽还原酶,本文通过构建豌豆根瘤菌gshR基因突变株,进一步研究谷胱甘肽还原酶基因突变对根瘤菌抗氧化以及共生固氮的影响,为阐明谷胱甘肽还原酶在根瘤菌抗氧化体系中的作用机制提供理论基础.
1 材料与方法
1.1 材料与仪器
实验菌株为野生型豌豆根瘤菌RL3841和大肠杆菌(Escherichiacoli)DH5α,RLgshR为本次试验构建的RL3841突变体,克隆载体 pK19mob由英国牛津大学Philip S Poole教授提供.甜豌豆种子为本实验室保存.大肠杆菌用LB培养基于37 ℃培养,豌豆根瘤菌用AMS或TY培养基于30 ℃培养.豌豆根瘤菌培养所用抗生素(Sigma)及浓度:新霉素(Neo)80 μg/mL,链霉素(Str)500 μg/mL,壮观霉素(spe) 100 μg/mL;大肠杆菌培养所用抗生素及浓度:四环素(Tc)5 μg/mL,卡那霉素(Km)20 μg/mL.
限制性内切酶(XbaI、BamH I、Hind III等)、T4 DNA连接酶、RNAiso Plus、限制性内切酶均购于TaKaRa公司;TaqDNA 聚合酶、phusion 高保真酶购于Thermo Scientific公司;PCR产物及DNA凝胶回收试剂盒等购于博大泰克公司;反转录所用试剂为 PrimeScriptTMRT reagent Kit,FastStart Universal SYBR Green Master (Rox).
1.2 RLgshR突变菌株的构建
构建gshR基因突变株参照田梦洋等[8]方法,以RL3841总DNA为扩增模板,gshR的上游和下游引物(见表1)进行PCR反应.将pK19mob载体与目的片段分别用XbaI和Hind III双酶切后,经T4 DNA连接酶过夜连接,转化大肠杆菌DH5α感受态,转化子经检测后,获得阳性重组转化子pKgshR.再进行三亲本结合实验,其中RL3841为受体菌,大肠杆菌pKgshR为供体菌,大肠杆菌pRK2013为辅助菌,通过抗生素平板及以M13/RLgshRMP为引物的 PCR验证,最终获得gshR基因突变菌株RLgshR.
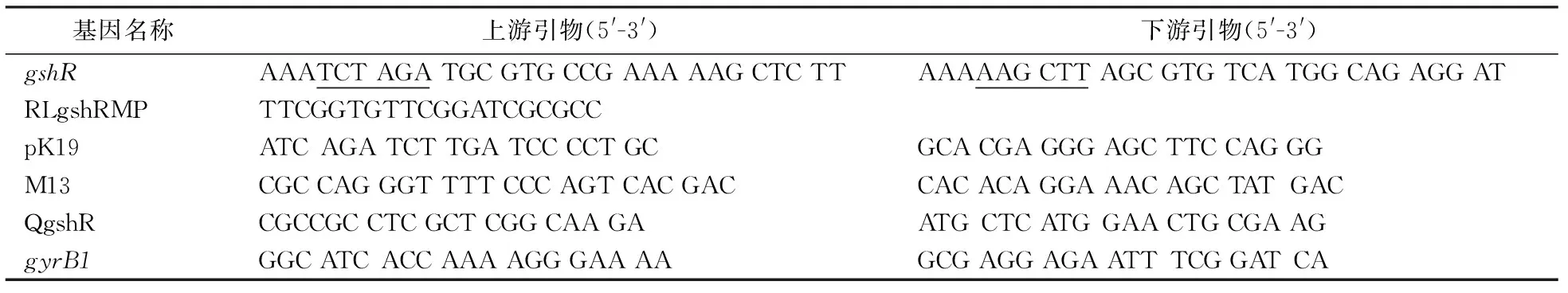
表1 PCR引物序列
注:____为限制性酶切位点
1.3 菌株的生长试验
1.3.1 菌株的自由生长
将已活化的RLgshR与RL3841菌株接种于添加相应抗生素的TY培养基,30 ℃培养2 d后,用AMS培养基洗脱、重悬,使其初始D(600 nm)=0.01,30 ℃,200 r/min恒温摇床培养,间隔取样测其D(600 nm),3组平行试验.
1.3.2 抑菌试验
在BOTs的发病机理中,有两条途径被提出。 首先是涉及BRAF和KRAS突变的“低级”途径。 根据这一途径,浆液性卵巢囊腺瘤进展为浆液性BOTs,最终通过连续的组织学前驱病变导致低度浆液性上皮性卵巢癌[4]。 所有浆液性BOTs中只有2%通过这种“低级”途径进展至癌症。 其次是涉及p53基因突变的“高级”途径。 大多数浆液性卵巢癌属于这种高级途径,没有已知的前体。 血清BOTs可以抑制SERPINA 5和双特异性磷酸酶4DUSP4两种基因的活化,而它们实质上是由细胞外基质降解的特异性肿瘤抑制基因,这是侵袭性生长发病的关键因素[5]。
使用处于对数生长期的RLgshR和RL3841菌株,用蒸馏水洗脱,使菌悬液D(600 nm)=1,涂布于AMS培养基平板,待平板晾干后,分别将含有不同浓度的氢过氧化枯烯(CuOOH)、双氧水(H2O2)滤纸片置于平板中央,30 ℃培养24 h,测量抑菌圈直径,3组平行试验.CuOOH溶于95%无水乙醇,以润有95%无水乙醇的圆滤纸片作为对照.
1.4 荧光定量RT-PCR
将活化的RL3841接种于AMS液体培养基,30 ℃,200 r/min摇床培养至对数期时D(600 nm)=0.3~0.6,每种菌3个重复.菌体离心收集后,用0.5 mmol/L H2O2处理1 h,对照组用生理盐水处理.采用Trizol法提取总RNA,经PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒将其反转录成cDNA,再对cDNA模板进行荧光定量PCR.gshR基因荧光定量PCR的引物见表1,gyrB1为内参基因.
类菌体RNA提取时,将培养25 d的豌豆植株摘取根瘤放置于研钵中,加入液氮,研磨至粉状,其后续RNA提取和cDNA制备等步骤与细菌RNA提取相同.其中对照组为无H2O2处理的AMS自生培养中对数期的3841菌株.gyrB1为内参基因,对类菌体中gshR基因进行荧光定量分析.
1.5 植物盆栽试验
采用蛭石作为基质种植甜豌豆[8].将实验室保存的甜豌豆经95%乙醇、2%次氯酸钠水溶液表面消毒后,无菌水清洗播种于已灭菌并含有营养液的蛭石塑料烧杯中,每杯3颗豌豆,每种菌种3组重复,在每颗豌豆上接种1 mL相应的菌悬液.播种完毕后用蛭石掩埋、保鲜膜封口,置于光照培养箱中培养.控制培养条件:22 ℃、湿度70%、光照培养16 h;20 ℃、湿度70%,黑暗培养 8 h .盆栽1 周后,待幼苗生长,用无菌牙签将保鲜膜挑破,让幼苗长出,定期添加营养液.4周后利用乙炔还原法测量根瘤固氮酶活.
2 结果与分析
2.1 RLgshR突变菌株的构建
按照程国军等[9]突变体构建的方法,在含有链霉素和新霉素的抗性平板上长出单菌落.以利用M13/RLgshRMP为引物,对重组子进行PCR验证,扩增出约650 bp的基因片段,得到gshR目的基因突变株RLgshR.
2.2 gshR基因突变对菌株生长的影响
将已活化的RLgor与RL3841菌株以初始D(600 nm)为0.01接种于AMS液体培养基,摇床培养,间隔取样测其D(600 nm),每个菌株3次重复,并绘制生长曲线(见图1).
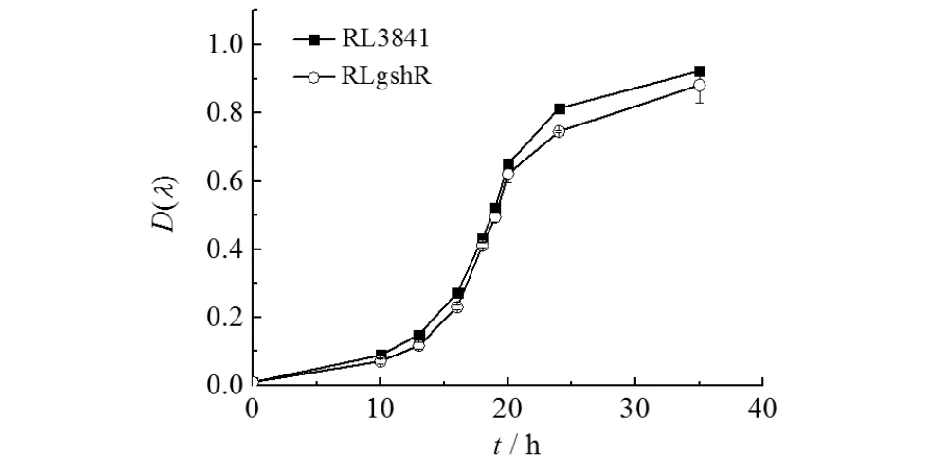
图1 野生型3841菌株与RLgshR菌株在AMS培养基中的生长情况Fig.1 Growth curves of wild type 3841 and RLgshR strain in AMS medium
由图1可知:RLgshR与RL3841菌株的生长变化趋势相同.经显著性方差分析,两种菌株在细菌数量增长上无显著差异,说明gshR基因突变不影响豌豆根瘤菌的正常生长.
2.3 gshR基因突变对菌株抗氧化物能力的影响
2.3.1gshR基因突变对根瘤菌抗H2O2的影响
无机氧化物H2O2对gshR基因突变株的抑菌能力结果见表2.当H2O2浓度为20 mmol/L时,RLgshR和RL3841的抑菌圈直径无显著差异;但当H2O2浓度分为100,500,1000 mmol/L时,RLgshR的抑菌圈的直径分别为10.87,17.60,21.53 cm,显著大于RL3841的抑菌圈直径(P<0.05),说明gshR基因突变虽不会影响豌豆根瘤菌抗低浓度H2O2的能力,但会严重影响其对较高浓度H2O2的抗性.
表2 不同浓度H2O2作用下RL3841和RLgshR的抑菌圈直径
Tab.2 Inhibition zone diameters of RL3841 and RLgshR under different concentrations of H2O2

c(H2O2)/(mmol·L-1)抑菌圈直径 / cmRL3841RLgshR203.40±0.404.07±0.211006.53±0.3510.87±0.38*50013.57±0.3517.60±0.46*100018.63±0.4021.53±0.42*
*与野生株RL3841相比,P<0.05
2.3.2gshR基因突变对根瘤菌抗CuOOH的影响
有机氧化物H2O2对gshR基因突变株的抑菌能力结果见表3.当CuOOH浓度分别为5,20,100,500 mmol/L,突变株RLgshR抑菌圈直径分别为3.50,8.50,15.17,18.50 cm,均显著大于RL3841的抑菌圈直径(P<0.05),表明gshR基因突变会严重影响根瘤菌抗有机氧化物CuOOH的能力.
表3 不同浓度CuOOH作用下RL3841和RLgshR菌株的抑菌圈直径
Tab.3 Inhibition zone diameters of RL3841 and RLgshR under different concentrations of CuOOH

c(CuOOH) / mmol·L-1抑菌圈直径 / cmRL3841RLgshR52.30±0.663.50±0.30*205.73±0.478.50±0.78*10011.77±0.8115.17±0.50*50015.40±0.5618.50±0.79*
*与野生株RL3841相比,P<0.05
2.4 植物盆栽试验
盆栽4周后,gshR基因突变株RLgshR接种豌豆植株形成红色有效根瘤.将培养4周的豌豆植株利用乙炔还原法测定根瘤固氮酶活(见图2 ).结果表明gshR基因突变对根瘤菌的共生表型和共生酶活无显著影响.
2.5 荧光定量RT-PCR分析gshR基因的表达量
用0.5 mmol/L H2O2处理 1 h,豌豆根瘤菌3841gshR基因的表达量为生理盐水对照组表达量的0.96±0.69倍;其在形成25 d根瘤类菌体中表达量为在自生条件下的1.26±0.17倍,经统计分析,gshR基因表达无显著差异,说明gshR基因的表达不受H2O2和共生环境的诱导.
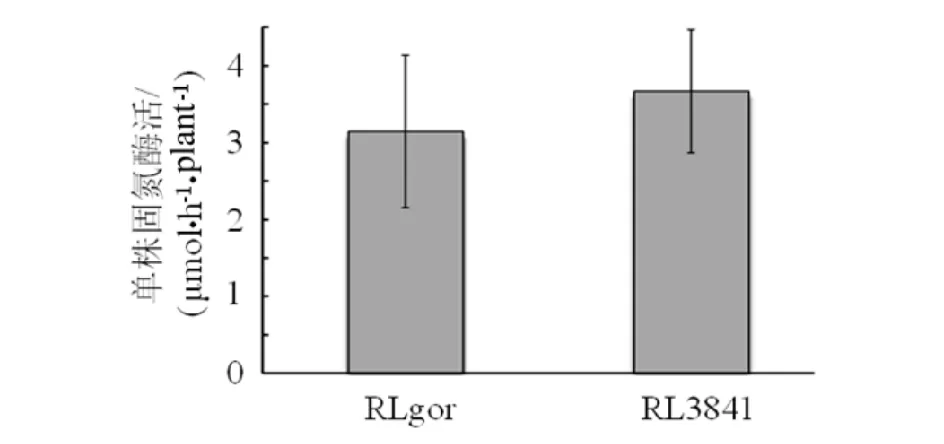
图2 RLgshR和RL3841的共生固氮酶活Fig.2 Symbiotic nitrogenase activity of RLgshR and RL3841
3 讨论
ROS可与氧化应激反应,无靶向性作用于脂质、蛋白质和DNA以诱导病理反应.豆科植物根瘤细胞已进化出防御系统,可维持细胞的氧化还原状态并减轻氧化应激所造成的损害[10],谷胱甘肽还原酶能将氧化型谷胱甘肽(GSSG) 还原成还原型谷胱甘肽(GSH),是活性氧的清除提供重要的还原力[7].本研究发现:豌豆根瘤菌gshR基因编码谷胱甘肽还原酶,该基因突变对根瘤菌RL3841的生长无影响,但是对有机氧化物CuOOH和较高浓度的无机氧化物H2O2十分敏感.在白念珠菌Candidaalbicans[4]、E.coil等细菌中,谷胱甘肽还原酶已被证明在抗氧化、机体解毒方面有重要作用.在乳酸乳球菌LactococcuslactisSK11[11]中发现菌株经H2O2处理,其死亡率高出自然条件下正常菌株的5.6倍.Riccillo P M等[12]研究发现热带根瘤菌R.tropici谷胱甘肽合成酶基因突变会显著降低根瘤菌抗酸和氧化物能力.经H2O2处理,野生型菌株3841中gshR基因的表达量无显著变化,说明gshR的表达不受外界H2O2的诱导.Soo J S等[13]研究发现,将Tigriopusjaponicus置于不用浓度的H2O2溶液中处理1 h,谷胱甘肽还原酶编码基因的表达量并无显著差异.
已有研究说明根瘤菌谷胱甘肽缺失突变会显著降低根瘤固氮酶活[7].但本研究中豌豆根瘤菌gshR基因缺失对植物共生和根瘤菌固氮酶活均无影响,由于其他抗氧化系统对缺失有补偿作用,如CAT酶、过氧化氢酶氧化应激系统可弥补细胞缺失GSH所造成的不足.

