重度阿尔茨海默病血清差异表达microRNA靶基因功能初步分析☆
罗新妮 宁玉萍 施海珊 侯乐 方子妍
阿尔茨海默病(Alzheimer disease,AD)是进展性神经退行性痴呆疾病,给社会和患者家庭带来沉重负担[1]。微小 RNA(microRNA,miRNA)是一类长度为19~23个核苷酸的高度保守非编码RNA,在转录后水平调控基因表达,对神经元形成、分化、突触塑造等过程具有重要调节作用。研究miRNA表达谱变化规律可了解AD发病过程[2]。有研究表明差异表达的miRNAs对AD患者具有良好的诊断敏感度和特异度[3],且部分miRNAs在AD患者的血清和脑脊液均与对照组存在表达差异[4]。但目前研究鲜有针对重度AD患者miRNA表达谱的研究。本研究使用高通量测序技术全面分析重度AD的血清miRNA表达谱特征,挖掘在重度AD患者血清中差异表达的miRNA,通过gene ontology(GO)功能富集分析和Kyoto encyclopedia of gene and genomes(KEGG)通路富集分析初步探索这些miRNA参与的生物学功能和通路,为深入探讨miRNA与AD发病机制的关联及寻找AD生物标志物提供依据。
1 对象与方法
1.1 研究对象重度AD组为2016年3月至6月广州市惠爱医院住院AD患者。入组标准:①符合《美国精神障碍诊断与统计手册第四版》(DSM-Ⅳ)痴呆诊断标准,及美国国立神经病语言障碍卒中研究所和AD及相关疾病协会(NINCDS-ADRDA)中“很可能的阿尔茨海默病”诊断标准[5],由2名神经内科副高或以上职称医师进行评估和诊断;②简易精神状态检查表(mini-mental state ex amination,MMSE)评分低于界值,即文盲≤17分、小学≤20分、初中及以上≤24分;③蒙特利尔量表 (Montreal cognitive assessment,MoCA)≤26分;④临床痴呆评定量表 (clinical dementia rating,CDR)为3分。排除标准:①其他脑部器质性改变所致痴呆,如脑出血、脑梗死、占位性病变等;②代谢性疾病、物质滥用及感染所致痴呆;③混合性痴呆;④患有其他重大躯体疾病或精神障碍。共收集7例重度AD患者。
对照组为2016年3月至6月在广州市惠爱医院公开招募的无认知障碍表现老年人。入组标准:①年龄≥60岁;②无认知障碍主诉和症状,由2名神经内科副高或以上职称医师进行评估;③神经系统体查正常;④MMSE评分高于界值,即文盲>17分,小学>20分,初中及以上>24分;⑤CDR为0分;⑥无神经或精神疾病史。排除标准:①患有脑器质性病变;②患有其他重大躯体疾病。共收集5名对照。
本研究经过广州市惠爱医院伦理委员会批准。所有研究对象或其法定监护人均自愿签署知情同意书。
1.2 研究方法
1.2.1血清采集和处理 所有被试者于清晨空腹肘静脉穿刺采血5mL,用EDTA抗凝管收集。样品在4℃下3000rpm离心15min,聚乙烯管分装血清,置-80℃冻存待测,避免反复冻融。
1.2.2总RNA提取及纯度、浓度检测 Trizol法提取单个血清样本的总RNA,采用超微量紫外分光光度计(Nanodrop2000,美国)和芯片生物分析仪(Agilent2100,美国)测定RNA的纯度和浓度。本研究样品RNA溶液的OD260/OD280比值均在1.8~2.0,RNA含量在20ng以上,纯度和浓度均符合测序要求。
1.2.3构建文库、测序和数据质控分析 RNA溶液经聚丙烯酰胺凝胶电泳 (polyacrylamide gel electrophoresis,PAGE), 将分子量在18~30nt的 RNA分子切胶富集,然后连接3’和5’接头,对连接了两侧接头的小RNA样本进行反转录PCR,生成cDNA文库,并用高通量测序仪(Illumina HiSeqTM2500,Illumina,美国)进行测序。测序得到的原始数据经过去污染、去低质量、去接头的过程获得干净tag序列。对tag序列进行长度分布统计,数量及丰度、基因组比对等分析;与miRBase数据库比对鉴定样品中miRNA,得到miRNA表达谱(基迪奥生物,广州)。
1.2.4差异表达miRNA分析 采用edgeR软件对AD和对照组间miRNA的count值进行差异分析,并使用负二项分布检验计算组间比较P值,利用miRNA的表达量值 (transcripts per million,TPM)进行差异倍数计算。差异表达miRNA(differentially expressed miRNA,DEmiRNA)是指在AD和NC两组的表达差异倍数 (fold change,FC)绝对值≥2且P<0.05的 miRNA[6]。
1.2.5靶基因预测、GO及KEGG分析 使用RNAhybrid(v2.1.2)+svm_light (v6.01)、Miranda (v3.3a)及TargetScan(v7.0)3个软件对DEmiRNA的靶基因进行预测,以3个分析结果的交集作为靶基因预测结果。对靶基因进行GO功能和KEGG生物通路注释,统计靶基因映射到的GO功能和KEGG生物通路的基因数目,应用超几何检验计算P值,找出与整个基因组背景相比靶基因显著富集的GO term和 Pathway,以P<0.05为检验水准,满足此条件的GO term或Pathway定义为靶基因显著富集的GO term或Pathway。
1.3 统计学方法数据采用SPSS20.0进行统计分析。重度AD组和对照组的年龄、受教育年限、认知测试分值等正态分布资料比较采用独立样本t检验,性别比较采用Fisher精确检验,miRNA在两组间表达差异采用负二项分布检验。检验水准α=0.05,双侧检验。
2 结果
2.1 人口学与临床资料7例患者中男2例、女5例,年龄55~92岁,平均(72.2±12.3)岁,病程2~10年,平均(5.86±3.02)年,MMSE 评分2~14分,平均为(2.7±5.0)分,MoCA 评分0~5分,平均(0.7±1.9)分。5名对照中男3名、女2名,年龄62~70岁,平均(65.6±3.6)岁,MMSE 评分28~30分,平均(28.8±0.8)分,MoCA 评分26~28分,平均(26.6±1.1)分。两组性别(P=0.558)、年龄(t=1.140,P=0.281)及受教育年限(t=-1.544,P=0.122)差异无统计学意义。重度 AD 组 MMSE (t=-11.303,P<0.001) 和 MoCA(t=-27.091,P<0.001)评分低于对照组。
2.2 miRNA测序结果与对照组相比,重度AD组中共有112个 DEmiRNA(|FC|≥2且P<0.05),其中上调57个,下调55个。上调且测序reads数≥10的主要 DEmiRNA 包括 mir-206-y(FC=5.8,P<0.01)、hsa-miR-199a-3p(FC=4.9,P=0.02)、hsamiR-199b-3p(FC=4.9,P=0.02)、mir-1-y(FC=4.6,P=0.02)、hsa-miR-1307-3p(FC=4.6,P=0.03)、hsa-miR-1-3p(FC=4.4,P=0.03)及 hsa-miR-4446-3p(FC=3.9,P=0.04),下调且测序 reads数≥10的 DEmiRNAs为 hsa-miR-215-5p(FC=-3.4,P<0.01)。 见表1。

表1 主要DEmiRNA的名称、序列及表达差异倍数
2.3 GO功能富集分析和KEGG通路富集分析GO功能富集分析结果表明DEmiRNA的靶基因参与蛋白结合、离子结合、转运金属结合等分子功能的调节(表2),细胞内器官、细胞器官、细胞膜组成器官及细胞膜等调节(表3),以及生物代谢过程和生物调节等生物学过程(表4)。KEGG通路富集分析结果显示有6.42%的靶基因参与PI3KAkt信号通路,MAPK信号通路、Ras信号通路、Rap1信号通路、粘连复合体等也是DEmiRNA靶基因主要参与的通路(表5)。图1是靶基因参与PI3K-Akt信号通路的KEGG通路分析图,其中红色方框为DEmiRNA的靶基因。
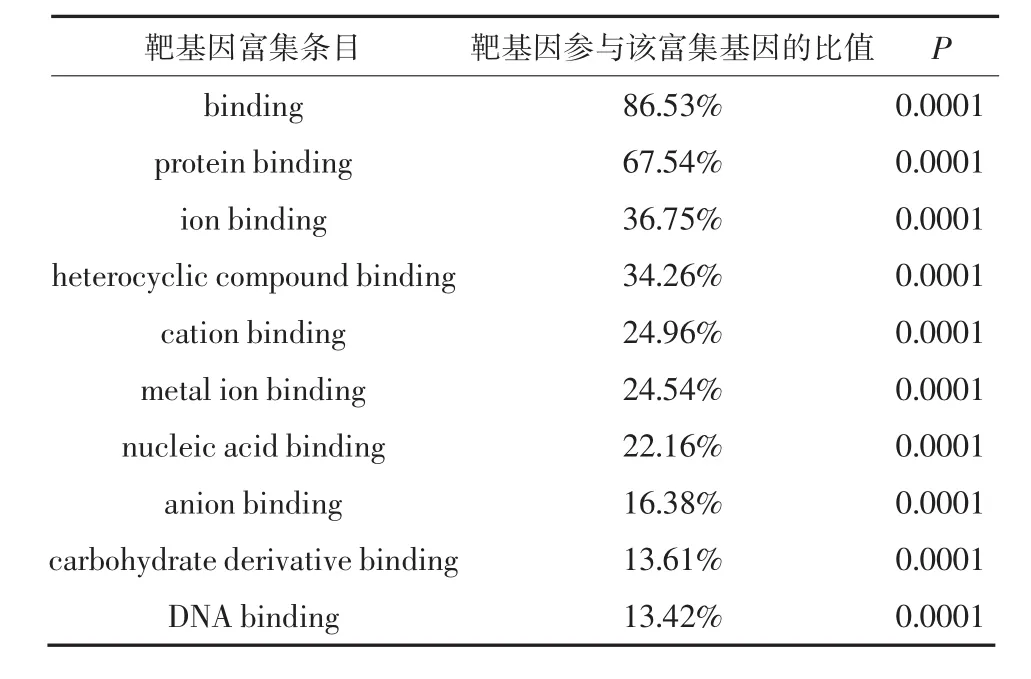
表2 GO富集的分子功能分析
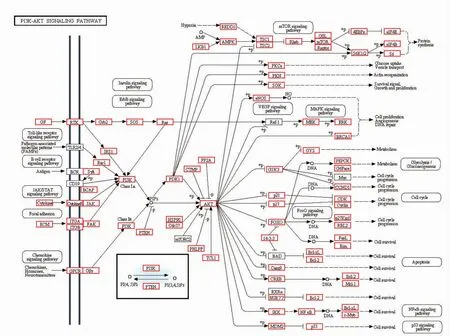
图1 靶基因参与PI3K-Akt信号通路的KEGG通路分析图。原图来自KEGG数据库(www.genone.jp/kegg/),其中红色方框为重度AD患者DEmiRNA的靶基因
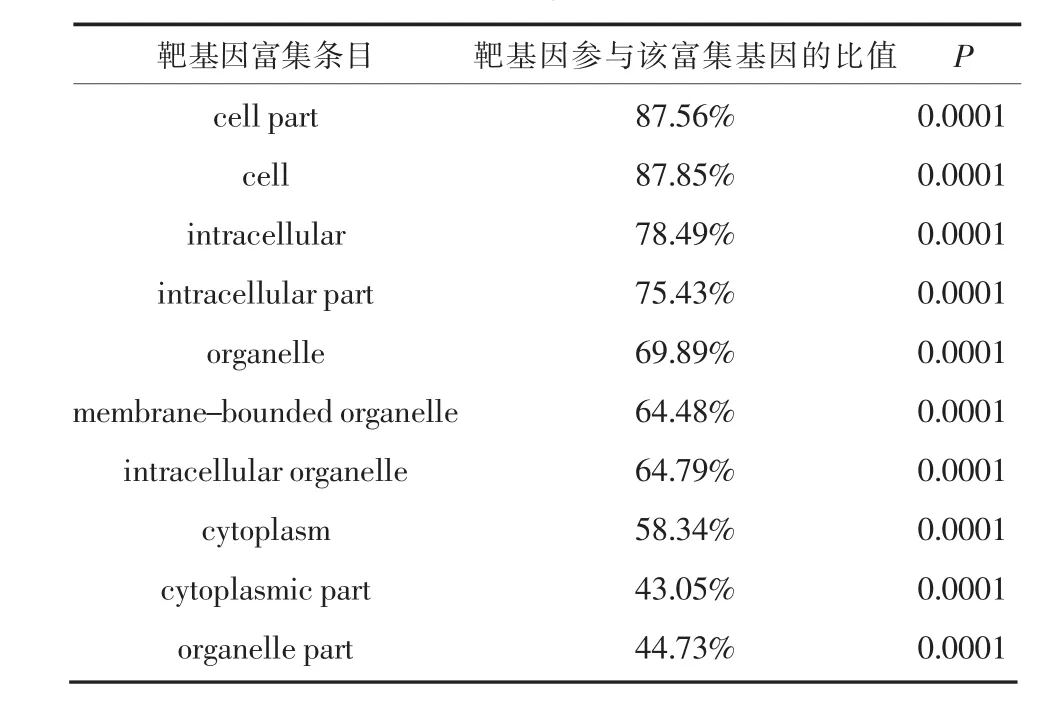
表3 GO富集的细胞组成分析
3 讨论

表4 GO富集的生物学过程分析
本研究使用高通量测序技术对重度AD患者的血清miRNA进行研究,结果提示重度AD组和对照组的血清miRNA表达谱存在部分差异。与AD及轻度认知障碍(mild cognitive impairment,MCI)患者血清miRNA的研究结果一致[3-4,7]。此外,本研究证实mir-206-y及hsa-miR-215-5p是DEmiRNA,在重度AD患者血清中前者表达上调,后者表达下调。miR-206-y和hsa-miR-215-5p与AD的发生发展有密切关系:在AD转基因小鼠模型中,miR-206表达上调导致脑源性神经营养因子的表达减少[8];而miR-215表达下降能够重新激活细胞周期,导致神经元凋亡,从而引起神经退行性改变[9];且遗忘型MCI患者血清miR-206表达水平明显高于正常对照组[7],可作为预测遗忘型MCI患者痴呆转化率的生物标志物[10]。本研究进一步证实mir-206-y和hsa-miR-215-5p是AD疾病潜在的生物标志物。

表5 靶基因主要富集的10个KEGG通路
本研究中GO功能富集分析显示DEmiRNA的靶基因参与蛋白结合、离子结合、转运金属结合、细胞器与细胞膜等生物代谢和调节过程。以上生物代谢和调节过程被证实与AD的发生发展密切相关:研究显示AD患者大脑的老年斑中富含金属离子[11];AD患者脑内葡萄糖代谢降低远早于β淀粉样蛋白沉淀发生,而酮体是脑内替代葡萄糖的主要能量来源,脑中能量代谢底物转换为酮体是AD早期代谢特征[12]。本研究提示血清DEmiRNA与AD的病理变化存在一致性,但其关联性仍需进一步探索。
在KEGG通路分析中,本研究发现DEmiRNA的靶基因主要参与PI3K-Akt信号通路调控。既往研究显示,PI3K-Akt信号通路与AD患者海马神经元的生存、凋亡和细胞代谢密切相关[13-14]。β淀粉样(Aβ)蛋白低聚体阻断PI3K-Akt信号通路时可导致大脑神经元易损伤性增加[15],提示PI3K/Akt信号通路参与AD的病理改变过程。本研究提示重度AD患者血清DEmiRNA或可反映AD患者大脑PI3K-Akt信号通路调控的异常情况。
综上所述,本研究表明重度AD患者血清存在显著的miRNA表达差异,其中mir-206-y和hsa-miR-215-5p是AD疾病潜在的生物标志物。且GO功能和KEGG通路富集分析提示血清DEmiRNA作用的靶基因与AD病理改变密切相关。考虑到重度AD患者的特征性病理变化更明显,血清microRNA谱系的改变可能较轻中度AD更为典型,本研究仅纳入重度AD患者,而未纳入不同病程阶段的认知功能障碍患者,并且本研究样本量较小,仅初步探索miRNA差异表达,靶基因分析亦有待深入,这些不足需在未来研究中加以改进。

