尾菜青贮乳酸菌的分离筛选及其青贮菌剂制备
彭章普, 王 洁, 麻和平, 张文齐, 刘彩云, 邵建宁*
(1.甘肃省科学院,甘肃兰州 730000;2.甘肃省科学院生物研究所,甘肃兰州 730000)
随着我国蔬菜种植面积不断扩大和蔬菜种植布局不断集中,在蔬菜采收、初加工等过程中伴有大量尾菜产生。由于蔬菜产品具有较强的季节性,收获和上市期短而集中,大量尾菜不仅未被合理利用,而且造成了严重的环境污染,对尾菜进行处理利用,将尾菜变废为宝,防止尾菜造成环境污染,对蔬菜产业的健康发展和环境保护具有重要意义(杜鹏祥等,2015;韩雪等,2015)。尾菜具有有机物和水分含量高,易腐烂变质不宜贮存的特点,为解决尾菜污染环境,实现尾菜资源化利用,对经过分捡后无腐烂变质的尾菜进行青贮饲料制备,可以降低尾菜的营养物质损失,较长期保持尾菜的青鲜状态(任海伟等,2015;周苗苗等,2014;杨道兰等,2014;冯炜弘等,2013)。尾菜青贮过程中乳酸菌必须具备较强的产酸能力并且活菌数达到一定数量,才能更好地发挥其生物功效,因此,使用产酸能力强、青贮发酵效果好的乳酸菌,是制备优良青贮尾菜的关键(韩雪等,2013; 杨茁萌等,2012;Avila 等,2010; 潘艳等,2010)。目前专门针对尾菜青贮的青贮菌剂研究不多,自然青贮不能保证尾菜青贮的品质,因此,研发适合尾菜青贮的青贮剂非常必要。泡菜中含有丰富的乳酸菌,从泡菜中分离筛选出适合尾菜青贮用的优良乳酸菌是一条高效、快捷的途径。本研究是从市售泡菜中分离出乳酸菌,进行产酸性能、青贮效果研究,筛选出适合尾菜青贮的乳酸菌菌株,对筛选出的乳酸菌利用5 L立瓶进行青贮菌剂制备工艺研究,确定筛选菌株培养最适收获期和菌株配比,并对制备的尾菜青贮菌剂进行应用试验,为尾菜青贮菌剂的工业化开发提供菌种保证和科学的依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源 试验菌株是从兰州市售泡菜中分离筛选出的乳酸菌。
1.1.2 培养基 MRS培养基按照《中国农业菌种目录》中的配方配制(中国农业微生物菌种保存管理中心,2012);MC培养基按照《乳品微生物学实验技术》中的配方配制(杜鹏,2006)。
1.1.3 青贮原料 挑选无腐烂变质废弃的白菜叶、青笋叶进行清洗,切割成长2~3 cm,宽1~2 cm,通过晾晒将废弃白菜叶、青笋叶水分含量降至70%左右。
1.2 仪器与设备 JA2003N电子天平,上海精密仪器有限公司;DELTA 320 pH计,梅特勒-托利多(METTLER TOLEDO);高压蒸汽消毒器,上海医用核子仪器厂;超净工作台,北京市西城区半导体设备一厂;DG-1多功能培养箱,上海医疗器械修造厂;UV-120-02型分光光度计,日本岛津;BH-2 显微镜,奥林巴斯(OLYMPUS)。
1.3 试验方法
1.3.1 分离筛选
1.3.1.1 乳酸菌分离与纯化 从市售泡菜中取出5mL泡菜汁,和45mL无菌生理盐水混匀,以10倍梯度稀释, 选取 10-3、10-4、10-5三个稀释度,各稀释度取0.2 mL分别均匀涂布于MC培养基平板上,30℃平板倒置培养48 h,选择菌落显红色,周围有明显溶钙圈的单菌落进行培养和保存。对分离的菌株在含有CaCO3的MRS培养基平板上划线培养,划线分离纯化1~3次,挑取溶钙圈明显的单菌落,经镜检确认为纯种。将革兰氏染色呈阳性和过氧化氢酶试验为阴性的分离纯化菌株,使用MRS液体培养基培养,采用《微生物学实验教程》中甘油法进行保藏(周德庆等,2013)。
1.3.1.2 乳酸菌筛选 乳酸菌初筛,将上述分离纯化的菌株活化后,按体积比5%接种量(菌种活菌数约为1.0×108cfu/mL)接入MRS液体培养基中,置于30℃恒温培养箱培养24 h,进行产酸量测定,采用酸碱滴定法中和法,用0.1mol/L NaOH溶液滴定,计算产酸量。产酸量以吉尔涅尔度(°T)表示,每100 mL培养液消耗1 mL 0.1 mol/L NaOH溶液记为1°T。乳酸菌复筛,将初筛选出的菌株培养液按重量比为0.5%的接种量 (菌种活菌数约为1.0×109cfu/mL),接种在预处理后的废弃白菜叶、青笋叶中,分别均匀喷洒到500 g青笋叶,500 g白菜叶中,装袋后压实,袋口密封,在30℃下发酵,在一定时间测定尾菜青贮饲料pH及乳酸菌活菌数,综合尾菜青贮饲料感官指标评价复筛出发酵性能良好的乳酸菌(黄晓晗,2013;刘建新等,1999)。
1.3.2 菌种鉴定
1.3.2.1 形态特征观察 将筛选出的菌株分别涂布到MRS固体培养基,37℃培养48 h,观察菌落特征,取典型菌落涂片,进行革兰氏染色,油镜下观察细胞形态,方法参见 《常见细菌系统鉴定手册》(东秀珠等,2001)。
1.3.2.2 API 50CH试剂条鉴定 采用API 50CH(REF 50300)试剂条,对筛选出的乳酸菌进行鉴定。按照试剂条说明书操作,将接菌后的试剂条放入培养盒后,置于30℃条件下培养,记录每个试剂条在24、48 h的颜色变化,将结果记录于报告单,形成试验菌株生化反应谱,经APIWEB软件分析获得被鉴定菌株的鉴定结果。
1.3.3 乳酸菌培养
1.3.3.1 培养温度对乳酸菌生长的影响 将培养温度分别设定为 30、33、35、37、40、42 ℃, 使用MRS液体培养基,按照体积比5%的接种量接入种子液,静置培养24 h,在600 nm条件下测定菌液的OD值,确定出筛选菌株生长的最适培养温度。
1.3.3.2 培养基初始pH对乳酸菌生长的影响用1 mol/L的盐酸或6 mol/L的氢氧化钠将MRS液体培养基的初始pH分别调至5.0、5.5、6.0、6.5、7.0、7.5,按照体积比5%接种量接入种子液,静置培养24 h,在600 nm条件下测定菌液的OD值,确定出培养基最适初始pH。
1.3.3.3 接种量对乳酸菌生长的影响 将接种量分别设定为体积比 1%、2%、3%、4%、5%、6%、7%、8%、9%、10%,使用MRS液体培养基,37℃静置培养24 h,在600 nm条件下测定菌液的OD值,确定出最适接种量。
1.3.3.4 生长曲线绘制 将菌株进行活化培养,按选出的最适温度、初始pH和接种量,在MRS液体培养基中培养24 h,每隔2 h取发酵液菌液,在600 nm条件下测定菌液的OD值,以培养时间为横坐标,OD值为纵坐标,绘制生长曲线。
1.3.4.1 发酵菌液活菌数测定 取1mL待测定发酵菌液,用稀释液进行10倍梯度稀释,选取10-6、10-7稀释梯度,吸取0.2mL菌悬液置于MRS琼脂平板上,以灭菌的涂布器将菌悬液均匀涂开,然后将平板倒置于培养箱中,37℃培养48 h,进行菌落计数,每个稀释梯度做3个平行,计数方法参见《GB4789.2-2010食品微生物学检验菌落总数测定》(中华人民共和国卫生部,2010)。
1.3.4.2 尾菜青贮饲料中乳酸菌总数测定 取5 g尾菜青贮饲料和45 mL无菌生理盐水混匀,以10倍梯度稀释,选取10-5、10-6稀释梯度,吸取0.2mL菌悬液用涂布器涂布于MC琼脂平板上,培养48 h后,选择菌落显红色、周围有明显溶钙环的菌落进行计数。
1.3.5 尾菜青贮菌剂制备 将试管活化的复筛出的乳酸菌菌种,按照体积比5%接种量接入500mL三角瓶进行种子液培养,37℃培养12 h。将三角瓶种子液按体积比5%的接种量接入5 L立瓶进行发酵培养,当发酵液pH低于5.5时用6 mol/L的氢氧化钠溶液调节发酵培养液pH至6.0~6.5。在调控pH培养液的生长曲线达到最高值时,终止发酵,进行菌落计数确定发酵培养液活菌数大于 1.0×109cfu/mL。
1.3.6 尾菜青贮菌剂菌株配比试验 将复筛出的2 株乳酸菌菌株发酵培养液按活菌数 1∶1、2∶1、1∶2比例进行配比,按照重量比0.5%接种量接种到废弃白菜叶装袋压实封口,每组3个平行,置于恒温培养箱中,30℃青贮发酵,分别于 0 d至10 d每天取样,测定各袋取样样品的pH。
1.3.7 尾菜青贮发酵试验 将制备的尾菜青贮菌剂按重量比0.5%的量,分别均匀喷洒在5000 g青笋叶,5000 g白菜叶中,装入单向排气阀青贮袋中,装袋后压实、袋口密封,在30℃下发酵7 d,测定尾菜青贮饲料pH及乳酸菌活菌数,综合尾菜青贮饲料感官指标评价青贮菌剂的发酵性能(董妙音等,2016;杨艳等,2014;李勇等,2007)。
2 结果与分析
2.1 分离筛选
清代是中国古典园林发展成就最大也是最后一个时期,清代皇家园林则是中国皇家园林的巅峰。清代皇家园林从康熙年间兴起,至乾隆时期达到高潮,主要分布于北京西北郊和承德等地,分为宫城园林和离宫园林两类。⑤宫城园林包括西苑三海、景山以及紫禁城内的御花园、建福宫花园、慈宁宫花园和宁寿宫花园(即乾隆花园)6处;离宫园林包括北京西北郊的三山五园、南郊的南苑、承德的避暑山庄和蓟县的静寄山庄等8处。
2.1.1 分离纯化 本研究从采购的市售泡菜进行乳酸菌分离纯化,从MC培养基选择菌落显红色、周围有明显溶钙圈的单菌落进行保存,对分离的菌株在含有CaCO3的MRS平板培养基上反复划线纯化,挑选出溶钙圈明显的单菌落,经镜检后确认为纯种,最终分离获得20株产酸菌株。
2.1.2 初筛 青贮要求在较短时间内青贮基质pH迅速下降到4.0以下,这样才能有效抑制真菌及其他杂菌的生长,因此,产酸能力和产酸速率是筛选优良乳酸菌的重要指标。对分离纯化获得的20株菌株进行产酸速率试验,将初筛到的菌株在MRS培养液30℃静置培养24 h,进行产酸量测定,由图 1 可以看出,菌株 SD2、SD4、SD14、SD16、SD17酸度均大于或等于70°T,其中SD2、SD4产酸量较高,酸度达到75°T以上,对初筛出的5株产酸性能较好的菌株作进一步研究。
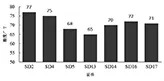
图1 菌株产酸能力测定结果
2.1.3 复筛 将初筛选出菌株接种在预处理后的废弃白菜叶、青笋叶中,测定尾菜青贮饲料pH值及乳酸菌活菌数,综合尾菜青贮饲料感官指标筛选出发酵性能良好菌株,结果见表1,从感官指标、pH、乳酸菌活菌数量比较可见,菌株SD2、SD4发酵废弃白菜叶、青笋叶,发酵7 d后,尾菜青贮饲料pH均低于4.0,乳酸菌活菌数大于1.0×108cfu/g,颜色、气味、质地等感官指标良好,适用于尾菜青贮饲料的发酵。
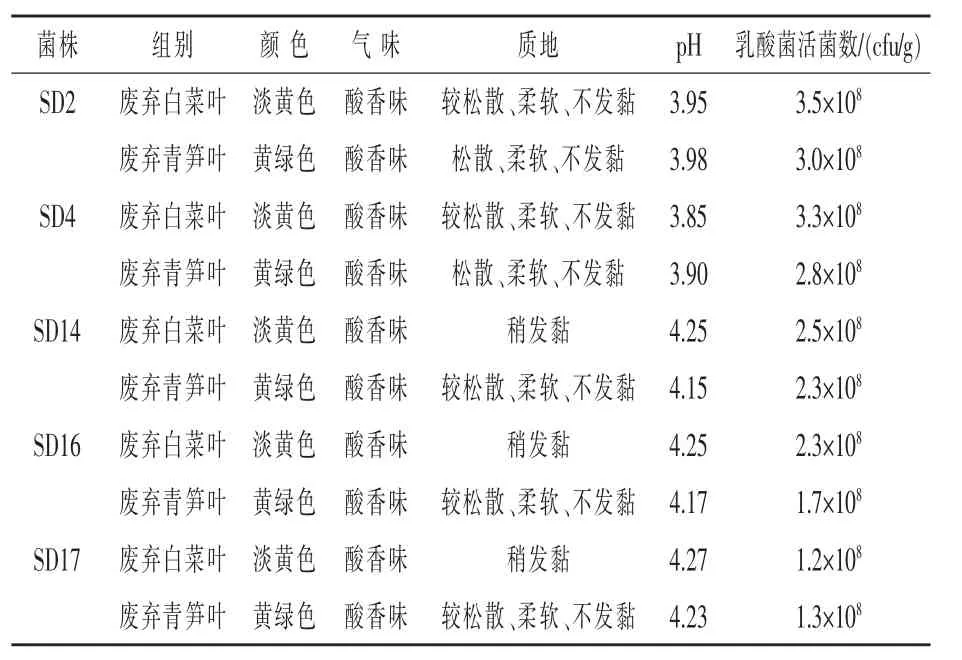
表1 不同菌株青贮尾菜评价
2.2 菌株鉴定
2.2.1 形态观察 对筛选出的菌株SD2、SD4进行菌落形态和细胞形态观察,菌株SD2在MRS琼脂平板上,菌落显灰白色、圆形、凸起、表面平滑、湿润、边缘整齐,直径2~3 mm,显微镜油镜观察,菌体呈长杆状、单个、成对或成短链,革兰氏染色阳性。菌株SD4在MRS琼脂平板上,菌落显微白色、圆形、扁平、湿润、边缘不规则,直径为1~2 mm,显微镜油镜观察,细胞短杆状、单个、成对或链状排列,革兰氏染色阳性。
2.2.2 API试剂条鉴定 API 50CH采用50个生化试验对微生物的碳水化合物的代谢进行研究,API 50CH与API 50CHL培养基配合使用,用以鉴定乳酸杆菌,对筛选出的菌株SD2、SD4经过API 50CH试剂条鉴定,结果见表2。从菌株菌落、菌体形态和革兰氏染色反应结合API 50CH鉴定结果,SD2最终鉴定为植物乳杆菌(Lactobacillus plantarum),SD4最终鉴定为发酵乳杆菌(Lacto-bacillus fermentum)。

表2 API50CH鉴定
2.3 培养条件研究
2.3.1 培养温度对筛选菌株SD2、SD4生长的影响将SD2、SD4分别接种在盛放MRS液体培养基200mL的500mL三角瓶中,置于不同温度下静置培养24 h,测定培养液OD值,结果如图2,菌株SD2在35℃下,培养液OD值较其他温度下高,选择35℃是菌株SD2最适生长温度;菌株SD4在37℃下,培养液OD值较其他温度下高,选择37℃是菌株SD4最适生长温度。

图2 温度对菌株生长影响
2.3.2 初始pH的影响 初始pH对筛选菌株SD2、SD4生长的影响,将菌株SD2、SD4分别接种在不同初始pH的MRS液体培养基中,置于37℃静置培养24 h,测定培养液OD值,结果如图3。由图3可知培养基初始pH过高或过低均不利于菌株的生长。SD2在初始pH 6.5的MRS液体培养基中,培养液OD值较其他初始pH条件下高,选择pH 6.5是SD2最适生长初始pH;SD4在初始pH 6.5的MRS液体培养基中,培养液OD值较其他初始pH条件下高,选择pH 6.5是SD4最适生长初始pH。

图3 初始pH对菌株生长的影响
2.3.3 不同接种量对筛选菌株SD2、SD4生长的影响 将菌株SD2、SD4分别按不同接种量接种在MRS液体培养基中,置于37℃静置培养24 h,测定培养液OD值,结果如图4。由图4可知不同接种量对菌株的生长影响不同,因此选择培养液OD值最高的为最适接种量。菌株SD2在6%接种量下,培养液OD值较其他接种量高,选择6%接种量是菌株SD2最适生长接种量;菌株SD4在6%接种量下,培养液OD值较其他接种量高,选择6%接种量是菌株SD4最适生长接种量。

图4 接种量对菌株生长的影响
2.3.4 最适条件培养 菌株SD2在35℃下按6%接种量接种到初始pH 6.5的MRS液体培养基中,由图5可见菌株SD2培养约10 h进入对数生长期,培养20 h后进入稳定期,培养液的pH变化趋势与菌体生长相符合,在菌体的对数生长期大量产酸,培养液pH迅速下降,培养20 h后培养液的pH稳定在约3.4。菌株SD4在37℃下按6%接种量接种到初始pH 6.5的MRS液体培养基中,由图6可见菌株SD4培养约8 h进入对数生长期,培养16 h后进入稳定期,培养液的pH变化趋势与菌体生长相符合,在菌体的对数生长期大量产酸,培养液pH迅速下降,培养16 h后培养液的pH稳定在约3.6。

图5 菌株SD2生长曲线与pH变化

图6 菌株SD4生长曲线与pH变化
2.4 最适收获期 乳酸杆菌在生长繁殖过程中分解代谢产生酸,随着酸度升高,pH下降,乳酸杆菌的生长受到抑制。为了促进乳酸杆菌的生长和繁殖,菌株SD2、SD4各自在5 L立瓶培养过程中,以培养时间为横坐标,吸光值为纵坐标,绘制出各自调节pH组和对照组的生长曲线。菌株SD2生长曲线见图7,菌株SD4生长曲线见图8。菌株SD2、SD4调节pH组的活菌数明显高于对照组。菌株SD2在24 h左右达到生长高峰期,因此选择发酵培养24 h为菌株SD2的最佳收获期,此时发酵液活菌数可达1.8×109cfu/mL;菌株SD4在20 h左右达到生长高峰期,因此选择发酵培养20 h为菌株SD4的最佳收获期,此时发酵液活菌数可达1.7×109cfu/mL。
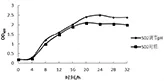
图7 植物乳杆菌SD2的生长曲线
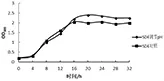
图8 发酵乳杆菌SD4的生长曲线
2.5 菌株配比 菌株SD2、SD4的发酵液按照活菌数 1∶1、2∶1、1∶2 比例进行配比, 按照重量比0.5%接种量接种到废弃白菜叶,由图9可知菌株SD2、SD4间不同的配比,其pH变化趋势不同,产生了不同的发酵结果。在发酵初期,各处理的pH相近,在发酵7 d后到pH变化均趋于稳定。菌株SD2、SD4配比为2∶1的青贮试验pH最低,其pH值下降速率也最快,在4 d时pH下降至4.0以下,7 d后下降缓慢,基本趋于稳定。因此,当菌株SD2、SD4活菌数的配比为2∶1时,充分发挥了协同作用,能快速启动青贮发酵,产生大量的有机酸使pH迅速降低,最后稳定在3.7左右,可实现尾菜青贮饲料的长期保存。
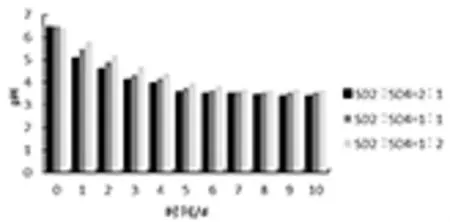
图9 菌株不同配比青贮过程中的pH变化
2.6 青贮效果评价 菌株SD2、SD4活菌数的配比为2∶1,按重量比0.5%接种量分别喷洒到废弃白菜叶和废弃青笋叶中,通过目测、嗅闻、手感感官检验、pH测定和活菌数计数,判断青贮饲料发酵效果。结果见表3,制备的尾菜青贮剂接种废弃白菜叶、废弃青笋叶发酵7 d后发酵效果较好,pH均小于4.0,达到了较长期保存尾菜的要求。其中青贮废弃白菜叶颜色淡黄色,酸香味浓郁,质地较松散、柔软、不发黏,7 d后pH为3.70,乳酸菌总数达到3.6×108cfu/g;青贮废弃青笋叶,颜色黄绿色,酸香味浓郁,质地松散、柔软、不发黏,7 d后pH为3.85,乳酸菌总数达到3.3×108cfu/g。使用试制的尾菜青贮剂对废弃白菜叶、青笋叶进行青贮发酵试验,菌株SD2与菌株SD4共同作用青贮发酵效果良好。
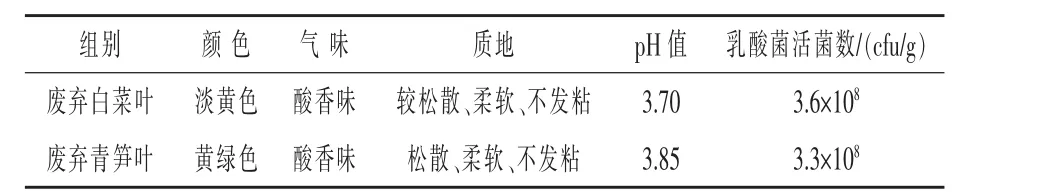
表3 尾菜青贮剂发酵尾菜结果
3 结论
3.1 从泡菜中分离筛选出适合尾菜青贮的乳酸菌,通过产酸性试验与尾菜青贮发酵试验筛选出SD2、SD4两株产酸能力强,青贮废弃白菜叶、青笋叶效果良好的菌株,在30℃进行尾菜青贮发酵7 d后,尾菜青贮饲料pH均低于4.0,尾菜青贮饲料乳酸菌活菌数大于1.0×108cfu/mL。
3.2 菌株SD2在MRS液体培养基中最适培养温度35℃,最适培养基初始pH 6.5,接种量6%。菌株SD4在MRS液体培养基中最适培养温度37℃,最适培养基初始pH 6.5,接种量6%。菌株SD2、SD4在最适条件下培养20 h后发酵液pH均能下降到pH 3.5以下,具有良好的青贮潜能。
3.3 对筛选获得的菌株SD2、SD4经细菌形态学观察,API 50CH试剂条鉴定,菌株SD2鉴定为植物乳杆菌,菌株SD4鉴定为发酵乳杆菌。
3.4 菌株SD2在MRS培养基中35℃培养,通过调控pH,24 h左右活菌数达到最大值,发酵液活菌数可达1.8×109cfu/mL。菌株SD4在MRS培养基中37℃培养,通过调控pH值,20 h左右活菌数达到最大值,发酵液活菌数可达1.7×109cfu/mL。
3.5 菌株SD2与菌株SD4活菌数配比为2∶1,30℃青贮白菜在4 d后pH下降至4.0以下,7 d后基本趋于稳定。

