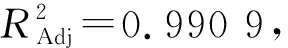超声波辅助壳聚糖固定化复合酶澄清枸杞汁的响应面优化
颉向红,刘 军,徐 昊,张喜康,马浩然,孔维洲,刘敦华
(宁夏大学 农学院,银川 750021)
枸杞(Lyciumbarbarum)又名枸杞子或枸杞的果实,是茄科落叶灌木,广泛分布于中国西北部,欧洲东南部和地中海地区的干旱和半干旱地区[1]。枸杞是世界上著名的中药材和保健食品,具有帮助滋养肝肾,提神明目等功能[1-2]。枸杞中主要的化学成分如枸杞糖类、色素、氨基酸、黄酮及碱类等有大量的药理作用[3-4]。黑枸杞 (LyciumruthenicumMurr)又名黑果枸杞,树属多棘刺灌木,大都分布在高山沙地,含有丰富的紫花色苷素及丰富的游离氨基酸、维生素、少量的微量元素,营养物质非常高,它具有可以延缓人体细胞组织的老化、护肝明目、抗疲劳、改善睡眠等作用[5]。
由于枸杞汁中存在易引起果汁混浊甚至导致沉淀的果胶以及蛋白质等大分子物质,这使得枸杞汁在加工生产、储存过程中出现混浊的主要原因之一[6]。为了克服以上难题,普遍应用以可溶形式存在果汁工业领域中的果胶酶,纤维素酶的商品酶制剂,因为它们促进这些化合物的水解,改善过滤,澄清,最终使产品稳定化[7-10]。但使用游离酶制剂存在较难回收和资源较高等问题,随着酶工程的逐步成长,固定化酶在一定水平上填补了这一缺陷[11]。以壳聚糖为载体制得的固定化酶,稳定性较高,机械机能较好且容易回收[12],而壳聚糖作为自然阳离子澄清剂,含有较好的絮凝作用,使其絮凝是由于它可以和果浆中带负电荷物质如蛋白质、果胶、纤维素互相作用[13-14],因此采取超声波辅助壳聚糖固定化酶法来澄清枸杞汁。超声波有助于澄清是因为超声波的强烈振动和空化效应能使有用因素急速溶入溶剂[15-16],并且超声波具有促进酶解和用时短等优点[17]。本试验以枸杞汁的透光率为指标,采取超声波辅助壳聚糖固定化复合酶澄清枸杞汁,通过响应面优化澄清酶解工艺,为果汁澄清的综合开拓利用提供参考依据。
1 材料与方法
1.1 材料与仪器
枸杞、黑枸杞,购自银川新百超市;壳聚糖(脱乙酰度≥90%),购自青岛云宙食品添加有限公司;果胶,购自广州万邦有限公司;羧甲基纤维素钠盐,购自常熟威怡科技有限公司;果胶酶、纤维素酶(酶活力10 U/g),购自河南万邦实业有限公司;冰乙酸,购自郑州市高研生物科技有限公司;没食子酸,购自天津市大茂化学试剂厂;蒽酮,购自上海光诺化学科技;乙醇、苯酚、亚硫酸钠、无水碳酸钠、乙酸、乙酸钠、考马斯亮蓝G-250 均为分析纯,购自国药集团化学试剂有限公司。
数控超声波洗濯器(昆山市超声仪器有限公司);6新世纪紫外分光光度计(北京普析通用仪器有限责任公司);TDL-5-A型低速台式大容量离心机(上海安亭科学仪器厂);SHZ-D循环水真空泵(郑州长城科贸);SRT-AI80多功能食品加工器 (青岛贸润电器制造有限公司);数显恒温水浴器(上海博迅实业有限公司)。
1.2 试验方法
1.2.1 工艺流程 工艺流程:原料选择(黑红枸杞)→预处理(清洗干枸杞并用温水浸泡0.5 h)→打浆(料水质量比1∶6)→粗滤(两层纱布过滤)→超声波澄清→枸杞汁
1.2.2 壳聚糖固定化复合酶的制备 参考文献[18-19]的方法,依据本试验要求进行微调整:1 g壳聚糖溶解于φ=1%冰醋酸并定容至100 mL,震荡搅拌均匀,使完全溶解,将上述溶液用5 mL 的注射器逐滴加入到 100 mL 混合液(φ=10% NaOH与φ=95%乙醇,体积比为 4∶1)中,在 4 ℃ 冰箱中过夜,滴入少许φ=5%戊二醛,搅拌后再静置几个小时,抽滤并用水冲至偏中性,在抽干后交联的壳聚糖-戊二醛载体上加入纤维素酶和果胶酶的酶液,振荡均匀后,4 ℃固定几个小时,用蒸馏水洗去未固定的酶,再抽干即得固定化复合酶。游离酶经壳聚糖固定化后,固定化果胶酶活性为62 356 U/g[20],固定化纤维素酶活性为99 450 U/g[21]。
1.2.3 枸杞汁透光率最佳波长的确定 量取少量已加入固定化复合酶20 g/L[m(纤维素酶)∶m(果胶酶)=1∶2]于50 ℃下超声反应60 min后的复合枸杞汁中,在不同波长下采取分光光度法测定枸杞汁的吸光度,用最佳波长处的透光率(T,%)来表现枸杞汁的澄清度。
1.3 单因素试验
1.3.1 复合酶比例筛选 量取10 mL复合枸杞汁,加入不同质量比的壳聚糖固定化果胶酶和壳聚糖固定化纤维素酶(1∶1、1∶2、1∶3、2∶1、3∶1)复合酶液20 g/L,在50 ℃下超声反应60 min,在最佳波长处测其透光率。
1.3.2 壳聚糖固定化复合酶的添加量 量取10 mL复合枸杞汁,加入m(纤维素酶)∶m(果胶酶)=1∶2的复合酶,用量分别为10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,在50 ℃下超声反应60 min,确定酶不同添加量对枸杞汁透光率的影响。
1.3.3 超声时间 量取10 mL复合枸杞汁,酶添加量为20 g/L[m(纤维素酶)∶m(果胶酶)=1∶2] 时,在50 ℃下分别超声反应30 min、60 min、90 min、120 min和150 min,确定超声时间的差异对枸杞汁透光率的影响。
1.3.4 超声温度 量取10 mL复合枸杞汁,酶添加量为20 g/L[m(纤维素酶)∶m(果胶酶)=1∶2]时,分别在45 ℃、50 ℃、55 ℃、60 ℃和65 ℃下超声反应60 min,确定超声温度的差异对枸杞汁透光率的影响。
1.4 澄清工艺的响应面试验优化
以单因素试验结果为依据,酶添加量(g/L)、超声时间(min)、超声温度(℃)为自变量,枸杞汁透光率为响应值,采取Box-Behnken来设计试验,通过三因素三水平的响应面分析法对枸杞汁澄清工艺进行优化,试验设计见表1。
1.5 澄清前后营养成分的对比
采用考马斯亮蓝法[22]测定水溶性蛋白质;采用手持糖度计法糖度;采用DNS法[23]测定还原糖;采用蒽酮-硫酸法[24]测定多糖;采用福林酚比色法[25]测定总酚;采用分光光度计法[26]测定类胡萝卜素。
2 结果与分析
2.1 枸杞汁透光率最佳波长的确定
由图1可以看出,当所测定的波长到达700 nm 时,枸杞汁透光率可以到达78.79%,700 nm 以后透光率基本稳定不变,所以确定枸杞汁透光率最佳波长为700 nm。
2.2 壳聚糖固定化果胶酶和纤维素酶比例的确定
从图2可以看出,当m(纤维素酶):m(果胶酶)是1∶2时,透光率最佳。当其质量比为3∶1和2∶1时,透光率减小。这可能由于纤维素酶活即酶解能力会因纤维素酶质量浓度的增长而削弱,导致透光率降低[17]。所以选择m(纤维素酶)∶m(果胶酶)的比例为1∶2。

表1 Box-Benhnken试验因素水平表Table 1 Factors and levels of Box-Behnken design

图1 果汁透光率与所测定波长的关系曲线Fig.1 Relationship between wolfberry juice transmittance and wavelength

图2 固定化复合酶比例酶解效果的比较Fig.2 Comparison of enzymatic hydrolysis effects of immobilized complex enzymes
2.3 单因素试验
2.3.1 酶添加量的差异对枸杞汁透光率的影响 由图3可以看出,透光率会因酶添加量的增多而呈现出先增加后减小的趋势(P<0.05)。当酶添加量为20 g/L时,透光率最大为79.93%,故综合考虑选用10~30 g/L为响应面的优化条件。
2.3.2 超声时间的差异对枸杞汁透光率的影响 由图4可以看出,在30~150 min的5个超声时间阶段内,随着超声时间的延伸,枸杞汁的透光率逐渐上升。60 min和120 min时两者的透光率之间相差不大并且差异性不显著(P>0.05),当超声时间超过120 min时,枸杞汁透光率下降,可能是随着超声时间的延长,大量的多糖分化成单糖[17]。考虑时间效率的问题,选用30~90 min为响应面的优化条件。
2.3.3 超声温度的差异对枸杞汁透光率的影响 由图 5 可以看出,枸杞汁的透光率会随超声温度的增加而呈现先增加后减小的趋势,并且55 ℃和60 ℃时两者之间的透光率差异不显著(P>0.05)。透光率减少可能是由于复合酶活性会随着超声温度的增加而减弱或者失活[17],所以选用45 ℃~55 ℃为响应面的优化条件。

不同字母表示差异显著(P<0.05) Different letters indicate significat difference (P<0.05);相同字母表示差异不显著(P>0.05) The same letter indicates no significant difference(P>0.05);下同 The same below
图3不同酶添加量下枸杞汁的透光率
Fig.3LighttransmittanceofLyciumbabarumjuiceunderdifferentenzymedosage
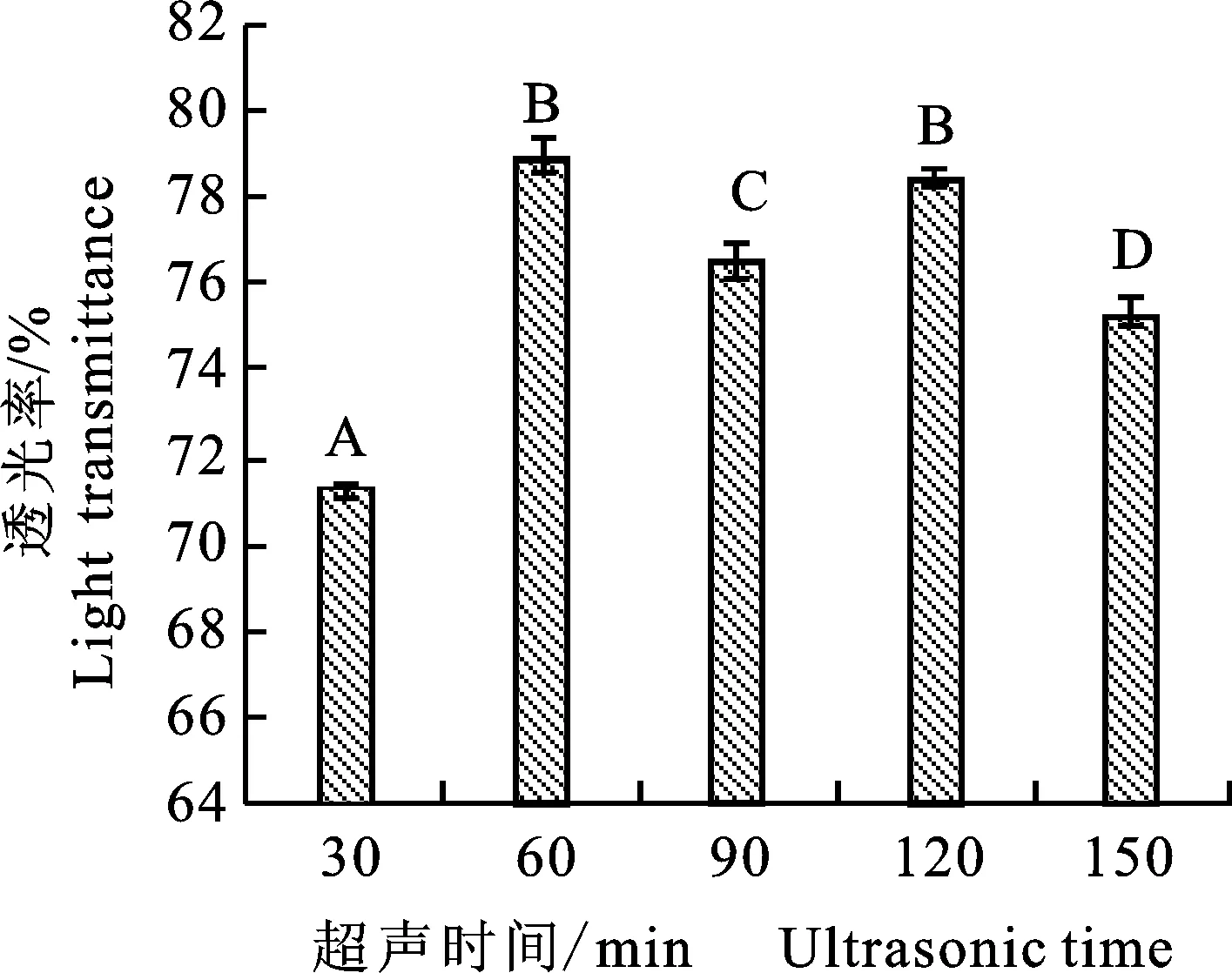
图4 不同超声时间下枸杞汁的透光率Fig.4 Light transmittance of Lycium barbarum juice under different ultrasonic time
图5 不同超声温度下枸杞汁的透光率Fig.5 Light transmittance of Lycium barbarum juice under different ultrasonic temperature
2.4 响应面试验优化
Box-Behnken试验设计及结果见表2。
2.5 回归分析
对表2中数据进行方差分析和多元回归分析,获得透光率对A(酶添加量 g/L)、B(超声温度 ℃)、C(超声时间min)的二次多项回归模型:Y=82.20+1.67A+0.26B+0.58C+0.26AB-0.12AC+0.29BC-2.09A2-2.00B2-1.83C2

2.6 交互作用分析
由图6中的响应曲图可以看出,超声温度一定时,响应值透光率随着酶添加量的增多而不断增大,这可能是因为能够引起枸杞汁混浊的果胶物质和多糖组织分解能力会随着酶添加量的增多而增强,使得枸杞汁变成澄清透亮,透光率不断提高;酶添加量一定时,透光率随着超声温度的增加先增加后减少,变化程度较少,超声温度与酶的活性代谢息息相关,只有在最适的温度范围内,酶的活性才能发挥到最佳,超声温度超过最适温度范围都会影响酶的活性,即枸杞汁透光率随酶的活性能力发生改变,呈先增大后减少的变化趋势。由图7中响应曲图可以看出,超声时间一定时,透光率随酶添加量的增加呈上升趋势,但上升幅度较小;酶添加量一定时,透光率随超声时间的增加呈上升的变化趋势,变化幅度也较小。由图8可以看出,超声时间一定时,透光率随超声温度的增加先增加后减少,透光率减少可能是由于酶活性会因超声温度的升高而降低,枸杞汁的透光率也随着降低,变化较大;超声温度一定时,透光率会因超声时间的增加先增加后减少,变化幅度也较大。
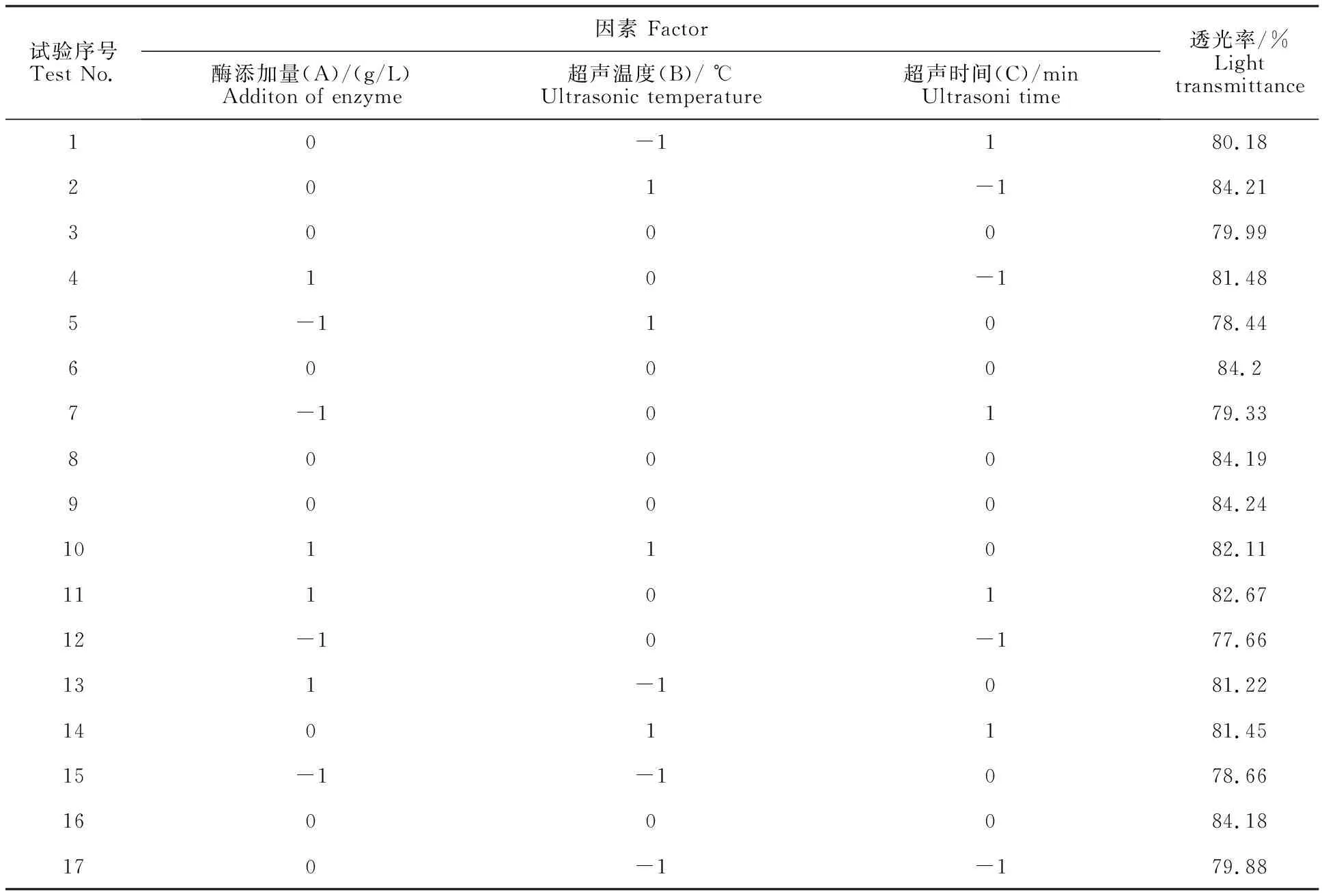
表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and results
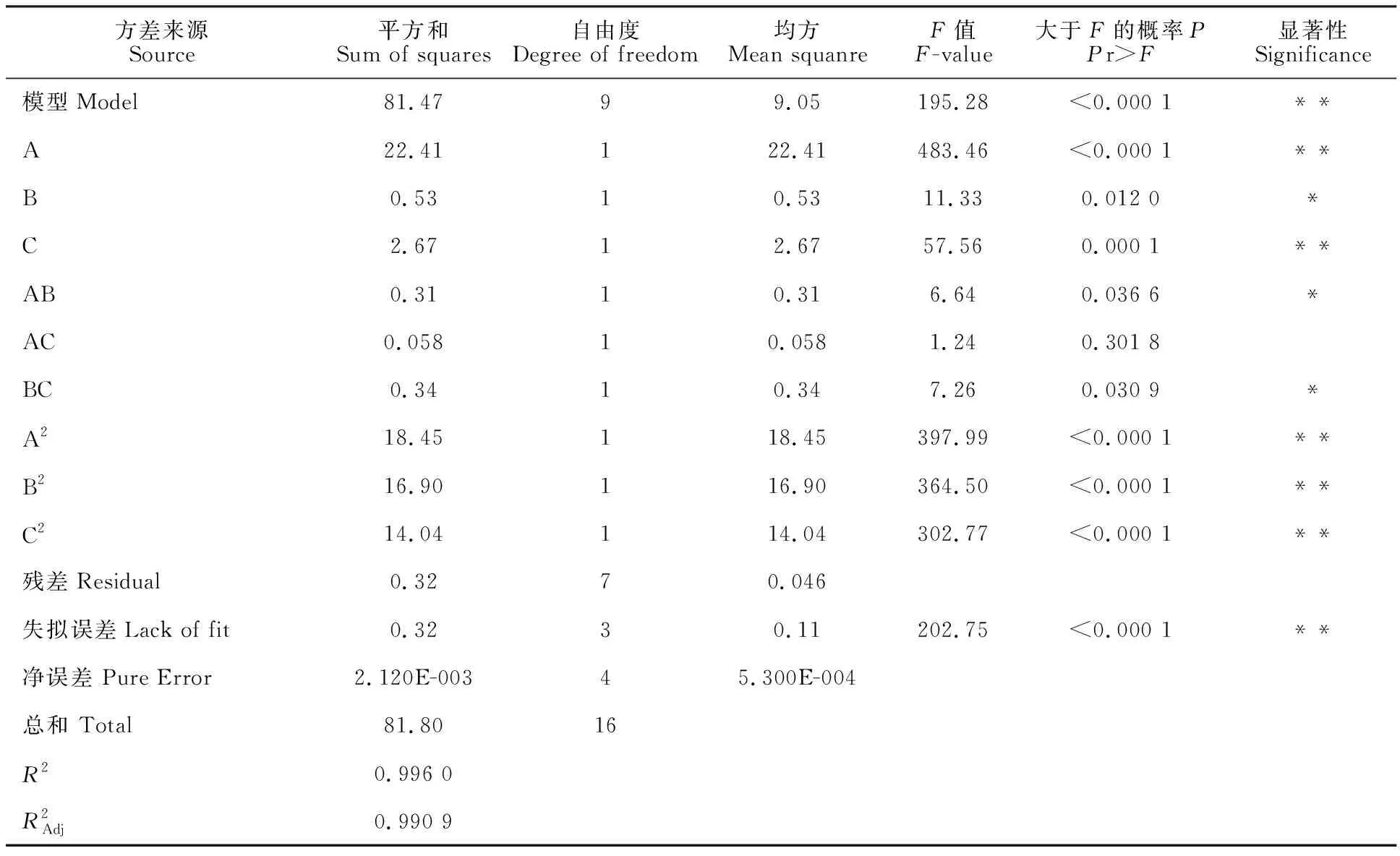
表3 回归模型方差分析Table 3 Analysis of variance of regression model
注:“*”代表差异显著(P<0.05);“**”代表差异极显著(P<0.01)。
Note:“*” indicates significant(P<0.05);“**” indicates extremely significant(P<0.01).
试验中每两个因素之间的交互程度对响应值的影响大小,可以通过等高线图直观看出,图6和图8中的等高线图都呈现卵形,卵形表示两者之间交互显著[27]。故A、B项和B、C项交互作用显著(P<0.05);图7的等高线图趋于圆形,圆形表示交互作用不显著[27],故A、C项之间的交互作用不显著(P>0.05),该结论与方差分析结论相同,均表明交互项中仅有A、C项交互作用不显著。
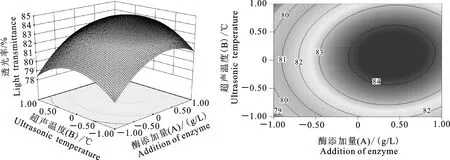
图6 透光率与酶添加量和超声温度的响应面和等高线Fig.6 Response surface and contour of light transmittance and enzyme addition amont and ultrasonic temperature
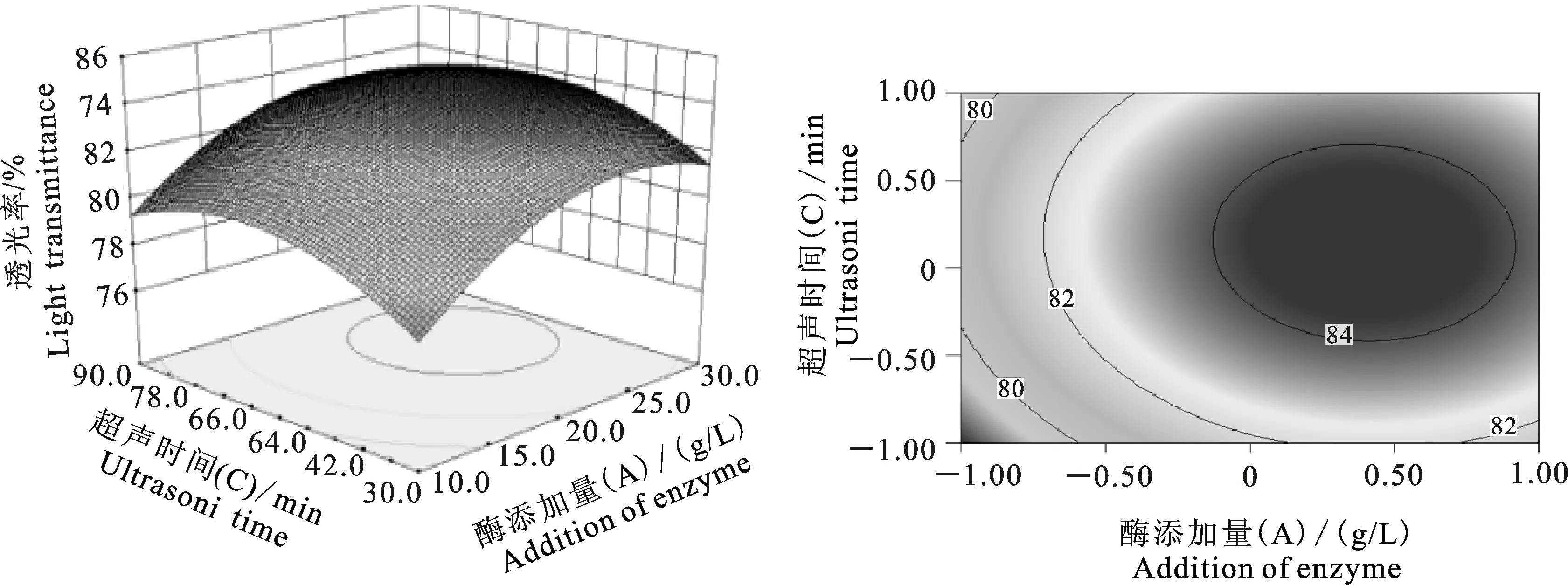
图7 透光率与酶添加量和超声时间的响应面和等高线Fig.7 Response surface and contour of light transmittance and enzyme addition amont and ultrasonic time
2.7 最优澄清工艺优化及验证
经Design Expert 8.0.6软件分析优化出的最优澄清工艺参数为:超声温度50.51 ℃,超声时间64.61 min,壳聚糖固定化复合酶用量24.03 g/L,在此优化条件下透光率为84.60%,为了适合生产实际,便利操作,将各工艺参数调整为:超声温度50 ℃,超声时间65 min,壳聚糖固定化复合酶用量24 g/L,3次重复验证试验,测得枸杞汁平均的透光率值为84.51%,与预测值的误差仅为0.107,说明该模型与实际情况拟合度较高,因此在实际操作中可用此模型优化出的工艺参数进行生产。
2.8 营养成分分析
理化指标标准曲线的回归方程和相关系数见表4。

表4 理化指标标准曲线的回归方程和相关系数Table 4 The regression equation and correlation coefficient of the standard curve of physical and chemical indicators
注:y代表吸光度值,x代表各理化指标的值。
Note:yrepresents the absorbance value, andxrepresents each physical and chemical index.
由表5可以看出,枸杞汁澄清前后,壳聚糖固定化复合酶澄清枸杞汁对其主要营养物质的影响各有差异,导致果汁混浊的总酚、水溶性蛋白质的下降率分别为11.92%和13.86%,可能是因为多数水溶性蛋白质和少数酚类物质会随着壳聚糖的絮凝性能[11]和果胶酶以及纤维素酶的分化功能而沉降[4],使其含量下降;枸杞汁中主要的营养活性物质多糖、还原糖、类胡萝卜素的损失率为10.77%、4.10%、10.53%,说明在响应面法优化前提下,壳聚糖固定化复合酶澄清能良好地保存枸杞汁中的主要营养物质。

表5 酶解前后枸杞汁营养成分的对比Table 5 Comparison of nutritional composition of Lycium barbarum juice before and after enzymatic
3 结 论