浅谈“物理化学”解题方法研究
周 海,康 敏
(遵义师范学院化学化工学院,贵州遵义563006)
“物理化学”是化学相关专业的一门十分重要的基础课,该课程内容繁多、基础理论性强、概念抽象难以理解,而且公式多、推导过程复杂、公式使用条件严格、逻辑性和关联性强。再加上“物理化学”还涉及到较多的高等数学和物理知识,这使得不少学生都感到“物理化学”难学,甚至怕学;有部分学生上课听懂了,教材也看懂了,但是习题不会做;也有部分学生在学习时尚能理解相关内容,但在准备硕士研究生入学考试时却不知从何复习,复习也效率很低。因此我校开设了“物理化学解题方法研究”作为专业选修课,主要是为了帮助学生有效复习并掌握“物理化学”课程的有关理论、定律,增强学生分析问题与解决问题的能力,以提高学生的考研成绩。
笔者近年来一直从事“物理化学”和“物理化学解题方法研究”课程的教学工作,在如何复习“物理化学”,准备硕士研究生入学考试方面积累了一定的经验。笔者认为对于“物理化学”课程,教师教学、学生复习都必须采取有效的方法才能取得良好的效果,主要包括理清各章主要内容、各章内容之间的关系并搭建知识框架,总结各章之间相似的内容,此外还应注意提高复习效率并掌握各种典型题型的解题思路。
1 《物理化学》基础知识的高效复习方法
1.1 理清各章的主要内容并搭建知识框架
《物理化学》教材每一章都包含较多的内容,不少章节之间的内容环环相扣、逻辑性较强,因此学生在复习“物理化学”时的首要任务是正确理解各章所包含的主要概念、定律(理)、公式等。同时还应着重理解相关概念的来源与特点,概念之间的相互关系,定律(理)的适用对象,公式推导的过程与适用条件,公式可以用于解决的题型等。只有在充分理解上述内容的基础上,考生才较好地掌握了这一部分内容,也才能在考研过程中做到得心应手,从容不迫。例如,对于热力学第一定律,需要弄清楚系统与环境、封闭系统、敞开系统、孤立系统(还应理解绝对的孤立系统和人为划分的孤立系统及其区别),广度性质与强度性质,状态与状态函数[1],U、H、Q、C和W等物理量,真空膨胀、等外压过程、等温可逆过程、绝热过程等常见过程,以及标准摩尔反应焓、标准摩尔生成焓、标准摩尔燃烧焓等标准量。同时学生还需要进一步地理解热力学第一定律适用于研究何种体系,它涉及哪些物理量,它的文字表述方式,其主要表达式的区别,这些公式可以解决哪些问题并由此掌握不同过程之间的区别以及主要热力学量的计算方法[2]。
在比较透彻地复习各章节知识的基础上,学生可进一步尝试画出各章节的框架图以加强记忆,并彻底弄清各章的知识脉络与主要内容,尽可能地做到看着教材目录就知道各部分的主要内容与主要公式及其应用。例如,热力学第一定律我们可以画出如图1所示的框架图。
1.2 理清各章内容之间的关系
在复习“物理化学”时还可以将教材中的章节按内容进行分类,笔者在讲授“物理化学解题方法研究”时根据各章内容关联性的强弱将“物理化学”所有内容分成六大部分。第一部分为化学热力学,主要包含热力学第一定律和热力学第二定律;第二部分为多组分系统热力学,主要包含多组分系统热力学及其在溶液中的应用、相平衡和化学平衡;第三部分为电化学,主要包含电解质溶液、可逆电池的电动势及其应用、电解与极化作用;第四部分为化学动力学,主要包含化学动力学基础(一)和化学动力学基础(二);第五部分为表面与胶体化学,主要包含表面物理化学、胶体分散系统和大分子溶液;第六部分为气体和统计热力学基础。
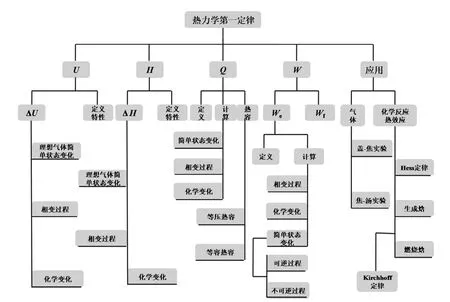
图1 热力学第一定律框架图
将相关章节分类后就可以对内容进行整体复习了,这样的复习系统而全面,能够带领考生站在较高的位置上纵观全局,进而更好地把握各章的知识点及其脉络结构。例如在复习电化学时,笔者就带领学生通过了解这部分内容为何按照电解质溶液、可逆电池、电解池的顺序安排。这是因为电解质溶液是电池以及电化学体系的重要组成,只有在充分了解电解质溶液的性质、特点、表达方式和计算方法的基础上,我们才能进一步学习可逆电池,了解电池系统的基本构造以及它所涉及的基本原理、结论。最后就是用所学的基本知识、理论解决实际生活、生产中的问题,这就是电解与极化。这样可以帮助学生理解“物理化学”课程中关联较大章节的主要内容及其联系。
1.3 总结归纳,提高复习效率
“物理化学”内容繁杂,但前后知识并非全无关联。为了提高复习的效率,我们可以将教材中相似的内容进行归纳总结。
例如,理想状态与非理想状态多组分系统中各组分的化学势表达式有所不同,而且对于多组分液相体系,溶质、溶剂在一定范围内分别适用于不同的经验定律,而且溶质还有多种形式。这使得多组分系统的化学势具有多种表达形式,初学者对化学势基准态的选取以及不同化学式表达式之间的联系、区别都不甚了解,学习、复习效果当然也不理想。其实多组分系统中各组分化学势的表示形式很相似,不论气体还是液体都可用公式来表示,只是不同体系的基准态不一样,由此导致的形式各有不同。具体来讲,理想气体、非理想气体分别用压力或逸度的适当形式替换公式中的,而理想液体、非理想液体则分别用浓度或活度适当形式替换公式中的。于是只要掌握公式中基准态的选取,所有多组分系统中各组分化学势的表示形式就很容易理解并熟记了。
再比如在相平衡中讨论了多种类型的相图,这些内容看似分散,其实这些相图都具有某些共性。在复习过程中若能找出不同相图之间的内在联系,则可起到事半功倍的效果。笔者以形成稳定化合物体系的相图[3-4]为例说明二组分系统相图的通性。
不论是具有一个低共熔点的体系、形成稳定(或不稳定)化合物的体系、部分互溶的体系,或是其他更复杂体系的相图,都具有以下一些特点:①高温部分(即相图的最上部分)一般都是溶液(熔液)单相区;而相图中的单相区是A和B两组分能形成溶液或固溶体的部分,相区内的一点既代表系统的组成和温度(物系点),又代表了该相的组成和温度(相点);②两相区必处于两个单相区或者单相线之间,相区内的一点只能代表系统的组成和温度(物系点),而水平连结线两端点才代表各个相的组成和温度(相点),两相区内都可以利用杠杆规则计算不同相态的量;③相图中凡是曲线都是两相平衡线,线上的一点为相点,表示一个平衡相的状态;④相图中凡是垂线都可以看作是单组分纯物质(如图2中xA=1、xB=1和代表化合物C的垂线),此时该处的相律为此时只有在E、F和H点处的条件自由度为0,而垂线上其它地方的条件自由度均为1,而二组分相图中其它地方的相律为 f*=C–+1=3-,此时只有三相线(除端点外)上的条件自由度才为0。

图2 形成稳定化合物的相图
此外,除了某些知识相似外,“物理化学”中还有很多相似的公式[5-11],学生在记忆时可进行适当的联想,这有助于进行更深入的复习、理解,并适当减轻记忆压力。例如:

其中公式(1)为稀溶液凝固点降低的计算公式;公式(2)为稀溶液沸点升高的计算公式;公式(3)和(4)都为克劳修斯——克拉贝龙方程,可分别用于计算单组分系统气——液两相平衡和气——固两相平衡时的平衡压力、平衡温度或者相应过程的摩尔焓变等;公式(5)为化学反应平衡常数与温度间的关系公式,可用于计算不同温度下反应的标准平衡常数或者标准摩尔反应焓变;公式(6)为阿伦尼乌斯公式,主要用于计算不同温度下反应的速率系数或者活化能。除了形式相似外,上述几个公式都是通过对具有类似形式的偏微分式子进行定积分得到的,公式中各种形式的焓变(H)或活化能(Ea)在计算范围内都可看作与温度无关的常数,而且考察这些公式所涉及的题型也很相似。考生若能准确把握上述内容,不仅可以减轻记忆压力,还能较容易地做到举一反三。
2 典型题型的准备方法与解题思路
2.1 选择与判断题
选择和判断题是硕士研究生入学考试中“物理化学”课程的两类常见题型,为了提高这两类题型的正确率,学生需要全面、准确地把握“物理化学”课程涉及的基本概念、理论、原理及其应用,同时还需注意区分一些易混淆的概念、公式及其适用范围。
例如,有考题将溶液化学势与溶剂化学势和溶质化学势等相似词语放在一起,让考生很容易混淆。对于这一组概念,首先需明确的是多组分溶液体系中化学势就是偏摩尔吉布斯自由能,它是针对某一组分的偏摩尔量,不是针对整个溶液的,所以溶液没有化学势。搞清楚这一点后,考生很容易对“溶液的化学势等于溶液中各组分化学势之和”(西南大学2012年硕士研究生入学考试物理化学试题)做出正确判断。
除了相关概念外,学生还应注意“物理化学”中的很多公式都是在特定条件下推导而来的,因而这些公式都有其特定的适用条件。例如陕西师范大学2013年硕士研究生入学考试物理化学试题选择题第6题:

很多学生会选择B选项,因为化学热力学中学习过等温等压下的化学反应有H=Qp。这就忽略了该公式成立的条件是等温等压且不做非膨胀功。对于上题,原电池中进行可逆放电的过程必然会涉及非膨胀功(电功),所以该题就不能用H=Qp进行判断,而应该用公式rGm=rHm-TrSm来判断。原电池的可逆过程TrSm=Qp,所以公式rGm=rHm-Qp成立。因此,等温等压下原电池中可逆地进行某反应式时有rHm=rGm+Qp,由于rGm<0,所以r Hm<Qp,即上题应选择C选项。
2.2 相图题
相图解析无非是考察相图中点、线、面的含义及其适用的相律。因此,总结简单相图的特点,了解各简单体系相图的绘制方法,知道两相平衡区中如何应用杠杆规则进行相关计算,是考研学生的需达到的基本要求。各体系相图相似性的总结详见第一部分中的相关内容。
2.3 简答题
近年来,在研究生考试中让考生利用某一原理解释某个现象的题目越来越多。应对这种考题,考生除了要熟练地掌握课本上的公式、原理外,还应多注意生活中的一些现象,了解其成因。这需要考生充分熟悉教材内容,能够快速地从教材中筛选出与对应的理论、公式。
例如华中师范大学2014年考研真题第22小题就是让考生从相平衡的角度解释:为什么高原上煮饭用高压锅才能煮熟?很多人都清楚在高原上用普通锅烧水时,水的沸点明显低于100°C,而这与高原上的大气压低有关系。因此该题考察的知识点即为体系平衡温度与平衡压力的关系,应该用克劳修斯-克拉贝龙方程来解释。
2.4 证明题
“物理化学”中化学热力学的相关证明通常都较难,而且很多同学感觉无从下手。笔者发现热力学的证明基本上都可从状态函数的定义、全微分以及Maxwell关系式等三个方面入手。这里以两个例子说明此类题的解题思路。
例1:证明对于理想气体有Cp-Cv=nR关系式成立。
《物理化学》教材[3,12]在证明上式时用到了复合函数的偏微商公式,但很多学生并不能完全理解的证明过程,这使得该式证明难度较大。在已知状态函数具有全微分特性的情况下,该式也可以通过如下方式得以证明。
证明:

再代入理想气体状态方程pV=nRT即可证明C p-Cv=nR成立。
不难看出,上述证明过程就是从Cp的Cv的定义入手,再利用U=U(T,p)、U=U(T,V)构建全微分即可证明。
这类题的基本做法是用相应的热力学基本方程写出需要证明的结果,然后用Maxwell关系式进行代换,例2的证明过程如下。
证明:根据热力学基本方程dU=TdS-pdV,对该式两边同时除以dp(等温)有:

上式与所要证明的表达式之间只有等式右边第一项不一样,据Maxwell关系式因此.
2.5 计算题
计算题在“物理化学”考研中占有很大的比例,这也是很多同学感觉最难、得分最低的部分。这主要是由于“物理化学”的公式繁多,而且同一个量在不同条件下要使用不同公式进行计算,而学生难于把握这些公式及其适用条件。为此,我们建议同学们在复习充分的基础上对公式进行系统梳理,将公式与适用条件统一。这里以热力学部分为例进行说明,热力学部分主要是计算系统经过某些过程后其热力学量(U、W、Q、H、S、G和A等)的变化,同学们可将涉及到的公式进行如下总结、梳理。
例如,(1)功(W)的计算:

真空膨胀、等容过程:W=0
可逆电池
3 结论
总之,针对“物理化学”这样的难度大、内容多的课程,同学们在准备硕士研究生入学考试过程中需要找到合适的复习方法。例如,同学们需要加强对基本概念、公式的理解、记忆,也需要对相关知识进行归纳总结,并通过习题提炼解题技巧,还需要全面把握“物理化学”的所有内容,并进一步构建整个课程的知识框架。这样的复习才是事半功倍的,也才有可能在硕士研究生入学考试中取得好成绩。

