低氧调控EIMD后calpain活性与肌细胞膜损伤机制的探索研究
徐 飞,覃丽凤,黄巧婷,曹建民,王 平,徐玉明*
前言
高原低氧会降低肌肉工作能力、改变肌纤维(肌细胞)的形态和代谢功能,最终导致骨骼肌萎缩(Martin et al.,2017)。而大强度离心运动造成肌纤维微损伤和延迟性肌肉酸痛是运动性肌损伤(exercise-induced muscle damage,EIMD)的主要症状。但因低氧影响肌肉代谢和肌纤维损伤(Luo et al.,2016;Rovida et al.,2015)的机制不明确,所以低氧下提高肌肉工作能力的营养补剂和训练方法的应用受限。有研究发现,离心运动导致的肌损伤与钙激活中性蛋白酶—泛素(calpain-ubiguitin)结合途径有关(金其贯 等,2010,2011)。calpain是一种蛋白降解酶,其被激活后会降解肌肉的各种蛋白,所以calpain在离心运动导致肌纤维损伤过程中的作用备受关注。Lomonosova等(2014)观察到,当肌纤维损伤程度降低时calpain活性也降低,提示calpain与肌损伤有关。已证实大强度离心运动和低氧导致细胞钙超载是激活calpain的关键。随着研究推进,证实肌细胞内微摩尔(μ mol)和毫摩尔(m mol)级的Ca2+浓度便可激活calpain家族的calpain1(μ-calpain)、calpain2(m-calpain)(Bartoli et al.,2005)。骨骼肌和心肌特异性高表达的calpain3,也成为关注焦点(Murphy et al.,2006,2009,2011)。
细胞膜被破坏是细胞不可逆性损伤的关键环节,膜骨架蛋白丢失是膜损伤的重要机制(王金发,2003)。抗肌萎缩蛋白dystrophin(Freitas et al.,2016)、utrophin(Guiraud et al.,2017)是肌细胞主要的肌节外骨架蛋白,dysferlin高表达于骨骼肌,并参与肌细胞膜融合修复(Bansal et al.,2003;Cardenas et al.,2016),3种骨架蛋白对维持肌细胞和肌细胞膜的形态和功能具有重要作用。已证实,肢带型肌营养不良症(limb-girdle muscular dystrophy,LGMD)主要与肌膜蛋白和近膜蛋白缺陷有关,其中dystrophin是关键蛋白(Guiraud et al.,2017),也发现LGMD-2A和2B型的缺陷蛋白分别为calpain3和dysferlin(Roudaut et al.,2013)。上述证据链提示:低氧和离心运动导致的Ca2+超载-激活calpain-calpain激活后降解细胞膜骨架蛋白-膜骨架蛋白丢失-影响细胞膜形态和功能。因此,探索calpain在低氧对EIMD后肌细胞膜损伤中的作用和调控机制,对医学和运动科学领域的研究有重要参考价值。
1 研究对象与方法
1.1 研究对象与实验设计
110只SPF级8周 龄 雄 性SD健 康 大 鼠(体 重196.6±10.1 g,购自北京维通利华公司)在22±2℃、30%~60%相对湿度环境下,以标准啮齿类动物饲料分笼饲养,12/12 h光照/熄灯昼夜交替,自由饮食。适应环境3天后分批完成低氧观察实验(研究I,图1B)和抑制剂实验(研究II,图1C)①各组如有大鼠脱落,用备用大鼠补齐样本。。研究I(低氧对EIMD后膜损伤、calpain和膜骨架蛋白的影响):70只大鼠随机分为7组(每组n=10),包括安静对照组(C组)、常氧24 h、48 h和72 h组(N24、N48和N72组)以及低氧24 h、48 h和72h组(H24、H48和H72组)。研究II(抑制剂实验,验证calpain对肌细胞膜损伤的影响):40只大鼠随机分为5组(每组n=8),包括空白对照组(blank,B)、安慰剂(placebo,Pl)24 h和48 h组(Pl-24和Pl-48h组)和calpain抑制剂(inhibitor,I)24 h和48 h组(I-24和I-48h组)②24 h组伊文氏蓝注射时间点为运动后即刻,48 h组伊文氏蓝在运动后即刻和运动后24 h共注射2次。。
低氧EIMD动物模型:除C组和B组外,各组大鼠均进行4天常氧适应跑台训练,恢复后依据大鼠骨骼肌损伤模型(徐飞 等,2017;Armstrong et al.,1983)在低氧(氧浓度12.7%)下进行间歇性大强度下坡跑(离心)运动。运动方案:速度26.8 m/min,坡度-16°,每组持续5 min,共10组,组 间间歇1 min。
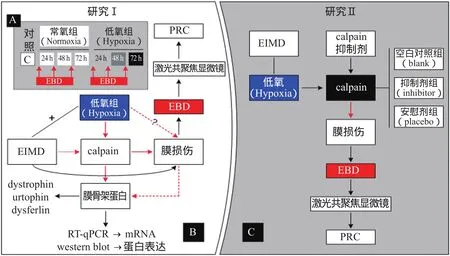
图1 实验设计示意图Figure 1. The Schematic Diagram of Experimental Design
1.2 取材及测试
1.2.1 腹腔注射伊文氏蓝染色
腹腔注射伊文氏蓝(evans blue dye,EBD)荧光染色剂(Sigma,USA),观察膜通透性变化以鉴别损伤模型。常氧与低氧24 h、48 h和72 h组腹注时间分别为运动后即刻、运动后24 h和运动后48 h(图1A)。EBD注射前经Millex-GP 0.22 μm过滤器(Millipore,USA)灭菌,注射剂量为1 mg EBD/0.1 ml PBS(pH7.4)/10 g体重。
1.2.2 取材与处理
各组大鼠完成实验后,以2.3 ml/kg剂量腹腔注射2%戊巴比妥钠进行麻醉,然后迅速分离腓肠肌,取浅层中间段肌纤维,切块冻存。于冰上切取3×3×5 mm3,OCT包埋后用液氮预冷的正己烷(-70℃)速冻,锡纸包裹后投入液氮,以制备冷冻切片。
1.2.3 鉴别肌细胞膜完整性
将EBD染色组织块用Leica冰冻切片机(CM 1850,Germany)切成6 μm厚度样本,荧光显微镜568 nm检测。激光共聚焦显微镜(Leica sp8,Germany)观察EBD切片,测量左、右、中部、上、下5个视野,IPP 6.0光密度分析软件统计EBD阳性细胞率(positive ratio of cells,PRC),鉴别肌细胞膜完整性。
1.2.4 注射calpain抑制剂
用0.1 M PBS配好的10% DMSO溶解calpain抑制剂MG-132(Selleck,USA),现配现用。大鼠运动后即刻腹腔注射MG-132(剂量15 mg/kg体重),然后置于低氧恢复,I-48、Pl-48组在24 h后再次注射。安慰剂组腹腔注射等量生理盐水。各组取材要求及测试方法相同。
1.2.5 反转录实时定量PCR(RT-qPCR)
用反转录实时荧光定量PCR检测calpain和膜骨架蛋白的mRNA表达,PCR扩增引物(Invitrogen,USA)序列(5’to 3’):calpain1上下游引物(105 bp)分别为AGACCATTGGTTTTGCAGTGTA、CTGATTGTGCCCGAGAAGC,calpain2上下游引物(205 bp)分别为GGCTTCGGCATCTATGAGGT、GAAATCGCCATTCTTGTGGG,calpain3上下游引物(100 bp)分别为TTTCAGACAGAGCAAACAGCAACAA、TGTGGGCTTTCCCCTTGTTTAT,dystrophin上下游引物(154 bp)分别为GTGTCCTCTCCTTCTACCTCGCT、 GCTCCATCACTTCTTCTAACCCTGT,utrophin上下游引物(144 bp)分别为CAAAAGCAAGTAGGAAAGGCGTTAG、ATCCTGCAGCGAGTCGATAAGC,dysferlin上下游引物(98 bp)分别为ATCATCCGAGCATTTGGCTTACA、TCCTGGTCACTCACTGATTTCTTCC,内参GAPDH上下游引物(138 bp)分别为TGGAGTCTACTGGCGTCTT、TGTCATATTTCTCGTGGTTCA。用超纯RNA试剂盒(CWbio,Cat#CW0581)提取组织样本总RNA,取5 μl RNA进行1%琼脂糖凝胶电泳检测RNA完整性,用DNaseⅠ试剂盒(CWbio,Cat#CW2090)对RNA中残留基因组DNA进行消化处理,用HiFi-MMLVcDNA第一链合成试剂盒(CWbio,Cat#CW0744)进行反转录,ABI-7500型荧光定量PCR仪,2-△△CT法进行相对定量分析,严格按说明书操作。
1.2.6 Western blot(WB)测定calpain及膜骨架蛋白的含量
取冻存的腓肠肌样本剪碎,加入1 ml含蛋白酶抑制剂的RIPA蛋白裂解液,在抽提蛋白前加入0.1 M PMSF母液(终浓度为1 mM)。根据选取测试样本重量按溶液:裂解液体积(1:9)加入裂解液,以15 000 rpm进行3次匀浆(每次10 s,间隔10 s)。匀浆时用冰水混合物浸泡进行降温,匀浆完成后于冰上孵育20 min,13 000 rpm 4℃离心20 min,然后取上清液分装保存,待测。BCA法测定肌组织蛋白浓度,BCA工作液A液:B液=50:1,稀释各BSA标准品,样品用PBS进行稀释。样品:BCA工作液=1:8,混匀后进行60 min室温孵育,用酶标仪(570 nm波长)读取对应OD值。
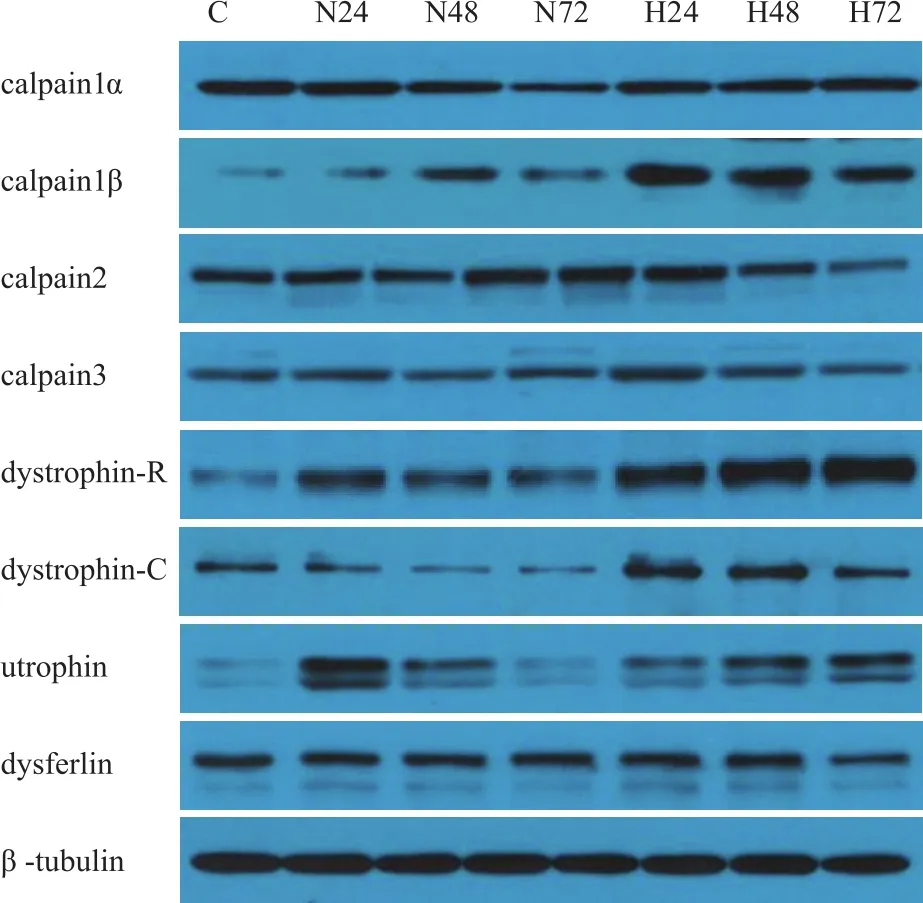
蛋白浓度调整:参照标准曲线,根据吸光度求总蛋白量浓度,用RIPA调整蛋白浓度,加入5倍还原样品缓冲液,样品终浓度为4 mg/ml,煮沸变性5 min。据目的蛋白分子量,配制8%和12%的分离胶,浓缩胶浓度为5%,样品上样量为20 μg/孔。电泳条件:浓缩胶恒压90 V、约20 min,分离胶恒压160 V,通过预染蛋白marker确定电泳时间。用湿转法进行转膜。转膜完成后用丽春红染色剂对膜染色并观察转膜效果。然后将膜浸没在3%的BSA-TBST中,于室温下轻摇30 min。再于室温下孵育10 min,稀释一抗后4 ℃过夜(一抗稀释比例:calpain1α为1:2 000,calpain1β为1:4 000,calpain2为1:4 000,calpain3为1:1 000,dystrophin为1:2 000,utrophin为1:200,dysferlin为1:2 000)。次日4 ℃拿出膜后室温孵育30 min,TBST洗膜5次(每次3 min)。二抗用5%脱脂奶粉-TBST稀释,二抗:山羊抗兔IgG为1:20 000,山羊抗小鼠IgG为1:10 000,室温轻摇40 min。TBST洗膜6次(每次3 min)。ECL加到膜上反应3~5 min,发光显影、胶片曝光、定影得到目的条带图像。采用ImageQuant TL软件计算IOD值。β-tubulin(鼠单抗,1:2 000)作为内参。
1.3 数据处理
数据以均数±标准差(M±SD)表示。将对照组的值处理为1作为基线值,calpain和细胞膜骨架蛋白相关指标进行标准化(与基线值的倍数关系)。双因素方差分析(two-way ANOVA)考察低氧与暴露时间的主效应和交互作用。交互作用不显著时,只考察低氧主效应对因变量的影响,组间比较用单因素方差分析(one-way ANOVA);交互作用显著时,用简单效应分析估计边际均数。多重比较(post-hoc)用LSD法,显著性差异临界值置为P=0.05。
2 研究结果
2.1 动物模型及膜损伤程度鉴定
EBD染色结果显示(图2),除C组外,EIMD后低氧和常氧各组肌细胞都有EBD侵入,切片结果显示,H24和N48组更为明显。PRC结果显示,低氧各组与常氧对应组之间有极显著差异(P<0.01)。且低氧与常氧组PRC呈现出不同的峰值特征和恢复趋势:低氧组PRC峰值出现时间(24 h)早于常氧组峰值出现时间(48 h)。72 h时,常氧组PRC已显著降低(N72 vs. N48组内比较),低氧组PRC与H48组持平(膜损伤仍未恢复、且显著高于常氧对应组(H72 vs. N72,P<0.01)。

图2 低氧对EIMD后大鼠腓肠肌EBD荧光染色及阳性细胞率的影响Figure 2. The Effect of Hypoxia on EBD of Gastrocnemius and Positive Ratio of Cells
2.2 低氧对EIMD后calpain和膜骨架蛋白mRNA表达的影响
2.2.1 低氧对EIMD后calpain mRNA表达的影响
低氧各组calpain1 mRNA表达与C组无显著差异(P>0.05),H72组显著高于N72组(分别为1.067±0.360和0.783±0.178,P<0.05,图3A)。低氧各组calpain2 mRNA显著高于C组,H72组显著高于N72组(分别为1.736±0.970和1.437±0.671,P<0.05,图3B)。calpain3的mRNA表达无组间差异,但与calpain1和calpain2不同的是,低氧与常氧各组calpain3 mRNA随时间延长而降低(图3C)。
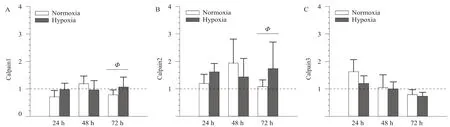
图3 低氧对EIMD后calpain mRNA表达的影响Figure 3. The Effect of Hypoxia on mRNA Expression of Calpain after EIMD
2.2.2 低氧对EIMD后细胞膜骨架蛋白mRNA表达的影响
EIMD后低氧与常氧各组dystrophin和utrophin的mRNA表达显著低于C组。dystrophin和utrophin的mRNA表达随时间延长而降低,H24组显著低于N24组(P<0.01,图4A、B)。utrophin的mRNA在72 h时出现上调,但组间无显著差异(图4B)。dysferlin的mRNA表达相对滞后,呈现先升高(48 h)后降低(72 h)的特征,组间无显著差异(P>0.05,图4C)。
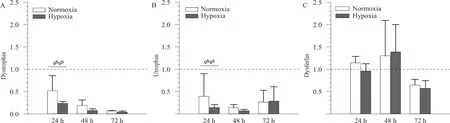
图4 低氧对EIMD后膜骨架蛋白mRNA表达的影响Figure 4. The Effect of Hypoxia on mRNA Expression of Membrane Cytoskeleton after EIMD
2.3 低氧对EIMD后calpain和膜骨架蛋白表达的影响
2.3.1 低氧对EIMD后calpain蛋白表达的影响
WB结果见图5。双因素方差分析结果显示,低氧×时间对calpain蛋白量影响的交互作用不显著(P>0.05)。考察低氧主效应发现,低氧各组calpain1、calpain2和calpain3与常氧各组比较都无显著差异(表1)。
2.3.2 低氧对EIMD后细胞膜骨架蛋白表达的影响
低氧×时间对膜骨架蛋白(dystrophin、utrophin、dysferlin)蛋白含量的交互作用不显著(P>0.05),但utrophin1(F=2.769,P=0.076)和utrophin2(F=2.498,P=0.097)接近显著性差异临界值(表2)。考察低氧主效应发现,低氧各组dystrophin-R、dystrophin-C和dysferlin蛋白量与常氧各组无显著差异(P>0.05),H72组utrophin1高于N72组(P=0.030),两组的utrophin2接近显著差异临界值(P=0.056)。
2.4 抑制剂实验结果
2.4.1 抑制剂对calpain1和calpain2蛋白表达的影响
抑制剂组(I-24、I-48组)calpain1α、calpain1β和calpain2的蛋白含量显著低于B组(P<0.05),安慰剂组(Pl-24、Pl-48组)与B组无显著差异(P>0.05)。I-24组calpain1α和calpain2显著低于Pl-24组(图6B、D),I-48组calpain1α、 calpain1β和calpain2与P1-48组相比,无显著差异(P>0.05)。
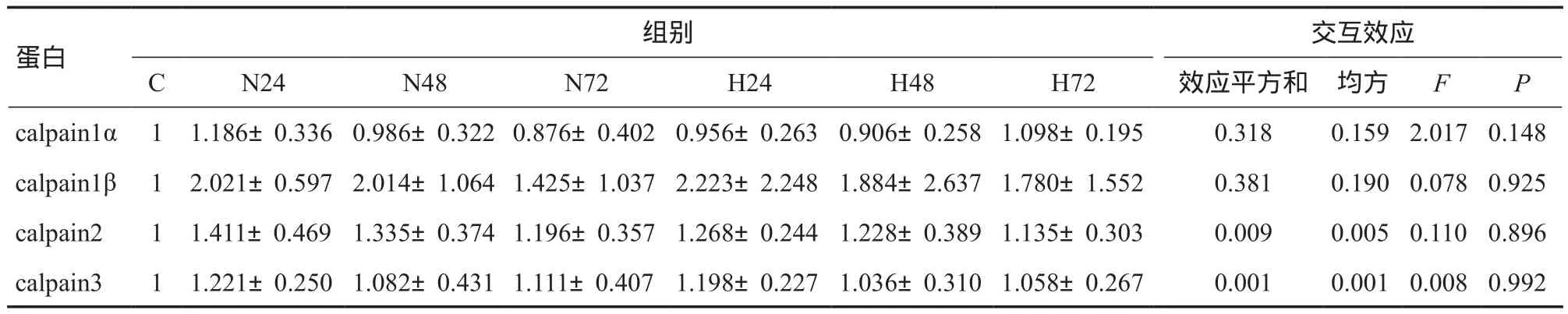
表1 低氧对EIMD后calpain蛋白表达的影响Table 1 The Effect of Hypoxia on Calpain Protein Expression after EIMD
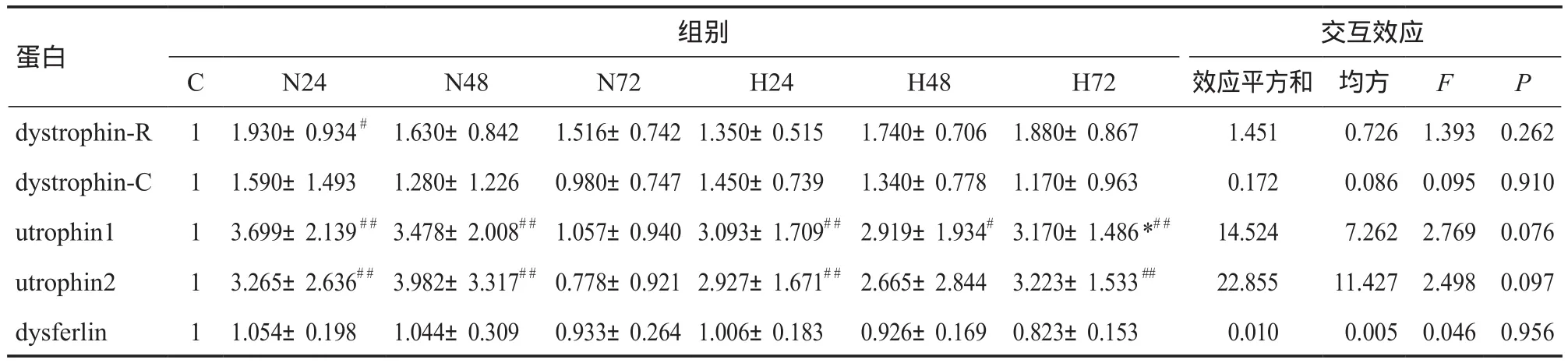
表2 低氧对EIMD后肌细胞膜骨架蛋白表达的影响Table 2 The Effects of Hypoxia on Protein Expression of Membrane Cytoskeleton after EIMD
2.4.2 抑制calpain1和calpain2对肌细胞膜损伤的影响
激光共聚焦显微镜切片观察结果显示,B组肌细胞无明显EBD染料侵入(图7A、B)。calpain抑制剂组和安慰剂组肌细胞均有EBD侵入,Pl-24和Pl-48组更为明显(图7D、F)。PRC结果显示,抑制剂24 h、48 h组PRC显著低于安慰剂对应组(分别为P<0.01、P<0.05),但仍显著高于B组(分别为P<0.05、P<0.01,图8)。安慰剂组(与研究I的低氧组为等效实验处理)PRC峰值(19.40±2.51)出现在24 h,与研究I中低氧组PRC的峰值(21.00±7.69)接近,出现时间(24 h)相同(图2F)。
3 讨论
3.1 低氧对EIMD后肌细胞膜损伤的影响
离心运动导致EIMD的骨骼肌微损伤症状(Lieber et al.,1996;Nosaka et al.,1995)出现肌原纤维排列混乱和肌丝卷曲、断裂等(金其贯 等,2010,2011;Lomonosova et al.,2014),影响肌细胞膜的完整性和通透性(肌酸激酶升高、膜与细胞骨架分离、膜磷脂数量减少和磷脂降解产物堆积)(Cully et al.,2017;Hasenoehrl et al.,2017)。但尚不明确低氧对EIMD后肌细胞膜损伤的影响。本研究中,低氧和常氧各组EIMD后出现明显EBD阳性细胞,EBD与血清蛋白结合形成伊文氏蓝—白蛋白复合物可被激光共聚焦显微镜检出,若观察到胞内EBD阳性细胞增加,则表明肌细胞膜完整性受损(Hamer et al.,2002;Lomonosova et al.,2014)。而低氧组PRC显著高于常氧组和对照组也验证了EBD切片结果。本研究还发现低氧组PRC峰值前移和恢复延迟的现象(H72组PRC与H48组持平,并显著高于N72组)。综上,低氧提前了EIMD后膜损伤的时间并加剧了损伤程度。
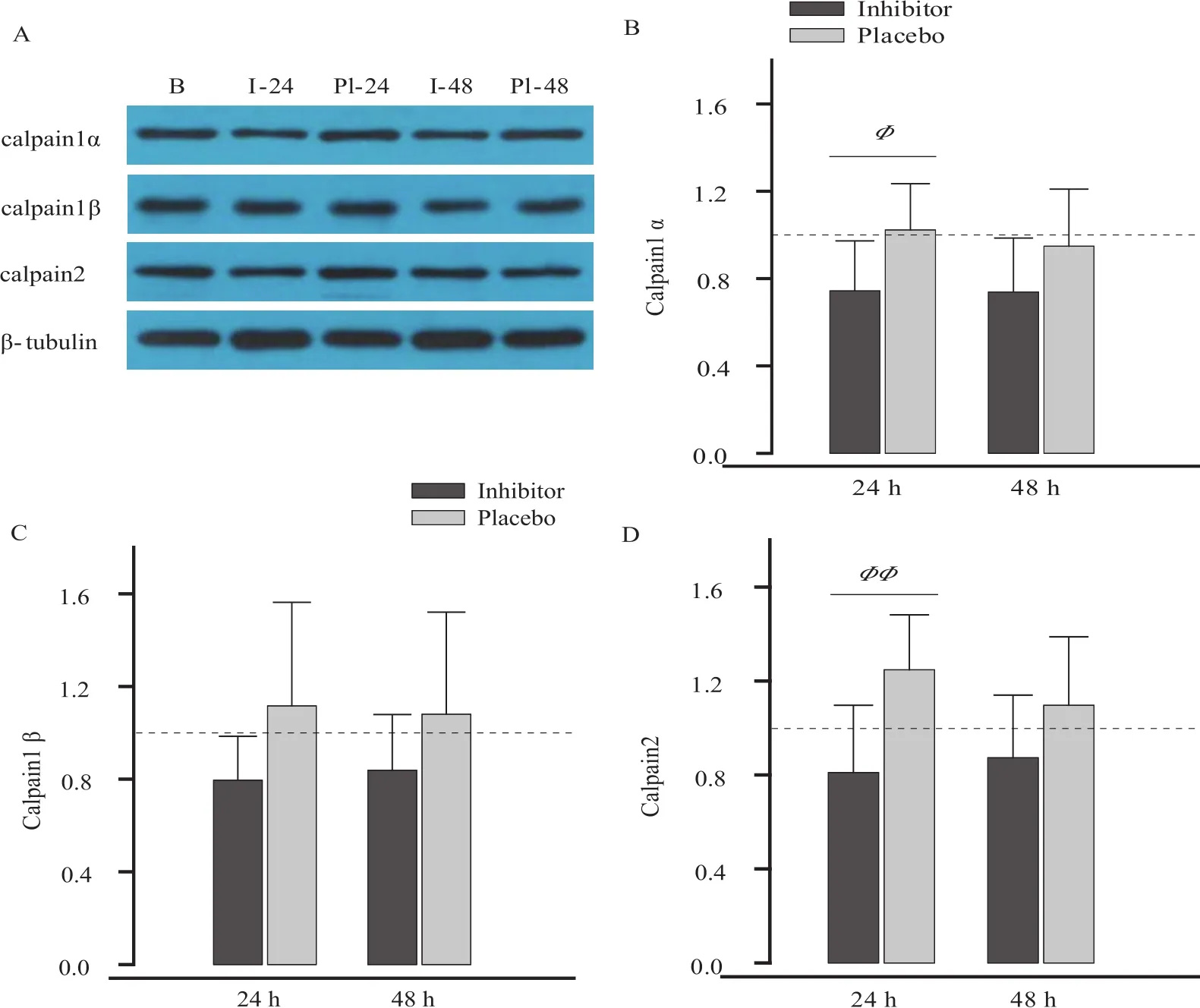
图6 抑制剂对calpain1、calpain2蛋白表达的影响Figure 6. The Effect of Inhibitor on Calpain1 and Calpain2 Protein Expression

图7 抑制calpain1和calpain2对膜损伤的影响Figure 7. The Effect of Calpain1 and Calpain2 Inhibitor on Muscle Sarcolemma Injury
3.2 低氧对EIMD后calpain的影响
calpain是一种蛋白降解酶,主要作用于细胞、骨架蛋白、蛋白激酶和激素受体。calpain1和calpain2和calpain3最为常见,普遍认为calpain对肌肉结构、功能变化具有重要影响(金其贯 等,2010,2011;Lomonosova et al.,2014;Murphy et al.,2009,2011)。但EIMD后低氧对calpain的影响与膜损伤的关系尚不明确。新近研究发现,低氧对calpain有激活作用(Hirata et al.,2015;Kovacs et al.,2016;Wang et al.,2016)。本研究RT-qPCR结果表明,低氧组calpain1、calpain2 mRNA显著上调,与EIMD激活calpain的结果基本一致(Lomonosova et al.,2014)。此外,常氧组calpain1、calpain2 mRNA随时间延长而降低(N72 vs. N48),低氧组mRNA随时间延长而增加(H72 vs. H48)。结合PRC结果可知,常氧组calpain mRNA表达与PRC变化趋势一致(mRNA下调-常氧组膜损伤缓解),低氧48h和72h组则相反(mRNA上调-低氧组膜损伤加剧)。提示低氧导致calpain1、calpain2基因表达上调与膜损伤加剧有关。这与新近研究证据吻合:低氧激活calpain1、calpain2后加速视网膜神经细胞死亡(Hirata et al.,2015)、激活calpain2后抑制肺动脉高压患者血管重塑(Kovacs et al.,2016)。
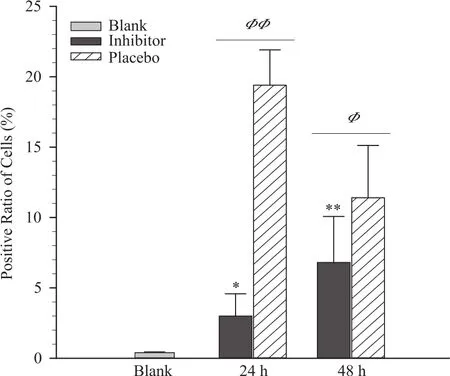
图8 抑制calpain1和calpain2对阳性细胞率的影响Figure 8. The Effect of Calpain1 and Calpain2 Inhibitor on the Positive Ratio of Cells
因calpain3呈骨骼肌特异性高表达,Murphy等(2011)报道,EIMD后24 h会激活calpain3,所以推测低氧也可能激活calpain3。但有趣的是,尽管低氧各组calpain3的mRNA表达低于常氧各组,但并无显著差异;更有意思的是,低氧与常氧各组的mRNA表达都随时间延长而降低(H72 vs.H24),这与笔者的研究假设和calpain1、calpain2对低氧应答的趋势相反。所以,现有证据表明EIMD后低氧并未激活calpain3①本研究N24组calpain3的mRNA表达显著高于C组(图3C),与Murphy等(2011)发现离心运动短期内激活calpain3的结果一致,说明大强度离心运动能够激活calpain3,但这不是本研究要证明和关注的内容,故并未展开讨论。。Murphy等(2011)发现离心运动短期内激活calpain3,但calpain3不能易位进入细胞核和胞质,实际上他们早期另一项研究(Murphy et al.,2009)明确指出安静时胞内Ca2+浓度而非肌肉拉伸的离心运动才是激活内源性calpain3的关键。本研究通过在体实验也发现,EIMD后的低氧暴露并未激活calpain3,提示calpain3可能不是低氧导致膜损伤的主要途径,也可能是EIMD-低氧-calpain3这个过程中存在某种调节calpain3的重要机制。但因缺乏更多有力的研究证据,还需进一步证实。Spencer等(2002)指出,calpain3在正常小鼠肌肉中的高表达并无明显的有害作用。就目前证据而言,究竟是calpain3在低氧导致膜损伤中不起重要作用,还是存在某种调控calpain3-膜损伤的机制,尚不得而知。这是多年来有关calpain3研究的一个谜团,也是将来的研究无法回避的一个难点。
与mRNA不同的是,EIMD后低氧各组calpain1、calpain2和calpain3的蛋白含量与常氧各组都无显著差异,提示,低氧对EIMD后calpain蛋白含量并无显著影响。分析认为,calpain蛋白含量与基因表达不一致并不矛盾,而蛋白含量无显著变化,并不能否定低氧对calpain的激活效应。首先,mRNA的丰度不一定与其翻译产物(蛋白表达量)成线性关系,因为基因表达调控层次很多,转录只是其中一个环节,转录后调控和翻译后调控都会影响最终蛋白量;此外,mRNA降解、蛋白的降解和修饰折叠等因素都可能导致mRNA与蛋白表达水平不一致。其次,本研究mRNA增加表明EIMD和低氧双重因素使calpain基因转录和蛋白合成趋势的增加,而最终蛋白含量无显著增加与calpain激活后的消耗有关。因为calpain是自溶性蛋白水解酶(最大特点是Ca2+激活和自溶式水解,通过被激活来降解其他蛋白),其在自溶水解和降解其他蛋白的同时自身也被消耗,所以calpain蛋白含量应包括其降解其他蛋白所被消耗的部分。Murphy等(2006)也发现力竭运动不能使μ-calpain(calpain1)和calpain3的蛋白含量显著增加,但其研究并未同步测试calpain的mRNA表达。另有多项研究证实,运动后calpain1和calpain3的mRNA表达显著增加(Feasson et al.,2002;Jones et al.,2004),calpain的这种特殊性也体现在本研究结果中。
3.3 低氧对EIMD后细胞膜骨架蛋白降解的影响
肌细胞膜骨架蛋白与细胞骨架连接并与膜蛋白结合,维持膜生理功能。dystrophin及其同源蛋白utrophin(二者NH2端和COOH端相同)是肌细胞主要的肌节外调节蛋白(Freitas et al.,2016;Guiraud et al.,2017)。而高表达于骨骼肌的跨膜蛋白dysferlin主要参与膜的运输和融合修复(Bansal et al.,2003;Cardenas et al.,2016)。本研究发现,低氧组dystrophin和utrophin的mRNA表达显著低于常氧组(H24 vs. N24),蛋白含量并无显著变化。而dysferlin的mRNA和蛋白含量都无显著变化。膜骨架蛋白与肌原纤维肌动蛋白(F-Actin)的多个结合区域(Bansal et al.,2003;Bartoli et al.,2005;Cardenas et al.,2016)是易被攻击的部位,初步发现dystrophin蛋白结构②是一个巨大蛋白,由3685个氨基酸组成,分子量约为427 kD。的中央竿状区(R-rod,该蛋白主体结构)易被大强度离心运动(机械牵拉)破坏,而dystrophin羧基端(COOH,dystrophin-C)的稳定性易受低氧的影响(Stelter et al.,2016)和calpain的攻击(Freitas et al.,2016)。但本研究发现,低氧加剧膜损伤时dystrophin-R、dystrophin-C蛋白并未丢失,说明EIMD后低氧加剧膜损伤,calpain被激活时该蛋白杆状区和C端结构相对完整,这与本研究的研究假设相反。意外发现的是,dystrophin的mRNA和蛋白含量降低时,utrophin的mRNA和蛋白含量出现调节性增加,这印证了Guiraud等(2017)提出utrophin是杜氏肌营养不良症开发新药和基因疗法中新靶点的观点。因为dystrophin与utrophin是同源蛋白且生理功能相似,但Guiraud等(2017)的新发现与膜损伤无直接联系。
EIMD后低氧激活calpain、加剧膜损伤,但膜骨架蛋白并无显著变化,说明EIMD后calpain在低氧加剧膜损伤过程中,并不是通过攻击(降解)膜骨架蛋白dystrophin、utrophin和dysferlin的途径,也即是说calpain导致膜损伤可能有其它机制,可能是降解其它关键的膜相关蛋白,也可能是calpain与上述3种膜骨架蛋白之间存在某种重要的调节和平衡机制(徐飞 等,2017)。但此推理成立的前提是calpain与膜损伤存在必然联系,本研究和前人研究发现,膜损伤和/或肌纤维损伤(金其贯 等,2010,2011;Lomonosova et al.,2014)时calpain有相应变化,只能说明二者存在相关关系,而非因果关系。综上,确认EIMD后低氧加剧膜损伤中calpain的角色是机制研究的关键点。
3.4 calpain抑制效果评价及对肌细胞膜损伤的影响
低氧会导致骨骼肌废用性萎缩和适应性萎缩(D’Hulst et al.,2013),calpain自溶式激活降解蛋白的特性对骨骼肌适应有重要作用(Kanzaki et al.,2017)。研究证实,离心运动后24 h大鼠股四头肌超微结构受损,calpain被激活(calpain1、calpain2蛋白含量显著增加)(金其贯 等,2010,2011;Lomonosova et al.,2014)。但上述研究未能通过在体或/和离体实验证实抑制或激活calpain对膜损伤的影响。本研究采用的calpain抑制剂(MG-132)通过结合calpain中心基团,使蛋白酶失活或活力下降(但并不使蛋白变性),已应用于心肌(Adams et al.,2015)和骨骼肌(Joung et al.,2014)细胞损伤和修复的机制研究。本研究发现,MG-132使calpain1α和calpain2的蛋白表达量显著降低,calpain1β也低于安慰剂组,说明calpain活性得到有效抑制,calpain1α和calpain2的抑制效果优于calpain1β。从蛋白结构来看,被激活的calpain1(有蛋白降解功能)是由大亚基α(催化区,80 kD)和小亚基β(调节区,30 kD)组成,calpain1α是两个相关基因的产物,calpain1β是单个基因的产物。Kanzaki等(2017)通过大鼠在体实验证实,抑制calpain活性对离心运动导致的快肌纤维损伤有显著保护作用,且保护机制与兰尼定受体和肌质网Ca2+-ATP酶途径无直接关系。综合观察实验(金其贯 等,2010,2011;Lomonosova et al.,2014)、抑制实验(Kanzaki et al.,2017)和本研究结果,提示,抑制calpain活性对肌细胞膜损伤有保护作用。
肌细胞膜EBD染色结果发现,对照组肌细胞无明显EBD染料侵入,抑制剂组和安慰剂组都观察到EBD侵入细胞。结合抑制剂组PRC显著低于安慰剂组的结果,说明抑制calpain1、calpain2能减轻膜损伤程度(对维持膜的完整性和正常功能有促进作用),而calpain1α和calpain2的作用可能大于calpain1β。这也在一定程度上从另一个角度证实,Freitas等(2016)离体实验发现激活calpain会加速肌营养不良蛋白(dystrophin)丢失而恶化脓毒性心肌病的结果(本研究的在体实验发现EIMD后低氧激活calpain不是通过攻击dystrophin蛋白引起膜损伤,Freitas等采用心肌细胞培养实验,没有EIMD和低氧刺激)。本结果也支持Kanzaki等(2017)的研究结果。但需指出的是,虽然抑制calpain活性能有效减轻膜损伤,但效果并不是十分理想,因为抑制剂各组PRC仍显著高于对照组,所以除calpain1、calpain2机制外,可能还有其它机制调控EIMD后低氧对膜损伤的过程(徐飞 等,2017)。推测与miRNA调控mRNA-蛋白表达过程有关(一个miRNA可调控多个基因的表达,多个miRNA组合也可精细调控单个基因的表达),已发现骨骼肌特异性表达的miRNA(miRNA-1、miRNA-133、miRNA-206)能精细调控calpain降解膜骨架蛋白的过程(Mancinelli et al.,2016)。Roudaut等(2013)也观察到miRNA调控calpain3基因缺失导致LGMD大鼠骨骼肌dystrophin蛋白的表达。所以这可能是将来calpain激活与膜损伤机制研究的一个重要方向。
4 结论
1. calpain1、calpain2被激活与低氧加剧大鼠EIMD后肌细胞膜损伤有关,但calpain并非通过降解膜骨架蛋白dystrophin、utrophin和dysferlin而导致膜损伤。
2. 抑制calpain1、calpain2活性能有效减轻但不能避免低氧加剧EIMD后的膜损伤,其中还可能存在其它调节机制。

