MiRNA210通过NUPR1基因靶向调控喉癌多药耐药性的研究
何 丹,王 苹,李亚纯,尹万忠
(吉林大学第一医院 耳鼻咽喉头颈外科,吉林 长春130021)
miRNA是真核生物中一类长度约为22个核苷酸的参与基因转录后水平调控的非编码小分子单链RNA,能通过与靶特异性的碱基配对引起靶mRNA的降解或抑制其翻译,从而对基因进行转录后的表达调控[1,2]。miRNAs与肿瘤的多药耐药密切相关[3],miRNA表达的改变可影响肿瘤细胞对化疗药物的敏感性。miRNA在肿瘤的多药耐药中与其作用的靶基因组成了一个复杂的网络调控肿瘤的多药耐药性。本实验拟研究miRNA210及其靶基因在喉癌多药耐药中的作用。
1 材料和方法
1.1实验试剂RPMI1640培养基、胎牛血清、Trizol试剂购于Invitrogen公司,miArrestTMmiRNA210 inhibitor Expression Clone慢病毒表达载体购自广州复能基因公司。双荧光素酶检测试剂盒购自Promega公司。合成质粒HTRA1、NUPR1购自上海捷瑞公司。CCK8试剂盒购于碧云天生物技术研究所。
1.2方法
1.2.1构建荧光素酶报告基因载体验证miRNA210的靶基因 合成我们前期研究中预测的miRNA210靶基因HTRA1、NUPR1 3’UTR序列,筛选并购买双荧光素酶报告基因质粒pmirGLO,转化、小量摇菌、小提质粒,将质粒邮寄上海捷瑞公司,将3’UTR序列插入到pmirGLO中。合成质粒HTRA1、NUPR1。购买miR210表达载体、 miR210抑制物载体,及相应的空载质粒对照,质粒提纯并备用。报告基因质粒HTRA1、NUPR1与miR210表达质粒及对照共转染293T细胞,转染48小时后提取细胞裂解液并用于荧光素酶检测,应用PROMEGA双荧光素酶检测试剂盒检测萤火虫及海肾荧光素酶活性。将NUPR1载体做定点突变,测序,比较突变后miRNA210能否抑制其表达。
1.2.2miRNA210抑制物质粒对喉癌多药耐药表型的改变 复苏耐药细胞Hep-2v。每50毫升含血清DMEM加入360 μl VCR储存液(100 μM),miR210抑制物质粒转染Hep-2v。CCK8 实验:Hep-2v细胞接种于96孔培养板中,分2组,转染Control质粒组和转染miR-210抑制物质粒组,每组设5复孔。在转染后24 h点终止培养,每孔加入10 μl CCK8溶液,37℃下孵育1-4小时,测定450 nm处的OD值。细胞活力为处理组的OD值/正常组OD值×100%。
1.2.3转染miRNA210抑制物质粒后多药耐药相关基因的表达 实验分为三组,Hep-2v组,转染对照组Control/Hep-2v组,转染miRNA-210抑制物质粒组miR210in/Hep-2v组。Real-time RT-PCR检测转染抑制物前后MDR1、NUPR1基因的表达。以人Actin为内参,PCR反应的特异性通过产物熔解曲线进行确认,mRNA的相对含量根据公式Fold change =2-ΔΔCT计算。CT为反应的实时荧光强度达到设定的阈值时所经过的扩增循环数。
1.2.4转染miRNA210抑制物质粒后多药耐药相关基因蛋白的表达 免疫荧光染色:细胞培养并收取样本,弃去培养液,用PBS溶液洗涤2次,加入4%的多聚甲醛溶液固定30 min,用0.1 mol/L PBS洗涤3次,加入1% Triton X-100处理15 min,5%羊血清封闭1 h,加入一抗( Rabbit anti-Nupr1 ,1∶100稀释,Rabbit anti-MDR1,1∶100稀释),4℃孵育过夜,用0.1 mol/L的PBS洗涤3×15 min,加入二抗(Alexa Fluor 555羊抗兔IgG,1∶400,Alexa Fluor 488羊抗兔IgG),室温避光放置1 h,0.1 mol/L的PBS洗涤,加入Hoechest33342标记细胞核,甘油封片,激光共聚焦荧光显微镜下观察。
1.3统计学分析
所有数据来自至少3次独立实验,计量数据采用平均数±标准差,用SPSS Statistics 10.0软件进行分析,生长抑制的比较采用单因素方差分析,两组比较采用t检验,P<0.05认为有统计学差异。
2 结果
2.1miRNA210靶基因的验证
构建3′UTR报告基因质粒HTRA1、NUPR1分别与miRNA210表达质粒共转染293T细胞,通过检测报告基因/内参基因的荧光比值确定miRNA210的作用靶点。结果见图1。HTRA1的荧光值在miRNA210组和Control质粒组之间无明显差别。而NUPR1质粒转染的荧光值明显低于转染control质粒组。表明NUPR1基因可能是miRNA210的靶点。构建一个NUPR1 3′UTR的miRNA210靶点的突变质粒,与miRNA210共转染,结果见图2,野生型(WT)的NUPR1组的荧光值明显低于突变组(MU)。进一步证实,NUPR1是miRNA210的作用靶点。
2.2抑制miRNA210表达对喉癌多药耐药表型的改变
转染Control质粒组和转染miRNA210抑制物质粒组(miR210in)通过 CCK8 实验表明转染miRNA210抑制物质粒组,Hep-2v细胞的存活率明显降低。见图3。

图1 比较NUPR1和HTRA1质粒与miRNA210共表达的荧光值变化 图2 比较野生型NUPR1和突变性NUPR1质粒与miRNA210共表达的荧光值变化 图3 miRNA210抑制物质粒组对Hep-2v细胞的抑制作用miRNA210in/Hep-2v组与Control/Hep-2v组比较
2.3抑制miRNA210表达对喉癌多药耐药相关基因表达的改变
转染miRNA210抑制物质粒组miR210in/Hep-2v组中NUPR1mRNA的表达明显增高3.11倍,P<0.01,而MDR1mRNA的表达明显降低2.05倍,P<0.01。表明抑制miRNA210的表达则喉癌耐药细胞多药耐药基因的表达明显逆转。见图4及图5。
2.4抑制miRNA210表达对喉癌多药耐药相关基因蛋白表达的改变
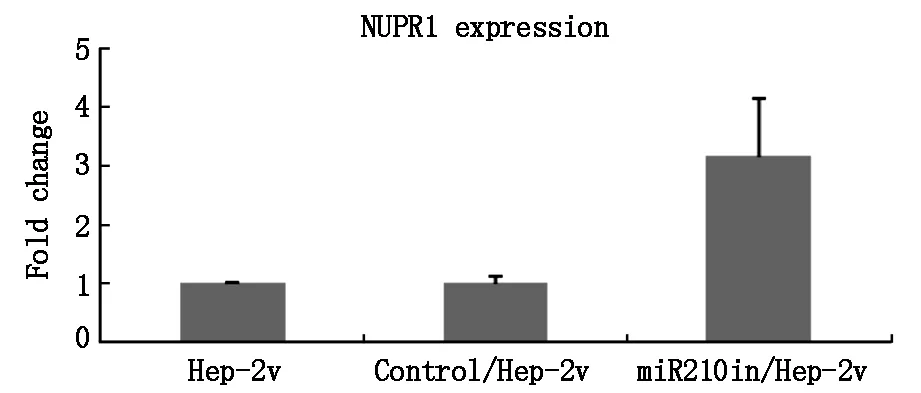
P<0.01,miRNA210in/Hep-2v组与Control/Hep-2v组比较

P<0.01,miRNA210in/Hep-2v组与Control/Hep-2v组比较
Hep-2v细胞NUPR1蛋白(P8)表达位于细胞膜,少量位于细胞浆中,呈绿色荧光染色,miRNA210in/Hep-2v细胞组中NUPR1蛋白表达荧光强度明显增加;而MDR1蛋白表达荧光强度明显下降。见图6及图7。
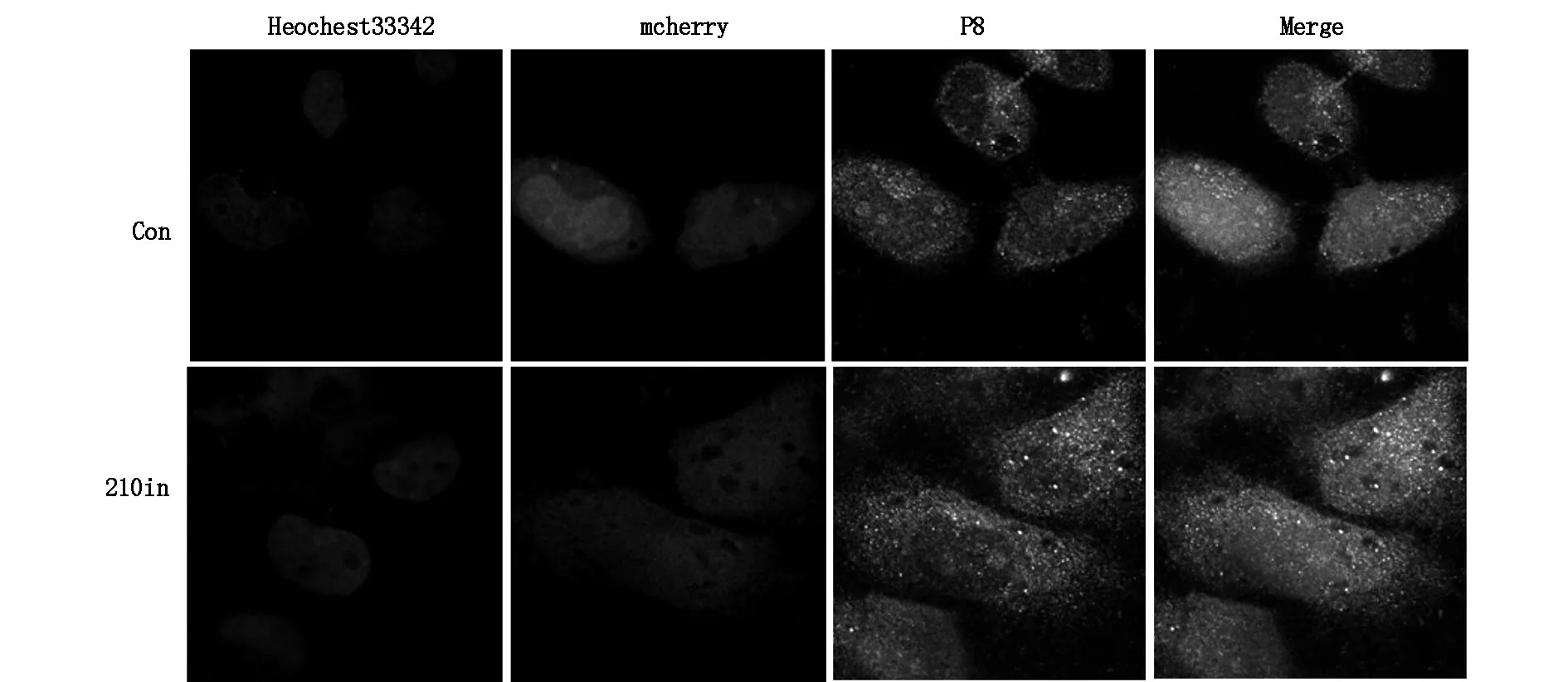
图6 miRNA210in转染Hep-2v细胞NUPR1蛋白表达
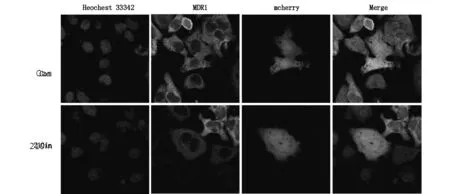
图7 miRNA210in转染Hep-2v 细胞MDR1蛋白表达
3 讨论
近年来,许多实验室分别开发出了应用于预测miRNA靶基因的计算机方法,这些方法依据miRNA与靶基因3′UTR的序列互补性,包括miRNA5′端的称之为“seed”或“nucleus”的串联碱基的存在和该位点的物种间保守性,并计算了预测的miRNA:mRNA双链的自由能。但是这种预测方法并不能完全确定miRNA的靶基因,需要通过实验进一步验证,而实验验证预测的靶基因常用的是构建荧光素酶报告基因载体。在这个载体的报告基因编码区的下游含有靶基因的3′UTR区和推测的结合位点,用该载体转染表达miRNA的细胞后,如果野生型载体中报告基因的活性低于带有突变结合位点的载体中报告基因的活性,可证明这个miRNA确实作用于该靶基因[4]。
我们的前期实验表明miRNA210与喉癌的多药耐药密切相关,我们通过Target数据库预测出miRNA210的靶基因为HTRA1及NUPR1[5]。本实验中我们通过双荧光素酶报告基因载体实验证实,NUPR1是miRNA210的作用靶点,即miRNA210可通过调控其靶基因NUPR1的表达影响喉癌的多药耐药性。
miRNAs与肿瘤的多药耐药密切相关,miRNA表达的改变可影响肿瘤细胞对化疗药物的敏感性,研究表明miR214同恶性肿瘤的多药耐药密切相关[6],其调控机制与Wnt/β-catenin通路有关。Blower等[7]系统的研究了miRNA与肿瘤耐药的关系并发现,miRNA表达谱和抗肿瘤药物对肿瘤细胞的生长抑制作用密切相关。另外对头颈部鳞癌细胞的研究发现抑制miR193a的表达能够逆转细胞的耐药性。其机制是通过抑制p-73介导的反馈调节通路实现的[8]。也有研究表明miR212能够调节类EGF肝素结合生长因子使头颈部鳞癌细胞对西妥昔单抗产生耐药性[9]。这些研究结果充分表明了miRNA在肿瘤的多药耐药中发挥着重要的作用,miRNA与其作用的靶基因组成了一个复杂的网络调控肿瘤的多药耐药性[10]。
MiRNA不仅在特定的细胞层面影响肿瘤细胞的药物耐药,而且在药物的作用方式上也发挥作用。例如,miR-34a表达水平的增高与耐多西紫杉醇的乳腺癌细胞系有关。然而与之相反miR-34a表达水平的下降将会增加尤文氏肉瘤细胞对阿霉素和长春新碱的敏感性[11]。在非小细胞肺癌中,miR-126可以有效的结合在血管内皮生长因子(VEGFA)的3′非编码区。而血管生成抑制剂贝伐单抗的作用靶点就在此区域。另外,miR-126的表达的升高可以逆转肿瘤细胞的多药耐药性,这就为靶向治疗提供可能性[12]。
miRNA210在低氧条件下能够抑制细胞增殖。越来越多的研究表明低氧微环境是导致肿瘤临床治疗效果差的主要因素之一,它能够增强肿瘤细胞对放化疗的抵抗,同时也使其更易发生侵袭和转移。多个miRNA参与了低氧反应过程,而miRNA210是低氧条件下反应变化最为显著的miRNA之一[13]。miRNA210在头颈肿瘤中的表达通常是升高的,miRNA210的表达可用来评定组织乏氧程度,同时也与头颈癌患者的预后相关[14,15]。本组实验中,我们构建了miRNA210抑制物质粒载体,并转染到受体细胞中,结果表明抑制miRNA210的表达,喉癌细胞的存活率明显降低,凋亡率明显增高,喉癌多药耐药相关基因的mRNA表达及蛋白表达均有明显改变,喉癌细胞的多药耐药性明显逆转。
研究结果表明miRNA210靶基因为NUPR1,抑制miRNA210的表达,可明显增加喉癌细胞对化疗的敏感性,miRNA210可通过调控其靶基因NUPR1的表达影响喉癌的多药耐药性。本研究可为以mRNA尤其是以miRNA210为靶点的药物开发及逆转耐药治疗提供依据,进而为提高喉癌化疗的敏感性提供理论基础,对喉癌的综合治疗有潜在的临床应用价值。

