芝麻过敏原分子特征与检测方法研究进展
马秀丽,黄文胜,张九凯,韩建勋,葛毅强*,陈 颖,*
(1.中国检验检疫科学研究院,北京 100176;2.中国农业大学食品科学与营养工程学院,北京 100083;3.中国农村技术开发中心,北京 100045)
芝麻(Sesamum indicum)又名脂麻、胡麻,在热带和亚热带广泛种植,据海关数据统计,2016年全球芝麻实际生产量约为450.90万 t。我国是芝麻生产、消费大国,2015年出口3.15万 t,进口80.59万 t,2016年产量63.00万 t[1]。芝麻油和芝麻酱是深受百姓喜爱的调味品,芝麻籽因其受热能产生浓香,被用作调味料广泛添加于糕点、菜肴和饮品中。同时,芝麻也是常见的食物过敏原之一,芝麻过敏患者在接触芝麻及制品后会出现包括皮肤和黏膜反应、呼吸反应、胃肠道反应在内的全身性反应,甚至可能休克或死亡[2-3]。
流行病学调查发现,美国约有50万消费者对芝麻及其制品过敏[4]。各国儿童对芝麻及其制品过敏的比例为0.1%~0.8%,其中美国和加拿大0.1%、澳大利亚0.8%、以色列0.2%[5-9]。在以色列,芝麻是仅次于牛奶和鸡蛋的第三大常见食物过敏原[10]。欧洲(意大利、法国、英国、丹麦、瑞典、瑞士等)及亚洲(日本)各国都有芝麻过敏的相关报道[11-14]。近年来,随着芝麻过敏发病率的升高,芝麻过敏已引起全球很多国家重视[15-17]。
由于芝麻及其制品在食品中使用广泛,芝麻过敏患者生活中接触芝麻过敏原的机会也大幅增加。各国开展了对芝麻过敏原阈值的相关研究,发现芝麻过敏原的引发剂量(eliciting dose,ED)05在芝麻蛋白的1.2~4.0 mg之间,ED10在4.2~6.2 mg之间[18-22]。过敏原的正确标识是预防过敏患者误食相关食品的唯一有效途径[23-24]。欧盟、加拿大、澳大利亚和新西兰等国要求含有芝麻成分的食品必须进行标识[25-29],2014年日本也建议生产商对含芝麻制品进行过敏原标识[18]。
食品在各生产环节(加工、储存、运输、销售)都有可能被芝麻过敏原污染(无意污染)[30]。明确芝麻过敏原蛋白氨基酸序列、晶体结构及其免疫球蛋白(immunoglobulin,Ig)E结合表位等生物信息,建立芝麻过敏原成分定性、定量检测方法,对于预防芝麻过敏、探讨食品加工过程对蛋白过敏原性的影响评估、开展致敏性消减研究等都具有重要意义。
本文旨在对各国对芝麻过敏原的管理规定、芝麻过敏原蛋白的结构特征、加工过程对其结构及致敏性影响、检测方法等方面的研究进展进行综述,总结芝麻过敏原的研究现状,并对未来研究趋势进行展望。
1 芝麻主要过敏原蛋白结构和功能研究进展
截至2017年,经国际免疫学会联合会(International Union of Immunological Societies,IUIS)确认的芝麻主要过敏原包括2 种2S白蛋白(Ses i 1(9~14 kDa))和Ses i 2(7 kDa)、1 种7S类豌豆球蛋白(Ses i 3(45 kDa))、2 种油质蛋白(Ses i 4(17 kDa)和Ses i 5(15 kDa))、2 种11S球蛋白(Ses i 6(52.2 kDa)和Ses i 7(56.6 kDa))[31-35]。其中2S白蛋白和11S球蛋白是主要的过敏原蛋白。以上几种芝麻过敏原蛋白的生物化学特征、生物学功能以及在数据库中的信息总结如表1所示。
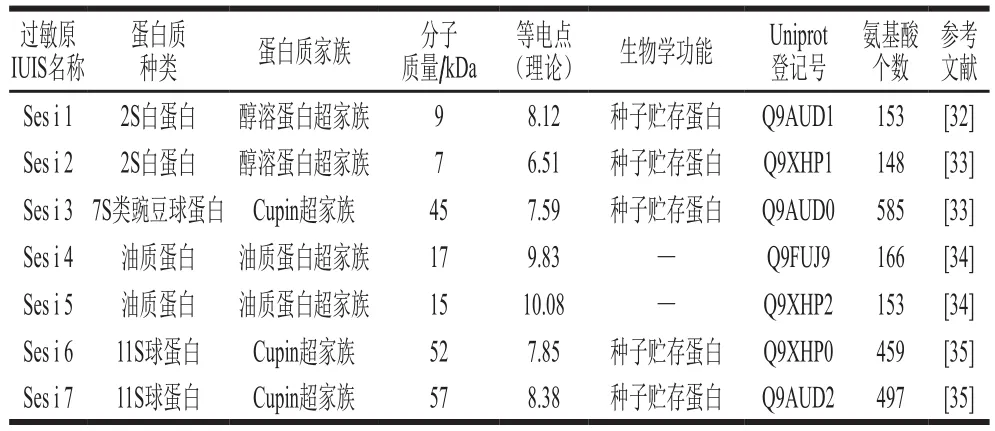
表1 芝麻主要过敏原蛋白Table 1 Major sesame allergens
1.1 芝麻主要过敏原Ses i 1和Ses i 2
Ses i 1和Ses i 2属于醇溶蛋白超家族(AF050)中的2S白蛋白家族,该类蛋白占芝麻总蛋白的25%左右[36]。醇溶蛋白超家族主要是依据其在醇-水混合物中的溶解性而定义[37],该家族成员通常分子质量低,在低浓度盐溶液中可溶于水,富含精氨酸、谷氨酰胺、天冬酰胺和半胱氨酸残基[38],含约100 个氨基酸残基,其中含有6~8 个半胱氨酸残基用于分别形成3~4 个二硫键,以维系蛋白质在合成后修饰切割形成的大小为两个亚基的正常折叠结构。通常认为2S白蛋白可直接通过胃肠道致敏。其高度稳定的蛋白结构表明,这些蛋白质可以穿过肠道黏膜屏障,使黏膜免疫系统处于致敏状态或引起过敏反应[39-40]。
Ses i 1和Ses i 2是芝麻中主要的过敏原蛋白[32],根据Uniprot蛋白数据库分析,由cDNA推导的Ses i 1含有153 个氨基酸,其序列如图1A所示,氨基酸1~21为信号肽。天然过敏原蛋白等电点为7.3,含有大小两个亚基,二者等电点分别为6.5和6.0,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测得的分子质量9 kDa[32],有较好的水溶性,且富含硫元素。Uniprot蛋白数据库中Ses i 2被命名为2S种子贮藏蛋白,又名2S贮藏白蛋白、β-球蛋白。其前体蛋白序列如图1B所示,含有148 个氨基酸,氨基酸1~19为信号肽,小亚基位于氨基酸39~68,大亚基位于氨基酸77~146。大亚基的分子质量为7 kDa。天然的Ses i 2有15 个蛋氨酸(M)和10 个半胱氨酸(C),其中8 个半胱氨酸在大、小亚基间形成两个链间二硫键(42↔97、54↔86),在大亚基内形成两个链内二硫键(87↔133、99↔141),用以维持其正常的三维结构[39],其蛋白结构模型如图2所示。Ses i 1与核桃(Juglans regia)中的2S白蛋白Jug r 1有38.56%的同源性,但序列比对结果显示Jug r 1中重要的IgE结合抗原表位与Ses i 1中相应位置的序列同源性有限[41](图3A),与榛子(Corylus avellana)过敏原Cor a 14有44%的同源性。Ses i 2与Jug r 1、Ses i 1分别有35.14%、38.5%的同源性(图3B),与巴西坚果(Bertholletia excelsa)过敏原Ber e 1、碧根果(Carya illinoinensis)过敏原Car i 1的同源性分别为39.9%、37.8%。也有研究认为,该前体蛋白形成14 kDa的β-球蛋白是主要的过敏原蛋白[31]。通过使用重叠肽段文库筛选的方法来鉴定其与人血清抗体的结合位点,其中SRQCQMRHCM、QCQMRHCMQW、NQGQFEHFREC 3 条肽段最可能含有致敏的抗原表位[40](图4中绿色标注部分)。而这些抗原表位与巴西坚果Ber e 1、蓖麻(Ricinus communis)过敏原Ric c 1的同源性分别为35%、45%[40]。

图1 芝麻过敏原氨基酸序列[32-33]Fig. 1 Amino acids sequences of sesame allergens[32-33]

图2 芝麻过敏原Ses i 1和Ses i 2蛋白模型[44]Fig. 2 Protein models of sesame allergen Ses i 1 and Ses i 2[44]

图3 芝麻过敏原Ses i 1、Ses i 2与核桃过敏原Jug r 1序列比对结果[41]Fig. 3 Sequence alignment s of sesame allergen Ses i 1, Ses i 2 and walnut allergen Jug r 1[41]

图4 芝麻过敏原蛋白(Ses i 2)抗原表位空间构象[40]Fig. 4 Spatial conformation of epitope in sesame allergen (Ses i 2)[40]
此外,Moreno等[42]发现Ses i 1可耐受温度为90 ℃,在酸性和中性条件中均稳定,并在胃肠道消化实验中表现出较好的稳定性。Orruño等[43]用蛋白酶消化纯化2S白蛋白,发现2S白蛋白(Ses i 1、Ses i 2)在天然状态下对胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶的消化均有很强的抗性,并且二者的氨基酸序列中都不存在糖基化修饰位点[33]。
1.2 芝麻主要过敏原Ses i 3
Beyer等[33]发现Ses i 3可以被75%的芝麻过敏患者血清所识别,是芝麻中另一种主要过敏原。Ses i 3是7S类豌豆球蛋白,属于Cupin超家族(AF045),该超家族的成员在其三维空间结构中具有β-折叠桶的蛋白质超二级结构,β-折叠桶是由很多的β-折叠片层以螺旋的形式缠绕在一起,筒中心由疏水氨基酸残基组成,并通过氢键维系形成的一种封闭的结构[45]。具有两个Cupin结构域的蛋白最初是在高等植物种子储藏蛋白中发现的,分为7S球蛋白三聚体(豌豆球蛋白)和11S球蛋白六聚体(豆球蛋白),这两种蛋白也是芝麻中主要的过敏原。Ses i 3在芝麻7S类豌豆球蛋白中含量最多[33],分子质量为45 kDa,缺乏二硫键。cDNA推导的Ses i 3前体由585 个氨基酸组成[44],氨基酸1~23是信号肽,氨基酸202~354和氨基酸395~560是其两个结构域,其蛋白三维结构模型如图5所示,与β伴大豆球蛋白具有相似的Cupin结构,都是由两个串联排列的Cupin模体结构组成。Orruño等[46]采用选择性沉淀法和阴离子交换色谱法从芝麻籽中分离纯化出7S类豌豆球蛋白,发现所分离的4 条蛋白带中均含有与前体蛋白氨基酸序列(E181)REEEQEEQG、(G389)ESKGTINIY相同的肽段,为同源序列。Ses i 3与花生中的Ara h 1(7S球蛋白)整体上有36%的同源性,在Ara h 1大部分的已知抗原表位相应区域二者同源性不高[47],但在Ara h 1中已知的某个IgE结合抗原表位(TPGQFEDFFP)上二者相应的区域有高达80%的同源性,且两者的差异氨基酸也在IgE关键识别位点之外[33],如图6所示。因此,在花生过敏患者中,Ses i 3和Ara h 1的IgE抗体之间的会有交叉反应,这点与花生和大豆之间的交叉反应类似[48]。此外Ses i 3前体蛋白和开心果(Pistacia vera)过敏原Pis v 3、榛子(Corylus avellana)过敏原Cor a 11之间分别有47%、42%的同源性。Ses i 3在自然状态下容易被胃蛋白酶酶解,对胰蛋白酶、胰凝乳蛋白酶的抵抗性较强[43]。
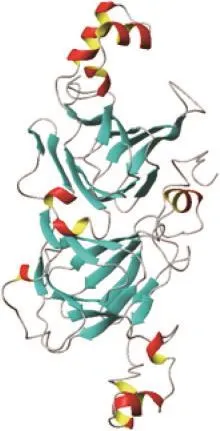
图5 芝麻过敏原Ses i 3蛋白模型[44]Fig. 5 Protein model of sesame allergen Ses i 3[44]
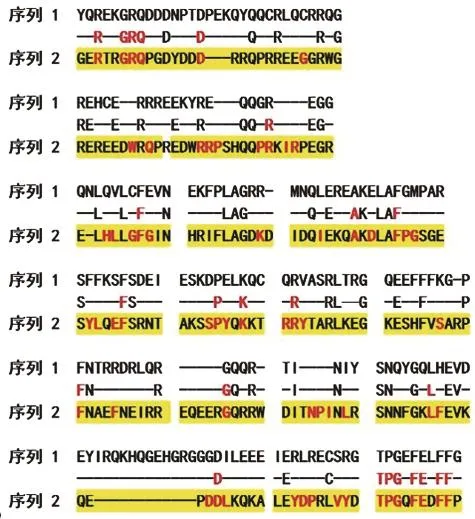
图6 芝麻过敏原Ses i 3与花生过敏原Ara h 1序列比对结果[47]Fig. 6 Sequence alignment of sesame allergen Ses i 3 and peanut allergen Ara h 1[47]
1.3 芝麻主要过敏原Ses i 4和Ses i 5
Leduc等[34]发现32 例芝麻过敏患者血清中全部含有油质蛋白(17 kDa和15 kDa)特异性IgE抗体,说明二者也是芝麻的主要过敏原。IUIS将其命名为Ses i 4和Ses i 5,属于Oleosin家族(AF090),该家族中的过敏原种类较少,目前已知的有花生中的Ara h 10、Ara h 11,榛子中的Cor a 12、Cor a 13等[49-51]。
Ses i 4由166 个氨基酸组成,是一种α-螺旋跨膜蛋白,参与跨膜肽段为40~69、81~114,如图7A所示。它与榛子中的油质蛋白过敏原Cor a 12有54%的同源性,与花生中的油质蛋白过敏原Ara h 10有46%的同源性。Ses i 5由198 个氨基酸组成,参与跨膜肽段为38~64、70~99,如图7B所示。它与Cor a 13的同源性高达75%,与Ara h 11的同源性达66%。何凡等[52]克隆了芝麻油质蛋白Oleosins的基因并在原核细胞中表达,重组蛋白分子质量约为15.5 kDa,等电点为5.18。

图7 芝麻过敏原Ses i 4和Ses i 5氨基酸序列[34]Fig. 7 Amino acid sequences of sesame allergens Ses i 4 and Ses i 5[34]
1.4 芝麻主要过敏原Ses i 6和Ses i 7
Ses i 6和Ses i 7属于Cupin超家族(AF045)中的Legumin家族(11S球蛋白),成熟的11S球蛋白通常以六聚体形式存在,分子质量约为360 kDa。一般情况下,11S球蛋白单体经过翻译后修饰由酸性亚基(30~40 kDa)与碱性亚基(20 kDa)经过分子间二硫键连接而成[53]。水不溶性11S球蛋白约占芝麻总蛋白的60%~70%,是芝麻蛋白的主要组成部分。据Uniprot蛋白数据库分析,Ses i 6是由459 个氨基酸组成的,氨基酸序列如图8所示,其中氨基酸1~21是信号肽,氨基酸22~277 为酸性肽链,氨基酸278~459是碱性肽链,两肽链之间通过二硫键连接(110↔284),分子质量为52.2 kDa[54]。Ses i 7也属于11S球蛋白,分子质量为56.6 kDa[55],结构与Ses i 6相似,由酸性和碱性两条肽链组成,两者有38%的同源性。Ses i 6、Ses i 7与花生中的Ara h 3(11S球蛋白)整体上有39%的同源性,在Ara h 3中已知的IgE结合抗原表位上二者相应的区域有较高的同源性,且在IgE关键识别位点上也有很多相同(图9)。并且二者已被成功克隆和重组表达,Magni等[56]通过体外实验发现,Ses i 6可以激活嗜碱性细胞,并与核桃过敏原存在交叉反应,与天然蛋白质相比,其重组蛋白由于没有经过加工产生两条肽链,免疫反应活性比天然11S球蛋白要低得多。与Ses i 3相似,二者在天然状态下易被胃蛋白酶消化,但对胰蛋白酶、胰凝乳蛋白酶的抵抗性较强[43]。与其他Cupin超家族成员相比,成熟后正常行使功能的11S球蛋白很少发生糖基化[53],而蛋白是否发生糖基化也被认为与过敏原的致敏性有关。
Stutius等[57]考察了美国儿童对坚果、花生过敏与对椰子、芝麻过敏之间的关系,发现对花生或坚果过敏的儿童更易对芝麻过敏,说明芝麻和花生、坚果之间存在交叉过敏反应。Achouri等[58]考察了pH值、高压(100~500 MPa)和热处理(煮沸、微波加热、烘焙)等不同的提取条件对芝麻总蛋白浓度、二级结构及酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)反应的影响,发现使用水和较低盐浓度(0.2 mol/L NaCl)制备的蛋白具有更高的免疫活性,高盐浓度促进盐析和聚集,可能会阻止表位与抗体反应,高压处理显著降低了芝麻蛋白的抗原性,沸水和烘烤等热处理方法增加了ELISA反应活性,而微波处理则相反。经傅里叶变换红外光谱分析,可能是蛋白质结构变化导致抗原表位破坏、掩蔽或暴露,从而减少或增加其免疫原反应,但未对芝麻中各过敏蛋白进行单独研究。

图9 芝麻过敏原Ses i 6、Ses i 7与花生过敏原Ara h 3序列比对结果[55]Fig. 9 Sequence alignment of sesame allergens Ses i 6, Ses i 7 and peanut allergen Ara h 3[55]
综上,目前芝麻中已知的过敏原有Ses i 1~Ses i 7共7 种,主要过敏原是2S白蛋白和7S、11S球蛋白,其致敏活性由其抗原表位决定。热处理、超高压等食品加工过程可改变或破坏食物过敏原结构及其抗原表位,从而改变其致敏性。对芝麻各过敏原分子结构、理化性质、抗原表位以及加工过程对过敏原影响的研究是开展食物脱敏技术的基础。然而,芝麻中过敏原组分较多,不同过敏原的空间构象以及抗原表位的数量构型皆不相同,在消减致敏性的同时又需兼顾食品品质,这给研究过敏原消减技术带来了难题与挑战。并且,目前没有任何脱敏技术能够完全消除芝麻过敏原的致敏性。而芝麻过敏原常具有较强的致敏性,能够诱发严重的食物过敏反应,甚至会导致休克或者死亡。目前消费者对于过敏食物的预防主要来自于明确的标签标识。因此,准确、可靠的芝麻过敏原检测方法显得尤为重要。
2 芝麻过敏原检测方法研究进展
过敏原的检测技术分为针对蛋白质和核酸两类。其中,基于核酸的检测技术有各种聚合酶链式反应(polymerase chain reaction,PCR);基于蛋白质的检测技术有免疫学方法、电泳、质谱(mass spectrometry,MS)和高效液相色谱法等。
2.1 基于核酸的检测方法
基于核酸的检测技术主要是以DNA/RNA为标志物鉴定过敏原种类。在食品加工热处理过程中,致敏蛋白结构容易被破坏[58],而过敏原的DNA相更耐受高温处理。相比于检测过敏原蛋白成分,检测DNA残留显得更加灵敏可靠[59]。目前基于核酸技术的芝麻过敏原检测方法主要包括常规PCR技术、实时荧光定量PCR(quantitative real-time PCR,qPCR)、多重PCR以及其他PCR衍生技术等。
2.1.1 常规PCR技术
PCR由高温变性、低温退火及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增。PCR法的突出特点是其具有极高的灵敏度,这在检测食品过敏原成分时极为重要[59],并成为某些国家食品安全检测机构或实验室的官方方法。王玮等[60]依据芝麻2S白蛋白mRNA基因设计的特异性引物序列,扩增片段为62 bp,并且在普通PCR方法的基础上,通过2 组4重PCR扩增,建立了检测包括芝麻在内的8 种过敏食物成分的PCR方法,检测限为100 pg。该方法可用于食品中过敏原成分的快速检测,并为开展新型、快速、高通量的食物过敏原可视薄膜生物传感器检测方法提供了技术基础[61]。
2.1.2 qPCR技术
传统PCR技术对扩增产物进行终点检测,而qPCR技术是在PCR反应体系中加入荧光基团,在PCR扩增过程中实时检测和收集荧光信号积累。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数实时存在线性关系,所以成为定量的依据。qPCR技术主要包括TaqMan qPCR法和SYBR Green qPCR法。TaqMan qPCR法是利用双荧光标记探针的荧光基团解离产生的荧光强度变化定量PCR产物。Brzezinski等[62]采用TaqMan qPCR法,根据芝麻2S白蛋白基因设计特异性引物探针,扩增长度为66 bp,对芝麻、多种坚果(扁桃仁、腰果、榛子、胡桃、巴西胡桃)、花生、南瓜籽、葵花籽、罂粟籽DNA扩增,发现只有芝麻可以产生特异性的扩增曲线,且与其他过敏食品DNA无交叉反应,灵敏度可达5 pg DNA,以饼干为基质的最低检测限为50 mg/kg。在市售的咸饼干、坚果水果棒、豆沙泥中都有检测到芝麻DNA成分。SYBR Green qPCR法是利用SYBR荧光染料特异地插入DNA双链后,发射荧光信号,保证荧光信号的增加与PCR产物的增加完全同步。Pafundo等[63]利用SYBR®GreenER™技术建立了一种能同时鉴定食品中芝麻、扁桃仁、榛子、腰果、花生等的多重实时荧光定量PCR方法,对芝麻的检测灵敏度可达0.5 pg DNA。制定的芝麻定量标准曲线R2=0.999 8,并利用该方法在市售的饼干、面包、巧克力中检测到了芝麻DNA成分。Schöringhumer等[64]利用芝麻过敏原Ses i 1的基因片段,对牛奶巧克力米饼、饼干、酱料等食品中的芝麻成分进行了鉴别,其最低定量限为50 pg基因组DNA。另外,Mustorp[65]和Waiblinger[66]等建立了qPCR方法检测食品中的芝麻成分,分别在小麦粉/大米粉饼干和酱料中加入过敏原成分,定量范围在10~123 mg/kg,与Brzezinski等[62]建立的方法(检测限为50 mg/kg)相比,检测限更低(10 mg/kg)。Schöringhumer等[67]建立双重PCR方法检测食品中的芝麻和榛子过敏原。
2.1.3 其他方法
微芯片毛细管电泳-PCR技术在利用常规PCR检测过敏原时,对PCR扩增终点DNA片段的测定是检测方法灵敏度的关键。传统的琼脂糖凝胶电泳对长度差异小的DNA片段分辨准确率较低且操作繁琐等缺点。微芯片毛细管电泳是近年来快速发展且应用前景广泛的新技术,其显著优点是微量、可自动化、结果更加准确。Coïsson等[68]利用微芯片毛细管电泳-PCR技术建立了一种同时检测芝麻、芹菜过敏原的多重PCR方法。根据芝麻2S白蛋白基因设计特异性引物探针,扩增片段长度为339 bp,利用微芯片毛细管电泳对终点扩增产物进行测定,检测限可达1 μg/g,可达到单重PCR方法的灵敏度。相比于之前的PCR方法,该方法的灵敏度提高。
多重连接探针扩增法(multiplex ligation-dependent probe amplification,MLPA)是基于在PCR技术发展起来的新技术,能够对待检DNA序列进行定性和半定量分析。每个MLPA探针包括两个荧光标记的寡核苷酸片段,二者与靶序列进行杂交,之后使用连接酶连接好两部分探针。接着用一对通用引物扩增连接好的探针,通过毛细管电泳分离每个探针的扩增产物,在一次反应中可以检测40~50 个核苷酸序列,该技术高效、特异[69]。López-Calleja等[70]利用MLPA同时检测芝麻、向日葵、罂粟、亚麻籽和大豆5 种食物过敏原,通过PCR法扩增连接探针,利用毛细管电泳检测扩增产物,并通过对50 种植物样品进行分析验证方法的特异性,该方法的检测限为10 mg/kg;通过qPCR技术对方法的准确性进行验证;通过对56 种商业产品的分析,验证MLPA方法的适用性,也发现了部分商品未按规定进行过敏原标识。
近几十年来,以核酸为标志物的物种种类鉴别检测方法飞速进步,并获得了广泛应用。在检测过敏原成分方面。PCR方法的突出优点是具有极高的灵敏度、特异性强、能够克服交叉反应的影响,避免对单一特异性抗体的需求。DNA比大多数蛋白的热稳定性高,因此,PCR方法能用于各种加工食品中过敏原成分的检测。目前,传统PCR和qPCR已经广泛应用于国内外食品中芝麻过敏原成分的检测。但是,PCR法检测的是DNA而非致敏性蛋白,检测的结果并不能真正反映食品的致敏性。并且在PCR过程中扩增效率的影响因素诸多,实际样品和标准样品之间、不同样品之间的扩增效率差异均能影响Ct值,致使定量检测结果不准确。所以qPCR的定量只是半定量,其准确度和重现性难以满足行政执法和贸易商品检测的要求。
2.2 基于蛋白的检测方法
蛋白质通常具有一定种内保守性和种间特异性,也可以作为物种鉴别技术的理想分析对象,基于蛋白的检测方法主要有基于过敏原/抗体的免疫学方法和MS分析等。
2.2.1 免疫技术
免疫学技术是通过抗原和抗体的特异性结合反应和信号放大技术达到鉴定食品过敏原成分的方法。主要包括ELISA、放射过敏原吸收抑制实验、免疫印迹和免疫扩散及各种试剂盒等,其中以ELISA方法的应用最为广泛。
ELISA法是利用抗体抗原之间的高度特异性反应和酶的高效催化作用相结合发展建立的一种免疫分析方法,能够直接检测致敏蛋白,它是芝麻过敏原检测的常用方法之一,具有特异性高、敏感性强和准确性高等优点。目前,用于芝麻过敏原的检测方法有双抗夹心ELISA法和竞争ELISA法。Husain等[71]建立了芝麻蛋白间接竞争ELISA法,在脆面包、饼干等样品中的检测限和定量限分别为5 μg/g和30 μg/g(芝麻蛋白/食品),在新鲜的面包和面包卷中分别为11 μg/g和49 μg/g(芝麻蛋白/食品)。Redl[72]和Maruyama[73]等建立了双抗体夹心ELISA法检测芝麻过敏原,以芝麻蛋白免疫鸡和兔制得包被抗体和二抗,在全谷物面包中的检测限和定量限分别为0.5 μg/g和0.6 μg/g。目前针对芝麻过敏原的商业化ELISA试剂盒主要有Tepnel、R-Biopharm、ElisaSystems等公司的产品,其能够进行定性和半定量检测。以上ELISA方法和试剂盒主要针对芝麻总蛋白或2S球蛋白进行检测,虽然方便快捷,但也存在低通量、高基质干扰、交叉反应等缺点[74]。目前ELISA法检测食物中芝麻过敏原的研究实验中所针对的过敏原有所差异,即只检测单一过敏原,或只检测总过敏原[75]。
2.2.2 质谱法
基于MS技术的蛋白质鉴定基本原理是将蛋白质酶解成多肽,将多肽混合物色谱分离后进行MS或串联MS(tandem mass spectrometry,MS/MS)分析,得到的数据与蛋白质数据库进行比对,从而鉴定蛋白质[76]。MS既不存在免疫学方法通量低和交叉干扰的弊端,也克服了PCR技术不能直接检测致敏蛋白质的缺点[76-77],能结合蛋白质组学方法对蛋白质和多肽进行准确鉴定和定量,并可以同时检测多种过敏原,其正逐渐成为食品过敏原检测的主流方法[78-80]。目标过敏原的定量检测主要采用智能选择或多反应监测(multiple reaction monitoring,MRM)模式,MRM的显著优点是具有较高的灵敏度和特异性,能够在复杂的样品中对蛋白质进行定量[81]。
Huschek等[82]以100 mmol/L碳酸氢铵+4 mol/L尿素+5 mmol/L二硫苏糖醇(pH 8.2)溶液提取蛋白,采用溶液内酶切的方式得到酶切肽段,利用Nexera UHPLC/HPLC及SCIEX QTRAP 5500 MS/MS 液相色谱-MS联用(liquid chromatograph-MS,LC-MS)系统定性定量食品中的芝麻含量。以11S球蛋白Ses i 6的3 条肽段为芝麻过敏原的特征肽段(表2),并将同位素标记的特征肽段作为内标,在面包、小麦原料粉、饼干中进行芝麻过敏原的定量,回收率为70%~113%,定量限为10~50 mg/kg(过敏食物/食品基质)。MS检测依赖蛋白数据库,数据库不全等问题容易导致特征肽段的非特异性。经本团队的初步研究表明,表2中的芝麻过敏原Ses i 6特异肽段SPLAGYTSVIR实际在碧根果蛋白酶切肽段中也存在。因此,在靶肽段的特异性验证时需要扩大阴性样品范围,降低非特异性。该方法用稳定同位素标记的特征肽作为内标,在前处理结束后加入样品中用以校正MS离子化的不稳定性,而且能校正基质对酶切过程造成的干扰,使建立的方法更加准确可靠。由此可见,LC-MS检测技术是检测过敏原蛋白的有效新方法。
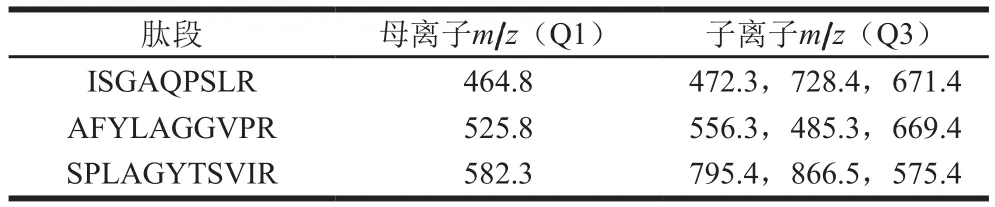
表2 芝麻过敏原蛋白11S球蛋白Ses i 6的MS定量特征肽及其离子对[82]Table 2 Parent and daughter ions for signature peptides of seasame allergen Ses i 6[82]
基于抗原抗体特异性反应的免疫学方法或非免疫性的MS分析等方法都有其优缺点,需要针对不同样品找到最适合的检测方法。其中,以ELISA为主的免疫学方法操作简单、专业要求低、使用范围广泛、灵敏度高、通量高,可以同时检测大量样品、成本低。但其难点是需要抗原稳定、特异性要求高的单克隆抗体,否则在复杂基质中检测时容易出现交叉反应,产生假阳性结果。加工过程能够改变蛋白的结构,其中包括过敏原蛋白的抗原决定簇。这将导致该方法对加工后样品中过敏原成分鉴定和定量检测的准确度降低,常常需要其他方法辅助检测。
目前,鸟枪法和MS技术相结合检测食品中过敏原成分成为新的发展方向。该方法前处理简单,在MS分析前无需通过双向电泳等方法分离蛋白,只需将提取的总蛋白酶解成肽段混合物,通过MS分析目标蛋白的特征肽段,达到鉴定的目的。以MRM分析特征肽含量,即可实现多种过敏原成分的同时定量检测。该方法无需合成抗体,新成分检测时开发方法周期短;基于非免疫性的特征肽段相比于整个蛋白在检测时受加工影响较小,方法的稳定性、重现性高。该方法的关键是筛选特异性强、稳定的肽段作为特征肽段,保证检测方法的准确、稳定、可靠性。MS技术正在食品安全领域被逐步推广,因此,蛋白组学结合MS技术检测过敏原成分具有广阔的前景。
3 结 语
芝麻种植范围遍布世界,被称为全能营养库,是重要的油料和食品保健品常用加工原料,但其使用的广泛性给芝麻过敏患者带来诸多风险。目前成功被鉴定出7 种过敏原Ses i 1~Ses i 7,近年来引起各国广泛关注。芝麻过敏反应是IgE介导的I型超敏反应,芝麻过敏反应可发生在各个年龄段,轻者可出现口腔黏膜过敏、皮肤荨麻疹等,重者可出现咽喉水肿、急性哮喘、过敏性休克,甚至导致死亡。
截至目前,饮食上严格控制芝麻的摄入仍然是避免芝麻过敏反应最为有效的途径,消费者对于过敏食物的预防主要来自于明确的标签标识。因此,准确、可靠的芝麻过敏原检测方法显得尤为重要。对于芝麻过敏原,目前主要的检测方法是PCR法和ELSIA法。PCR法灵敏度高、特异性强。ELISA法的操作简单、灵敏度高。二者作为芝麻过敏原定性检测方法研究较为充分,但是在食品过敏原的标签管理中,对于过敏原含量的检测十分重要,需要依靠可靠的定量技术作为依托。而在PCR过程中扩增效率的影响因素诸多,难以满足高准确度的定量。ELISA等免疫学方法特异性取决于抗原的制备,应用范围受到限制;加热过程会破坏蛋白质结构中的抗原决定簇,导致检测结果出现假阴性;各种商业化的ELISA试剂盒只能用于定性和半定量,并不能准确地定量芝麻过敏原。因此开发精准的定量检测技术将成为检测方法的发展方向。MS技术结合蛋白质组学方法能够在肽段水平和蛋白水平实现蛋白的定量,不依赖抗原抗体的制备;所检测的特征肽段稳定性高,几乎不受加工过程的影响;并且所选特征肽段与过敏原抗原表位重合,可进一步说明食物的致敏性。基于MS技术的定量蛋白质组学在过敏原的检测方面具有广阔的应用前景。
另一方面,对过敏原结构、致敏和脱敏机制等的研究也不断深入发展。不同的加工方法能够改变过敏原蛋白的各级结构、可以直接影响其致敏性;结构改变也可以影响蛋白聚集性,消化吸收性等,间接影响蛋白的致敏性。结构的改变有可能掩盖或者破坏过敏原表位,降低致敏性;也有可能引起聚集,形成新的免疫反应性结构,增强过敏原的潜在致敏性。结构变化导致的消化吸收能力的改变,可能因为抗原表位的破坏或者暴露而引起致敏性降低或者增强。目前,对于芝麻过敏原蛋白结构变化和致敏性变化之间的关系和机理还未被阐明,需要更为深入且全面的研究,从而揭示加工中过敏原蛋白结构聚集、交联或裂解等变化,探讨抗体与抗原的动力学反应,致敏性的变化规律;为采用不同工艺或方法定向消除或降低食品过敏原的致敏性提供理论参考,也为过敏原标签标识的实施提供理论依据。

