甲磺酸阿帕替尼联合TACE治疗中晚期肝癌的效果及对患者血清VEGF和MMP-9的影响
杨庆 潘松松 施昌盛 谢相滂 郑冰汝 诸葛小菊
原发性肝癌是常见的恶性肿瘤之一,由于病情进展快,死亡率也较高,占全球癌症相关死亡原因的第2位[1]。从病理学角度分析,原发性肝癌的病理分型分为肝细胞肝癌(hepatocellular carcinoma,HCC)、胆管细胞肝癌及混合型肝癌三类。在中国,HCC占原发性肝癌的比例高达85%~90%[2],是肝癌的主要病理类型。对于早期HCC,外科手术切除效果明确,也是唯一可能治愈HCC的方法。但HCC患者早期常无临床症状,一经发现往往已经进入中晚期[3-5],此时往往已经错失手术的良机。经皮肝动脉化疗栓塞术(transcatheterarterialchemoembolization,TACE)是治疗HCC的有效手段,也是目前正在推广的一种治疗手段,其主要原理是利用栓塞剂封闭肿瘤的主要供血血管,减少或阻断肿瘤血供,使肿瘤组织因缺血缺氧发生坏死,由于肝癌主要由肝动脉供血,而正常肝组织的血供以门静脉供血为主,所以TACE对正常肝组织的血供影响较小[6],同时TACE还可以配合局部应用化疗药物,形成局部的药物高浓度,更有效地杀伤肿瘤细胞。与其他保守治疗相比,TACE不仅能够更显著地抑制肿瘤的进展,还减少了全身用药带来的难以避免的不良反应,是中晚期肝癌患者的首选治疗方式。在TACE治疗过程中,肿瘤组织原有的血供受限或被阻断,继而进入缺血缺氧状态,这可能会刺激肿瘤细胞进行调节,改变缺氧诱导因子(HIF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达量,最终导致肿瘤新生血管生成也增加,并形成侧支循环,导致治疗失败,但是如果在TACE治疗的过程中同步使用抗血管生成药物,这一结果可能有所不同[7]。因此,TACE联合抗血管生成药物可能是更理想的治疗手段。
针对肿瘤血管治疗的想法由来已久,自1971年Folkman发现肿瘤生长的血管依赖性并提出针对血管治疗以来[8],与肿瘤血管生成相关的研究结果层出不穷。根据分子肿瘤学的研究结果[9],当肿瘤达到2~3 mm时,肿瘤内部血液和氧气就无法满足肿瘤生长的需要,此时,肿瘤会做出调整,诱导血管生成。在诱导血管生成的过程中,VEGF家族发挥了最重要的作用[10-11],其中的血管内皮生长因子受体(VEGFR)-2与肝癌血管生成的关系密切。有研究对肝癌经TACE治疗后残余的肿瘤组织进行检测发现,组织中VEGF和VEGF相关受体阳性的细胞数量较治疗前明显增多,细胞中VEGF相关基因的表达也更加活跃,研究还发现术后病情进展迅速的患者血清中VEGF表达的水平升高更明显,且与预后相关[12-13]。在肿瘤血管生成的过程中,血管内皮细胞是最重要的靶细胞,甲磺酸阿帕替尼作为VEGFR-2的特异性抑制剂,具有抑制血管内皮细胞增殖的作用。同时,阿帕替尼还能够改变肿瘤细胞的多耐药性,从而提高传统化疗药物尤其是铂类药物的疗效。基质金属蛋白酶(matrix metalloprotein,MMP)-9是肿瘤转移过程中不可或缺的酶[14],其在肿瘤血管生成中也发挥了重要作用。临床上,由于早期肝癌首选手术治疗,因此中晚期肝癌的治疗是TACE的主战场。此时,肝癌已经进展,甚至已经有转移的趋势,恶性程度较高。由于癌细胞的异型性较高,化疗药物的效果欠佳,而针对肿瘤血管的治疗受肿瘤异型性的影响较小。为了更好的展现联合治疗方案的优势,本研究选取了治疗难度较大的中晚期肝癌作为研究对象,将TACE与甲磺酸阿帕替尼结合,用TACE术栓塞已有血管,阻断肝癌细胞的血流供应,同时用阿帕替尼阻断VEGFR-2,阻止肿瘤组织新生血管的形成,更加彻底的阻断血流供应。通过观察血清VEGF和MMP-9的变化,探讨阿帕替尼联合TACE对血管生成的抑制效果及肿瘤转移的抑制作用。
资料与方法
一、临床资料
选取2015年6月至12月瑞安市人民医院收治的46例HCC患者,均经穿刺活检和组织病理诊断为HCC。纳入标准:①无明显化疗禁忌证,心、肾等主要器官功能无明显障碍;②巴塞罗那肝癌分期(Barcelona Clinic Liver Cancer,BCLC) 为 B 期或 C期;③肝功能Child-Pugh分级为A或B级;卡氏功能状态(KPS)评分>60分(评分越高,越能忍受治疗的不良反应);④未接受外科手术的首诊患者。以上标准需全部满足。排除标准:①肝功能失代偿,Child-Pugh分级为C级;②肝癌BCLC分期为A期或D期;③有药物过敏史,包括对阿帕替尼过敏和TACE相关药物过敏;④重要脏器功能障碍;⑤无法配合治疗者;⑥妊娠或哺乳期患者。以上标准符合1条即排除。
研究采用完全随机对照设计,用随机数表法进行分组,将所有患者分为观察组和对照组,每组23例,对照组仅行TACE治疗,观察组行TACE联合阿帕替尼治疗。两组的性别、年龄、病程、BCLC分期、肝外转移和血管侵犯情况差异无统计学意义(P>0.05),见表1。本研究遵循赫尔辛基宣言,所有患者均充分告知治疗的风险和收益并签署知情同意书,再报本院医学伦理委员会批准。
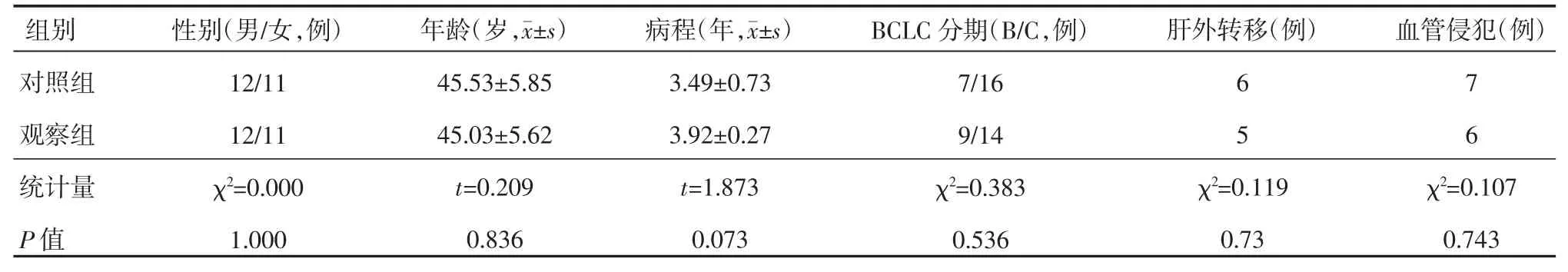
表1 对照组与观察组的基本资料比较 (n=23)
二、治疗方法
1.对照组:仅行TACE治疗,方案如下:改良Seldinger穿刺法经皮-股动脉穿刺,成功后插入导管进行肝动脉造影,了解肝肿瘤的情况,并结合患者全身情况来确定栓塞剂的剂量。将导管置入肿瘤的供血血管中,根据患者病情需要注入适量的5-氟尿嘧啶(5-FU,西安海欣制药有限公司生产,国药准字:H20050511)、阿霉素(山西普德药业股份有限公司生产,国药准字:H14023143),碘油同时起着栓塞剂和载体的功能,须与化疗药物充分混合后一起注入,再根据具体情况选择栓塞微球进行辅助栓塞。所有患者均于术前给予昂丹司琼8 mg止吐,术后给予保肝药,对术后疼痛无法耐受者给予止痛处理,并维持电解质酸碱平衡。
2.观察组:在对照组的基础上给予甲磺酸阿帕替尼(江苏恒瑞医药股份有限公司生产,国药准字:H20140105)口服,其余治疗方案完全相同。甲磺酸阿帕替尼具体用法及用量如下:(1)首次TACE治疗4 d后开始服药,剂量为500 mg/d,持续服药1~2周;(2)治疗2周后对患者耐受情况进行评估,主要以不良反应作为参考指标,根据评估结果调整剂量,具体调整方案如下:①若患者耐受情况良好或仅出现轻微不良反应,则维持原剂量;②若患者出现明显不良反应,则减少至250 mg/d观察或暂时停药观察,但停药观察时间不超过1个月。若执行方案②后不良反应消失或降级,则恢复至原剂量继续观察。下一周期TACE治疗前4 d停止服药,在TACE术完成后重复上一轮用药流程。
三、肿瘤疗效的评价
所有患者每3个月定期行增强CT或MRI检查,同时复查血清甲胎蛋白(alpha fetoprotein,AFP)、MMP-9和VEGF水平,再依据修正的实体肿瘤疗效评价标准(mRECIST)对肿瘤的控制情况进行疗效评价[9],评价结果分为完全缓解(complete response,CR):所有靶病灶均无动脉期增强,没有新病灶出现;部分缓解(partial response,PR):靶病灶增强扫描动脉期的直径缩小30%以上;疾病进展(progressive disease,PD):动脉增强期的目标病灶显影直径比原始水平至少增大20%,或有新的肿瘤病灶出现;疾病稳定(stable disease,SD):介于PR和PD之间。计算疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
无进展生存时间(progress free survival,PFS)定义为患者从接受治疗开始到PD或者死亡(不计死亡原因)的这段时间。观察起点为首次治疗时间,终点为PD或末次随访时间。当患者明确为PD时,则根据患者病情需要行其他治疗,如射频消融或放疗等。每8周进行一次疗效评价,记录患者的不良反应。所有患者均随访1年,随访期间记录半年生存率和1年生存率。总生存期为治疗开始到随访结束或患者死亡的时间。
四、血管生成相关指标的检测
所有患者均于治疗前及治疗后1个月分别采集两次血液标本,用酶联免疫吸附实验(ELISA)法检测VEGF和MMP-9的水平,所用试剂盒购自美国Sigma公司。
五、不良反应的评价
采用脸谱评分法评价疼痛情况,因4分以下的疼痛对患者影响较小,故本研究只记录4分以上的疼痛;若手术前后收缩压升高20 mmHg以上,则判断为血压升高。
六、统计学处理
研究数据采用SPSS 24.0进行统计学处理,患者的性别、BCLC分期、肝外转移、血管侵犯、疗效、生存率、不良反应发生率采用例(%)表示,两组比较采用χ2检验;年龄、病程、血清VEGF及MMP-9水平采用±s表示,两组比较采用t检验,以P<0.05为差异有统计学意义。
结 果
一、两组患者疗效比较
观察组的疾病控制率明显高于对照组,差异有统计学意义(P<0.05),见表 2。
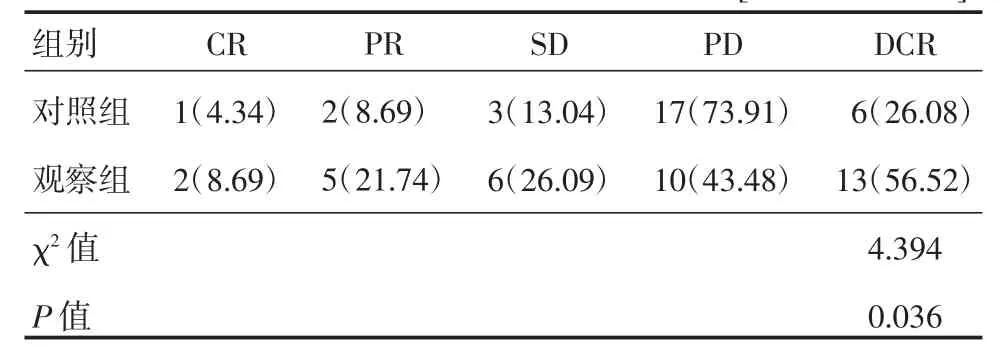
表2 两组患者的疗效及疾病控制率比较 [n=23,例(%)]
二、两组患者的生存率比较
观察组的总生存率高于对照组,差异有统计学意义(P<0.05);两组的半年生存率和1年生存率比较差异无统计学意义(P>0.05),见表3。
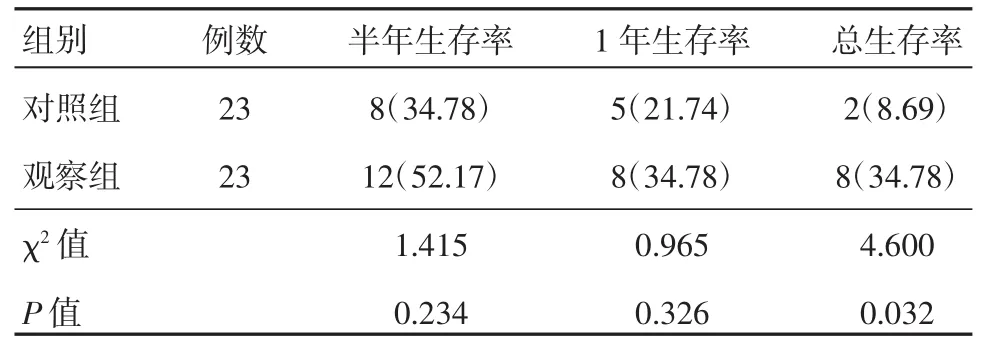
表3 两组患者的生存率比较 [例(%)]
三、两组的不良反应情况比较
两组患者的不良反应主要表现为发热、恶心、呕吐、腹痛、尿储留、血压升高、皮肤瘙痒等,两组的不良反应总体发生率差异无统计学意义(P>0.05),见表4。
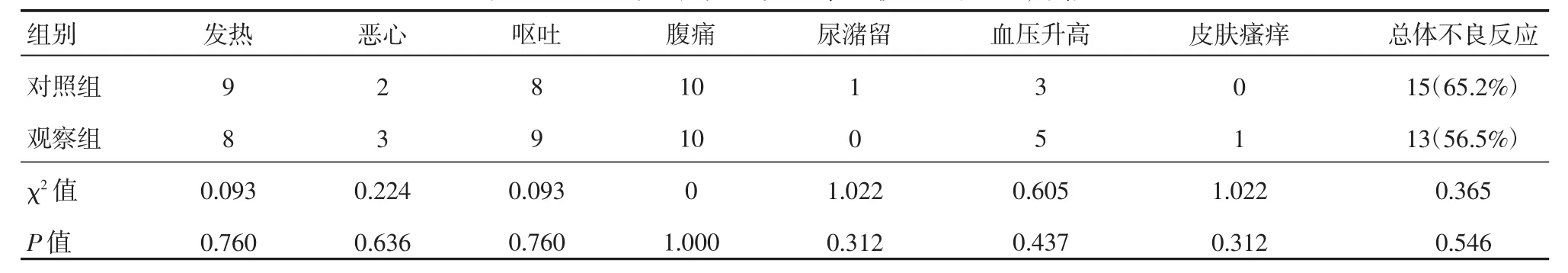
表4 两组的不良反应发生率比较 (n=23,例)
四、两组患者治疗前后血清VEGF及MMP-9水平比较
治疗前,两组血清VEGF和MMP-9差异均无统计学意义(P>0.05);术后1个月,观察组VEGF和MMP-9均低于对照组,差异有统计学意义(P<0.01),见表 5。
表5 两组患者治疗前后血清VEGF和MMP-9水平比较 (n=23,ng/ml,±s)
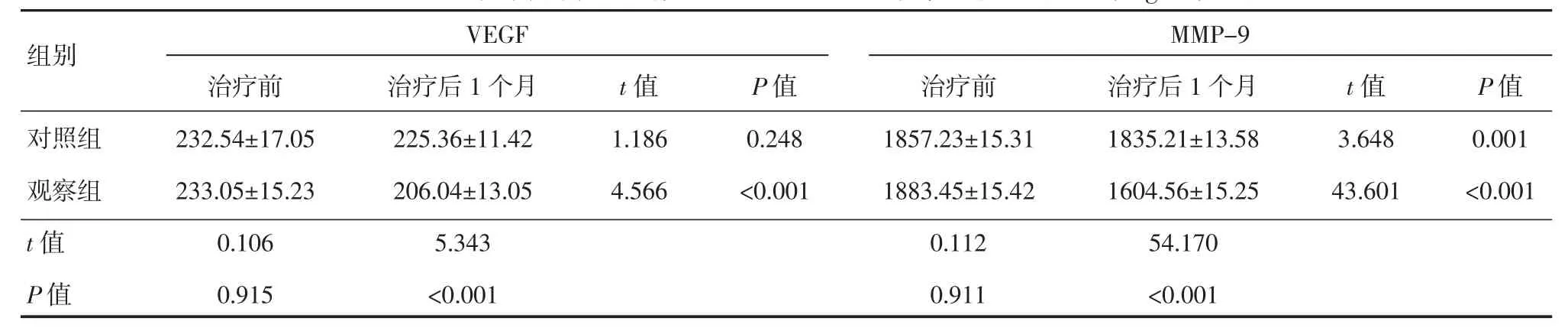
表5 两组患者治疗前后血清VEGF和MMP-9水平比较 (n=23,ng/ml,±s)
组别 VEGF MMP-9对照组观察组t值P值治疗前232.54±17.05 233.05±15.23 0.106 0.915治疗后1个月225.36±11.42 206.04±13.05 5.343<0.001 t值1.186 4.566 P值0.248<0.001治疗前1857.23±15.31 1883.45±15.42 0.112 0.911治疗后1个月1835.21±13.58 1604.56±15.25 54.170<0.001 t值3.648 43.601 P值0.001<0.001
讨 论
HCC是消化系统的常见肿瘤,发病率和死亡率均较高[15],严重威胁人类健康并且造成了巨大的经济负担。目前,早期外科手术依然是HCC患者唯一有可能治愈的手段,也是唯一一个痊愈的机会,但由于肝癌的早期症状不明显,大部分患者就诊时已属于晚期,已失去手术治愈的时机。TACE疗效确切,可作为非手术治疗患者的首选。肝癌在生长的过程中,血供的需求迅速上升,新生血管形成的速度也就成了影响肝癌生长的关键因素,有研究还认为新生血管的形成是肿瘤转移的基础,因此在肿瘤进展的过程中,新生血管形成的重要性无可替代,在众多影响新生血管形成的细胞因子中,VEGF家族被认为是作用效果最强的血管生成促进因子[16]。TACE虽然可阻断肿瘤现有的血液供应,但由于形成了局部的缺血缺氧环境,在HIF和VEGF家族的作用下,血管生成得到加强,众多的新生血管构成了肿瘤的侧支循环,持续为肿瘤组织供血,这也可能是TACE治疗后肿瘤结节不能完全坏死的原因之一[17]。从VEGF的作用来看,VEGF能与VEGFR-2结合,使VEGFR-2末端发生自动磷酸化的变化,之后在特定位点形成各种信号分子,诱导毛细血管官腔样结构的形成,同时促进血管内皮细胞分裂增殖,发挥其丝裂原的作用[18]。MMP-9被认为是肿瘤转移的关键酶之一,同时在转移肿瘤的血管生成中也发挥了不可或缺的作用。MMP-9和VEGF双阳性的肝癌组织其微血管密度明显高于单阳性的肝癌组织,这意味着MMP-9和VEGF都具有促进肿瘤血管生成的作用,并且可能具有协同作用。鉴于TACE术后残余癌组织中VEGF、MMP-9高表达的特点,术后配合使用抗血管生成的靶向药物,减少或阻止新生血管形成,可能是提高TACE疗效的有效途径。
甲磺酸阿帕替尼是一种小分子靶向抗血管生成药物,分子量为493.58 kDa,其能够在阻断VEGF与VEGFR-2结合的同时也可对酪氨酸激酶产生轻度抑制作用,是我国自主研发的抗血管生成药物,在实际使用中取得了较好的临床效果[19]。阿帕替尼的作用主要包括以下几点:(1)抑制新生血管形成,这是通过抑制血管内皮细胞增殖来实现的。(2)促使免疫系统攻击肿瘤,由于VEGF会抑制树突状细胞(DC细胞)的分泌功能,而阿帕替尼可以阻断VEGF的作用,因此可以解除VEGF对DC细胞的抑制。(3)增加肿瘤细胞对铂类药物的敏感性,这与阿帕替尼抑制VEGFR-2下游的磷酸化激酶有关。TACE治疗后的缺血缺氧微环境会促使肿瘤组织高表达VEGF及相关因子,在缺血缺氧的阶段,肿瘤的生长减缓,对化疗药物的敏感性也降低,这与阿帕替尼的作用具有很密切的关系。阿帕替尼可以抑制新生血管形成,但对已成形的血管无法产生影响;TACE可以栓塞已有血管,但对新生血管无能为力,此两者相互配合可以有效地弥补各自的不足,互相增强,提高疗效。本研究结果表明TACE与阿帕替尼联合治疗中晚期肝癌的疗效更佳,加入阿帕替尼方案后,疾病控制率和总体生存率均得到了提高,这为二者联合应用治疗中晚期HCC患者提供了有力的证据。同时,本研究也证明了笔者对其机制的猜想,即两者在抗血管治疗上的协同作用;二者联合使用能显著降低血清中VEGF和MMP-9的表达水平,从而达到抑制肿瘤生长和转移的效果。另外,从患者生存率的对比结果来看,中晚期HCC患者从中获益更大。
综上,TACE联合甲磺酸阿帕替尼治疗中晚期HCC患者,对TACE的临床治疗效果有一定程度的提升,其机制是TACE使肿瘤血供减少同时甲磺酸阿帕替尼抑制肿瘤新生血管生成。

