基于细胞壁吸附固定特性的小飞蓬耐Cd 机制研究
张 虹 ,罗洁文 ,胡华英 ,曹 升 ,周垂帆 *,侯晓龙
(1.福建农林大学林学院,福州 350002;2.海峡两岸红壤区水土保持协同创新中心,福州 350002;3.福建长汀红壤丘陵生态系统国家定位观测研究站,福州 350002)
镉(Cd)是生物生长的非必需元素和毒性最强的重金属元素之一,土壤中的Cd可通过食物链逐级积累,对动植物和人体健康造成严重的危害。2014年发布的《全国土壤污染状况调查公报》[1]显示,Cd污染的点位超标率在所有无机污染物中最高,达到7%。因此,修复土壤Cd污染的任务已刻不容缓。植物修复因其技术与经济上的双重优势,在国内外重金属污染土壤的修复治理中已逐渐得到发展和应用。小飞蓬(Conyza canadensis)是一种广泛分布于世界各地的菊科草本植物,该植物适应性强、生长快、生物量大、耐干旱瘠薄、根蘖力强。有研究发现,小飞蓬对重金属Cd有很强的耐性和富集能力[2],在矿区天然生长的小飞蓬地上部分Cd含量可达38.30 mg·kg-1[3],生物富集系数的范围为0.594~4.790,高于普通植物富集系数,是我国Cd污染土壤生态恢复的先锋植物[2,4]。但是目前关于小飞蓬对重金属Cd的耐性和解毒机制研究鲜有报道。
细胞壁作为植物细胞特有的外层组织结构,是保护细胞原生质体不受外界污染物尤其是重金属毒害的第一道屏障。细胞壁的主要组成物质有纤维素、半纤维素、木质素、蛋白质和果胶等,并含有多种带负电荷有机基团,如氨基、羧基、羟基、巯基和醛基等[5],这些有机官能团能有效地结合重金属阳离子形成沉淀,从而将其固定在植物细胞壁中,阻止其进入细胞以减少对植物细胞内敏感细胞器的伤害[6],使植物对重金属产生一定的耐性。研究发现,植物细胞壁可以通过改变其组成物质的含量来抵抗重金属胁迫,并增强对重金属的吸附固定能力。Xiong等[7]经试验发现,施用氮氧化物可增加根细胞壁中半纤维素和果胶的含量,进而增加根细胞壁对Cd的吸附固定,使水稻对Cd的耐受性增强。另有学者[8]发现,Cd胁迫下,拟南芥细胞壁中木质素生物合成基因的表达量变多,从而减少了重金属离子对自身的伤害。Zhou等[9]通过透射电镜观察Cd胁迫下小飞蓬的叶细胞发现,有Cd2+沉淀积累在细胞壁表面及细胞壁内。但是关于在Cd2+吸附固定过程中小飞蓬根、叶细胞壁哪些组分、组分中哪些官能团起到了关键性作用等问题还有待进一步探究。
鉴于此,本文通过扫描电镜(SEM)研究了Cd在小飞蓬组织的分布规律和毒害效应,并利用细胞壁化学改性结合吸附动力学试验研究了小飞蓬根、叶细胞壁对Cd2+的吸附固定特性,同时通过傅里叶红外光谱表征了小飞蓬根、叶细胞壁上Cd2+吸附位点的特定组分或官能团信息,以期探究小飞蓬根、叶细胞壁在Cd吸收过程中发挥的作用,为研究Cd2+对植物的毒害作用和植物对Cd的耐性及解毒机制提供研究思路,也为小飞蓬应用于Cd污染土壤的修复和治理提供相关参考。
1 材料与方法
1.1 试验材料
小飞蓬于2016年3月15日采集于福建农林大学校园内,选择植株大小均一、根系完整、高度为15 cm左右的小飞蓬,利用清洁过的河沙种植于福建农林大学温室中,每隔2 d浇一次去离子水,保持田间持水量为70%。2周后,将其移至人工气候培养箱中进行Hoagland营养液胁迫培养[以CdCl2溶液形式加入,Cd浓度设置为0(对照CK)、50、100 μmol·L-1],昼夜温度为25℃和20℃,光照14 h。胁迫培养1周后,将根系放入25 mmol·L-1Na2-EDTA洗脱液中浸泡15 min以除去根系表面吸附的Cd,用超纯水将叶片和根系冲洗干净并擦干,液氮固定后存于-75℃冰箱中备用[10]。
1.2 研究方法
1.2.1 SEM分析样品的制备与观察
小飞蓬样品的制备与SEM观察参考朱宇恩等[11]的方法。取对照组和50 μmol·L-1Cd胁迫组的小飞蓬,用切片切取1 cm新生根的根尖和面积为1 cm2左右的叶片(避开叶脉),用磷酸缓冲液对其反复清洗,再将其置于2.5%的戊二酸溶液中固定2~24 h。在此期间加入适量Na2S(1%)溶液,使植物组织中的重金属凝结,再将固定好的植物样品用0.1 mol·L-1的磷酸缓冲液反复冲洗3~5次,经50%、70%、80%、90%、95%和100%的乙醇溶液逐级脱水,每次15 min。经冷冻干燥后切片镀金,采用S4800型扫描电镜,在5.0 kV的加速电压条件下完成观察并拍照[12]。
1.2.2 小飞蓬细胞壁提取分离与化学改性
小飞蓬细胞壁提取的操作步骤为:将不同Cd浓度(0、50、100 μmol·L-1Cd)处理的小飞蓬根、叶分别剪碎置于陶瓷研钵中,加入液氮研磨成粉末状。先加入75%的冰乙醇对粉末浸提20 min,再于5000g的转速下离心10 min,去上清液保留浸提物;在浸提物中依次加入1∶7(根重/体积)的冷丙酮、冷甲醇-三氯甲烷混合液(1∶1,V/V)和冷甲醇溶液再次浸提,离心20 min,去上清液,对剩余沉淀物进行冷冻干燥,于4℃冰箱密封保存备用[10],并参考徐劼等[5]的方法将对照组小飞蓬根系和叶片的细胞壁粉末进行酯化改性、果胶酶改性和氨基甲基化改性。
1.2.3 小飞蓬细胞壁Cd吸附动力学试验
参考武贝[13]的方法进行Cd吸附:分别称取0.05 g对照组未经处理和经改性后的小飞蓬根、叶细胞壁粉末,装入底部有滤纸的滤头内,滤头上下均连接导管,上导管泵入 5 mg·L-1CdCl2+0.01 mol·L-1NaNO3的吸附液,下导管用于连接自动收集器。吸附液用蠕动泵以5 mL·10 min-1流速泵入小管,经细胞壁后用自动收集器收集流出液,每10 min收集一管,直到流出液中Cd浓度与吸附液中相同,本试验约在400 min达到吸附平衡。用AAS(原子吸收光谱法)测定每管流出液中Cd2+浓度。试验重复3次,取平均值作图(为防止图中曲线不清晰,标准偏差未在图中标出,但均小于5%)。
1.2.4 小飞蓬细胞壁的傅里叶红外光谱(FTIR)表征
利用傅里叶红外光谱仪对Cd吸附前后的对照组未经处理和经改性后的小飞蓬根、叶细胞壁以及Cd胁迫处理后提取的小飞蓬根、叶片细胞壁进行红外光谱表征。分别称取1 mg样品粉末与150 mg KBr在玛瑙研钵中混匀充分研磨,经压片机制备成透明、均匀锭片后用FTIR(光谱分辨率为4 cm-1,扫描范围4000~400 cm-1)测定红外光谱图[14]。
混凝土桥面板分为预制部分和现浇部分,预制部分采用C50混凝土,现浇部分采用C50补偿收缩混凝土,预制板纵横梁均设置剪力键,在钢梁支撑处设置厚5mm的橡胶垫片。
1.3 统计分析
采用SPSS 19软件进行相关数据的统计,采用单因子方差分析(ANOVA),用SNK法进行数据组间的差异分析,显著性水平为α=0.05;采用Origin 8.5作图。
2 结果与分析
2.1 小飞蓬组织结构的SEM分析
利用SEM对小飞蓬叶片横切面(图1)进行观察发现,CK组的小飞蓬叶片表面光滑,清晰可辨,组织排列有序无破损、结构饱满、木质部和韧皮部轮廓分明。但在50 μmol·L-1Cd胁迫下,叶片组织发生明显的变化,组织结构形状不规则、排列无序杂乱、局部出现破损并形成一些碎片,木质部和韧皮部畸形,皮层增厚,导管中出现大量晶体,并堵塞导管。
从小飞蓬根系横截面图(图2)可以看出,CK组的小飞蓬根系组织结构完整、形状规则、排列整齐,根系皮层、木质部、韧皮部以及凯氏带等部位轮廓清晰易于分辨,切面的组织结构表面平整且无杂质。但在50 μmol·L-1Cd胁迫下,组织结构排序混乱、结构受损而失去完整性;相邻细胞间的连接壁破裂、凯氏带部分断裂,难以识别;木质部、韧皮部畸形,不易于区分;皮层细胞收缩、失去弹性且皮层增厚;细胞间出现大量晶体,并有晶体堵塞在导管中。
2.2 对照组小飞蓬细胞壁化学改性前后红外光谱分析

图1 不同处理下的小飞蓬叶片组织扫描电镜图Figure 1 SEM analysis of leaf tissue of Conyza canadensis under different treatments

图2 不同处理下的小飞蓬根系组织扫描电镜图Figure 2 SEM analysis of root tissue of Conyza canadensis under different treatments

图3 小飞蓬根、叶细胞壁改性前后傅里叶光谱Figure 3 The FTIR spectra of the root and leaf cell wall of Conyza canadensis before and after chemical modification
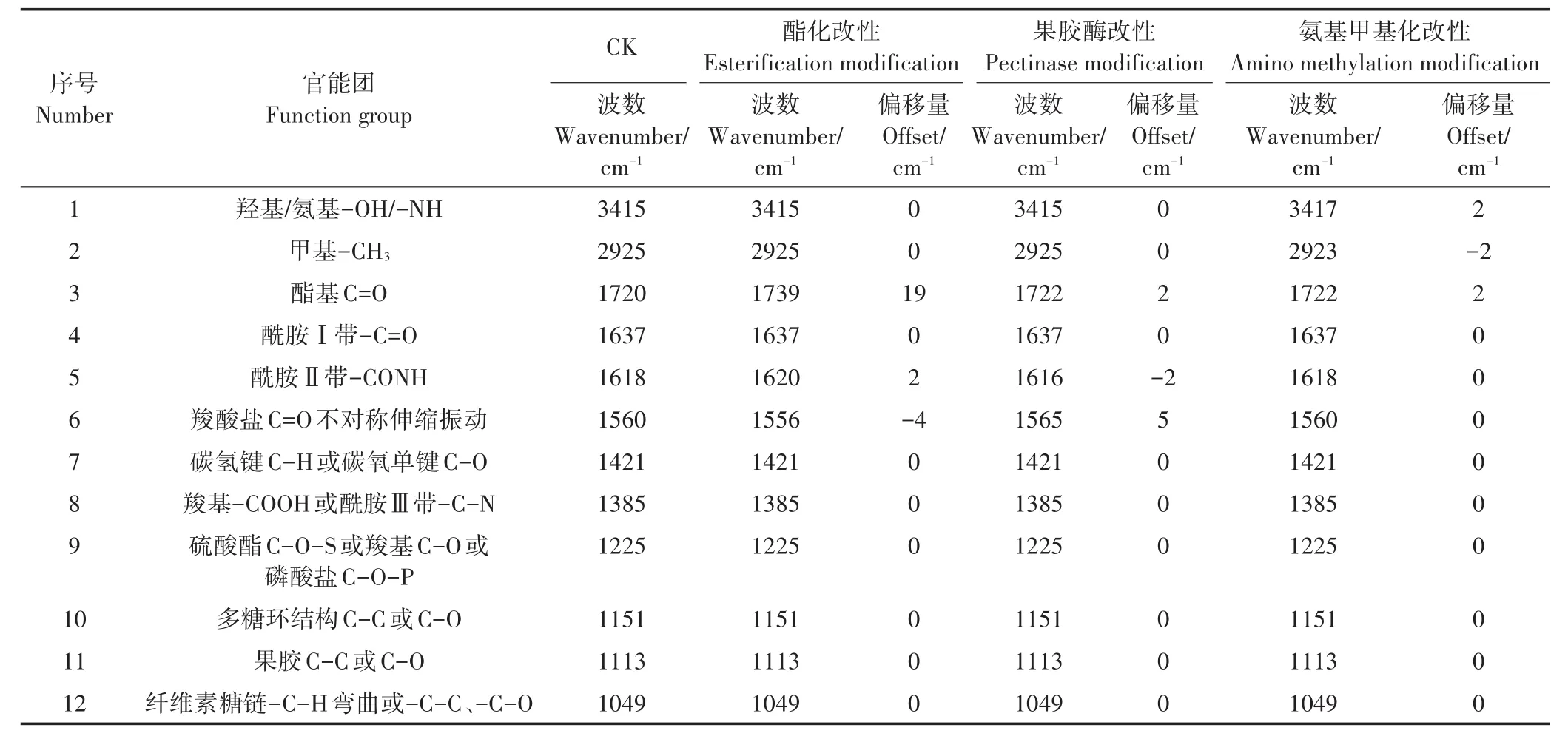
表1 小飞蓬根细胞壁改性前后傅里叶光谱分析Table 1 Analysis of FTIR spectra of the root cell wall of Conyza canadensis before and after chemical modification
对改性前后对照组小飞蓬细胞壁的红外光谱图(图3)进行解析,得到细胞壁在化学改性前后官能团变化的信息(表1、表2)。小飞蓬根细胞壁经酯化改性后,酯羰基(C=O)的伸缩振动峰由1720 cm-1向高频移动至1739 cm-1,且峰强也明显高于未经处理的细胞壁;小飞蓬叶细胞壁未经酯化改性前,1730 cm-1处无明显峰值,经改性后,该处峰强明显高于未经处理的细胞壁。此外,小飞蓬根细胞壁1560 cm-1处及叶细胞壁1565 cm-1处附近的羧酸盐C=O不对称伸缩振动吸收峰均增强并向低频移动,1151 cm-1处的C-O伸缩振动吸收峰峰值增强,以上特征峰值的变化均表明羧基酯化改性成功。
果胶酶改性后,氨基的-CONH(酰胺Ⅱ带)向低频移动,表明已去除蛋白质中的果胶;小飞蓬根细胞壁1560 cm-1处的伸缩振动吸收峰与未改性的细胞壁相比有所降低并向高频移动,说明已去除部分酸性果胶基团,同样的,小飞蓬叶细胞壁1560 cm-1处吸收峰峰值也有明显的下降;另外,小飞蓬根细胞壁1113 cm-1处吸收峰减弱,该部分的果胶C-C或C-O被去除,而叶细胞壁3410 cm-1处的羧基伸缩振动吸收峰与未改性的细胞壁相比峰形明显变窄,以上结果均说明果胶酶改性成功。
在氨基甲基化改性后的小飞蓬根细胞壁红外光谱图(图3)中,1637 cm-1和1618 cm-1处-C=O(酰胺Ⅰ带)和-CONH(酰胺Ⅱ带)吸收峰的峰高与未改性时相比有所降低,且小飞蓬根细胞壁3417 cm-1处的-NH特征峰向高频移动,这表明经氨基甲基化改性处理后细胞壁上的N-H基团减少。除此之外,小飞蓬根、叶细胞壁的-CH3特征峰向高频移动,且1385 cm-1处的峰值有所增强,并在1338 cm-1出现新的峰值,说明经改性后的甲基峰振动增强,反映出氨基甲基化改性成功。

表2 小飞蓬叶细胞壁改性前后傅里叶光谱分析Table 2 Analysis of FTIR spectra of the leaf cell wall of Conyza canadensis before and after chemical modification
2.3 对照组小飞蓬细胞壁对Cd吸附动力学及吸附位点研究
在吸附初期,对照组未经处理和经化学改性的小飞蓬根细胞壁对Cd的吸附速率均较快,且吸附量随着时间的增加而逐渐增加,但增加速度逐渐减慢。由图4A可知,经400 min的吸附后,未经处理的根细胞壁对Cd的吸附量并未达到饱和,仍有吸附的潜力;小飞蓬根细胞壁经酯化改性后其对Cd的吸附量相对降低了49.1%,其次是经氨基甲基化改性后相对降低了38.5%,而经果胶酶改性后相对降低了26.1%,由此可见,小飞蓬根细胞壁上的羧基和氨基是Cd吸附作用中的主要官能团。未经处理的叶细胞壁对Cd的吸附量高于根细胞壁的吸附量,在吸附的初期吸附速率快,且到后期仍保持较高的吸附速率,经400 min的吸附后,未经处理的根细胞壁对Cd的吸附未达到饱和,其吸附加速度缓慢下降,吸附量仍保持上升趋势(图4B);小飞蓬叶细胞壁经酯化改性后对Cd的吸附量相对降低了39.47%,其次是果胶酶改性,相对降低了30.23%,而氨基甲基化改性后相对降低了20.14%。其吸附位点与根细胞壁有不同之处,叶细胞壁上的羧基和果胶在Cd吸附中的作用较明显。
2.4 对照组小飞蓬细胞壁吸附Cd前后红外光谱分析

图4 化学改性对对照组小飞蓬根、叶细胞壁吸附Cd的影响Figure 4 Effects of chemical modification on Cd adsorption in the root and leaf cell wall(CK)of Conyza canadensis
由表4可知,小飞蓬叶细胞壁吸附Cd后,-C=O(酰胺Ⅰ带)、羧酸盐C=O不对称伸缩振动和纤维素弯曲振动多糖糖链C-C键向低频移动,且其峰强明显增大,说明蛋白质、羧酸盐和纤维素等参与了Cd的吸附;与小飞蓬根细胞壁相似的是,酯基、硫酸酯C-O-S、多糖环结构和果胶C-C等特征峰的峰强也有明显的增强。吸附Cd后叶细胞壁硫酸酯化程度增加,说明硫酸酯参与了与Cd的结合,此外,羧基、果胶质等物质也发挥了重要的作用。
2.5 Cd胁迫下小飞蓬细胞壁吸附Cd的红外光谱分析
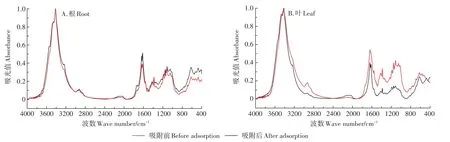
图5 对照组小飞蓬根、叶细胞壁Cd吸附前后红外光谱图Figure 5 The FTIR spectra of the root and leaf cell wall(CK)of Conyza canadensis before and after Cd adsorption
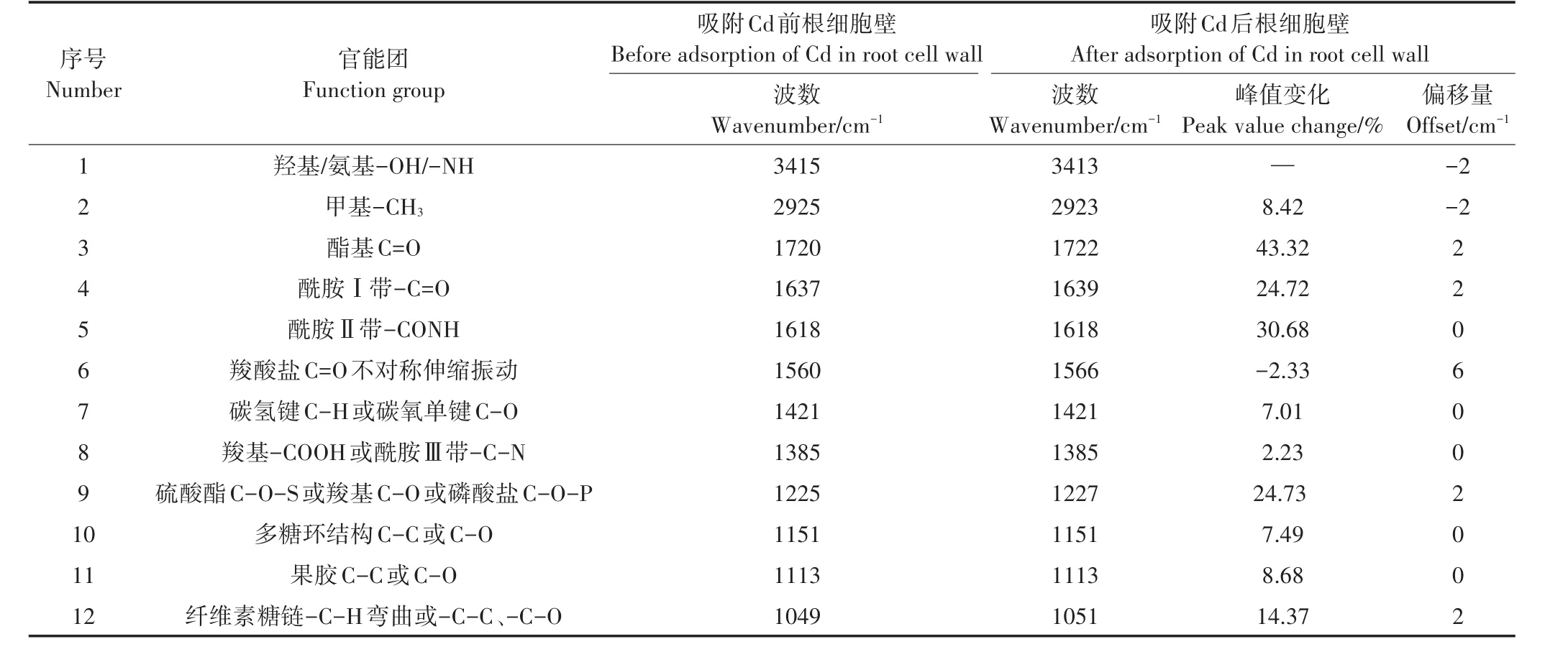
表3 对照组小飞蓬根细胞壁Cd吸附前后红外光谱分析Table 3 Analysis of FTIR spectra of the root cell wall(CK)of Conyza canadensis before and after Cd adsorption

表4 对照组小飞蓬叶细胞壁Cd吸附前后红外光谱分析Table 4 Analysis of FTIR spectra of the leaf cell wall(CK)of Conyza canadensis before and after Cd adsorption
利用FTIR进行表征胁迫处理对照组的小飞蓬根细胞壁后,结合图6A和表5可知,Cd胁迫后3415 cm-1处的-OH特征吸收峰峰形变宽,并向高频位移,位移的程度随Cd浓度的增加而增大,这是因为Cd的吸附导致根细胞壁上有大量的Cd2+存在,根细胞壁上的-OH官能团与Cd发生了明显的交互作用,可能是受到胁迫的小飞蓬根细胞壁为维持自身的稳态而生成更多的-OH,因而峰形变宽。而向低频位移的-CONH(酰胺Ⅱ带)和羧酸盐C=O不对称伸缩振动主要归属为蛋白质和果胶质糖醛酸中的羧酸根离子。由表5可以看出,Cd的胁迫使各特征峰的峰值有所增加,但是随着浓度的增加,1720、1225、1151、1113、1049 cm-1处的吸收峰峰强有较为明显的下降,说明应对不同浓度的Cd胁迫,小飞蓬根细胞壁的响应机制有所不同。
由图6B和表6可以看出,Cd胁迫后的小飞蓬叶细胞壁与对照组相比,各特征峰的吸光值都有较为明显的上升,说明Cd胁迫破坏了植物本身的稳态,且随着Cd浓度的增加各特征峰的峰强也增强。低浓度Cd胁迫(50 μmol·L-1Cd)时,-C=O(酰胺Ⅰ带)和羧酸盐C=O不对称伸缩振动向低频移动,但高浓度Cd胁迫(100 μmol·L-1Cd)下C=O则向高频移动,说明小飞蓬在应对Cd胁迫时通过调节果胶质的含量来调节内在的平衡,而3415 cm-1处的-OH/-NH特征峰峰形变宽并向高频移动,同时,纤维素糖链处特征峰和1419 cm-1附近的吸收峰也向高频移动,此处可能是由C-H伸展和C-O弯曲振动产生的,说明羧基、氨基以及羟基等均参与到Cd吸附的过程中。高Cd浓度处理下,-C=O(酰胺Ⅰ带)和纤维素弯曲振动多糖链向低频移动,-C=O(酰胺Ⅰ带)特征峰峰形变宽,说明此时小飞蓬叶片中的纤维素和蛋白质在吸收Cd的过程中发挥了重要的作用。
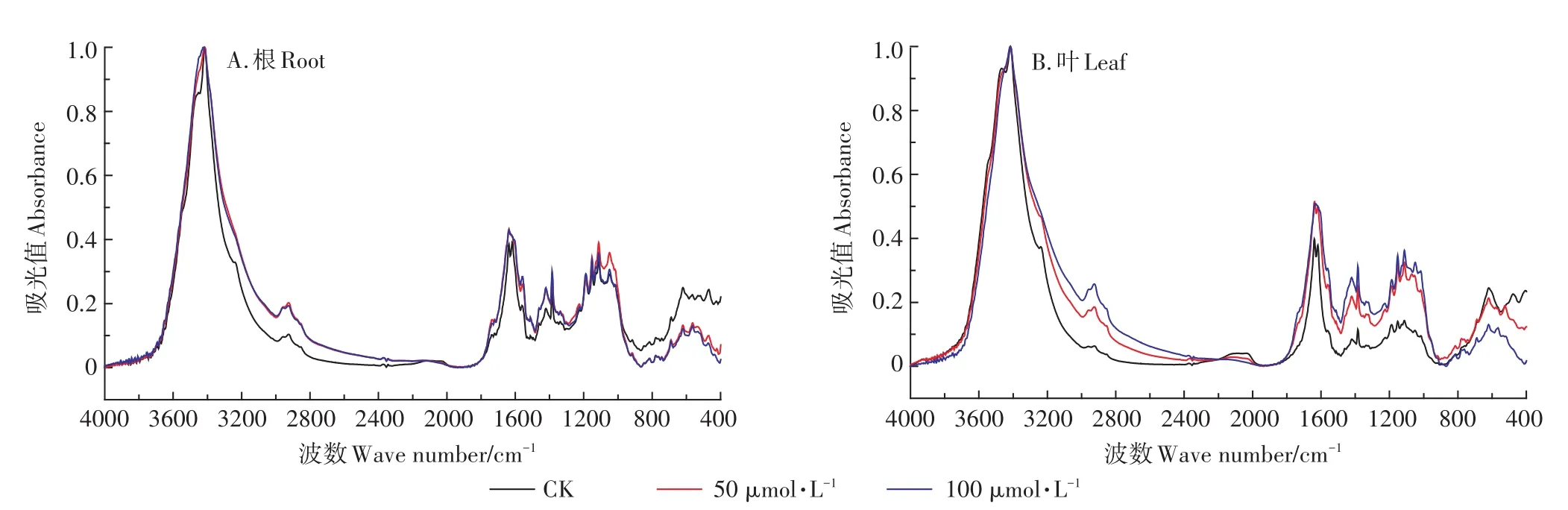
图6 对照与不同Cd处理下小飞蓬根、叶细胞壁的红外光谱表征Figure 6 The FTIR spectra of the root and leaf cell wall of Conyza canadensis under different Cd treatments

表5 对照与不同Cd处理下小飞蓬根细胞壁的红外光谱数据分析Table 5 Analysis of FTIR spectra of the root cell wall of Conyza canadensis under different Cd treatments
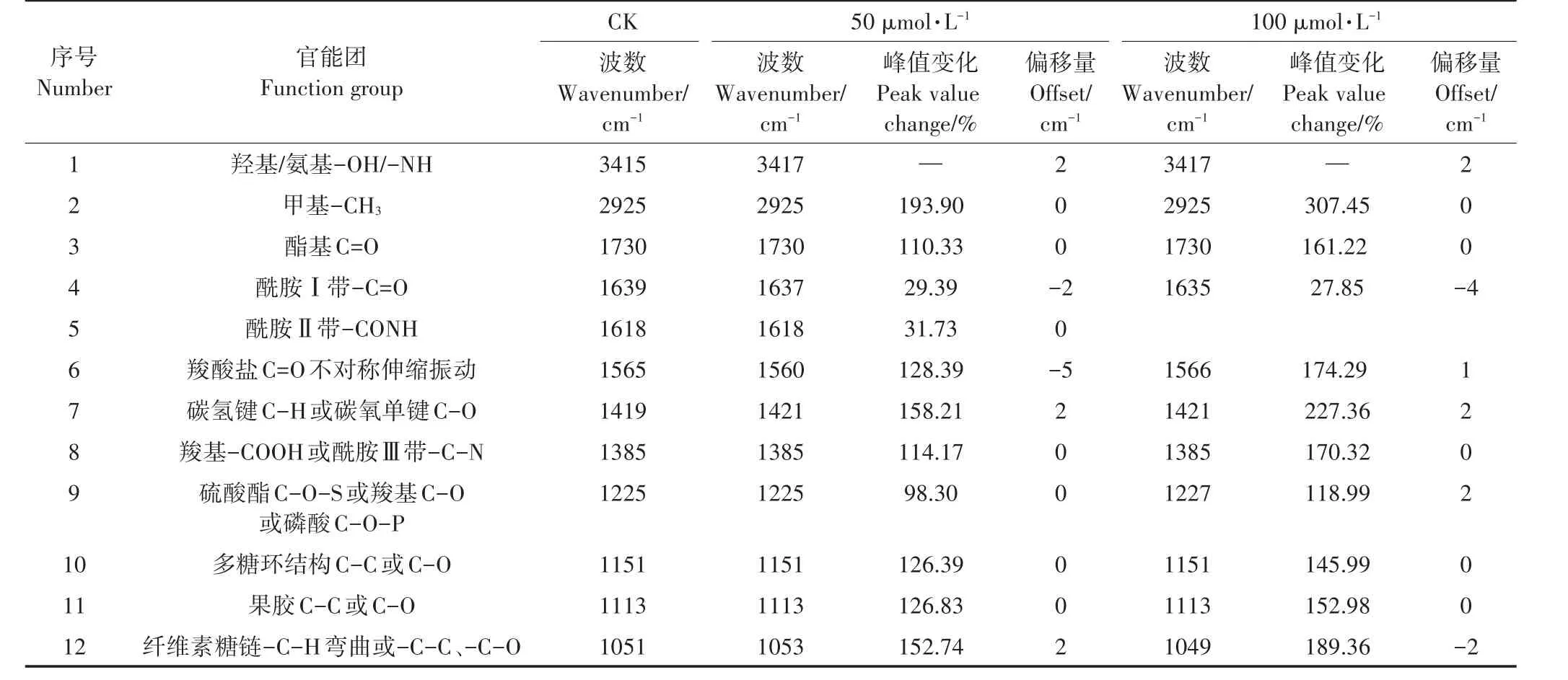
表6 对照与不同Cd处理下小飞蓬叶细胞壁的红外光谱数据分析Table 6 Analysis of FTIR spectra of the leaf cell wall of Conyza canadensis under different Cd treatments
3 讨论
3.1 Cd对小飞蓬组织结构的毒害效应
Cd是一种高危的有毒物质,仅微量就会对植物、动物乃至人体健康有严重的毒害作用。在试验中,经过7 d的100 μmol·L-1Cd胁迫后,小飞蓬靠近根部的叶片出现枯萎,部分新叶颜色发黄、叶尖干枯,部分叶片上出现黄黑色的斑点,部分根系颜色变深甚至发黑,这些症状均说明小飞蓬受到了明显的Cd毒害。经过SEM观察后发现,Cd胁迫下小飞蓬根系和叶片组织中均发生结构混乱,出现形状不规则、皮层增厚及形成晶体等现象,说明Cd进入植物细胞时,植物首先将其阻隔在细胞壁,重金属离子与细胞壁内的物质形成晶体固定在外皮层和内皮层组织中,有效减少其向木质部、韧皮部等中柱组织内迁移,从而减少植物其他细胞器中的游离重金属,而中柱组织是植物运输水分和养分的重要部位[15],因此能够在不同程度上降低重金属对小飞蓬的毒害作用,但是与对照相比,小飞蓬根、叶组织出现明显的损伤,部分多余的Cd被沉积在小飞蓬根、叶的中柱组织。在以往的研究中,Chen等[16]利用扫描电镜对棉花(Gossypium hirsutumL.)的根叶组织进行分析后发现,根皮层和次生韧皮部以及叶上皮层的薄壁组织在Cd吸收固定中起着重要的作用。Liu等[17]利用能量色散X射线技术观察洋葱(Allium cepa)的根部细胞组织,发现Cd主要分布在邻近表皮的皮层组织和薄壁组织中。因此,大量的Cd吸附固定于皮层组织,是小飞蓬耐重金属Cd的重要机制之一。
3.2 小飞蓬细胞壁的Cd吸附位点
植物细胞壁是植物生长发育及应对各种逆境胁迫的重要器官,通过区隔机制和适应机制在植物抵御重金属毒害方面起重要作用[18]。细胞壁中含有羟基、羧基和氨基等主要基团,它们可与重金属阳离子结合,从而降低重金属对植物的毒害。但是不同植物的细胞壁组分对不同重金属的吸附或络合等过程的贡献及其机制存在差异性。试验发现,小飞蓬细胞壁经过不同改性后对Cd的吸收量均有降低,叶细胞壁中吸附固定Cd的含量高于根系,按照降低量从高到低:根细胞壁为酯化改性>氨基甲基化改性>果胶酶改性;叶细胞壁为酯化改性>果胶酶改性>氨基甲基化改性。酯化改性主要让细胞壁中的羧基与外来物的羟基发生酯化反应,减少小飞蓬细胞壁上的羧基,考察羧基在细胞壁上与重金属吸附的能力。试验中,小飞蓬根、叶细胞壁中的羧基在与重金属的吸附中起着重要作用,徐劼等[14]的研究同样发现,酯化改性处理后的细胞壁对重金属Cd的吸附能力明显降低,较对照降低了42.6%。Clemens等[19]通过降低甲基酯化程度,增加自由羧基的含量,从而增加了植物根细胞壁上Cd2+的吸附位点,导致对Cd2+的吸附固定增多。
果胶质是植物细胞壁中带负电的生物相组分,也是重金属的主要结合位点,其主要包括同聚半乳糖醛酸聚糖(HG)、Ⅰ型鼠李半乳糖醛酸聚糖(RGⅠ)和Ⅱ型鼠李半乳糖醛酸聚糖(RGⅡ)[20],这些多糖类物质极易与重金属阳离子结合。在试验中,小飞蓬根、叶细胞壁经果胶酶改性后对Cd的吸附量较对照分别降低了26.17%和30.23%,因此果胶也是小飞蓬吸附Cd的重要位点。与此类似的是,Douchiche等[21]通过调节亚麻幼苗同聚半乳糖醛酸聚糖的甲基酯化模式,使果胶结构发生改变,从而对细胞壁吸附固定Cd的能力产生影响。Krzesłowska等[22]的研究发现,Pb胁迫导致葫芦藓(Funaria hygrometrica)的根细胞壁加厚,果胶含量增加并将Pb固定在细胞壁上,有效抵御了Pb的胁迫。以上说明果胶在细胞壁吸附重金属的过程中有一定的作用。
氨基甲基化改性去除细胞壁中的氨基后发现,小飞蓬根、叶细胞壁Cd的吸附量分别降低了38.5%和20.14%,说明氨基基团在一定程度上参与了小飞蓬细胞壁吸附Cd的过程,但并不是主要的官能团。王梦等[23]的研究中发现氨基也是茶树(Camellia sinensisL.)根细胞壁在Pb吸附时的官能团之一,但并非主要官能团。但Gardea-Torresdey等[24]的研究则发现,紫花苜蓿(Medicago sativa)组织细胞壁上氨基在Au(Ⅲ)的吸附过程中起主要作用。因此,细胞壁组分及官能团在吸附重金属的过程中随植物种类、重金属类型等条件的变化而产生差异。此外,Kulczycki等[25]对两种细胞壁结构不同的细菌进行吸附Cd试验,结果显示这两种细菌对Cd有非常相似的吸附性,说明两种细菌的吸附特性取决于细胞壁聚合物间的化学反应,而与细胞壁物理大分子结构无关。但是目前国内外关于植物细胞壁结构特征(纤维素的结晶度、半纤维素的分支度和木质素的单体等)对Cd吸附是否有影响的研究十分罕见,在今后的试验中可从这方面对小飞蓬进行进一步研究,为探究小飞蓬细胞壁在Cd吸附中的作用机制提供重要信息和新的研究方法。
3.3 小飞蓬细胞壁改性前后的红外光谱定性分析
FTIR图谱中植物细胞壁各组分及官能团在与重金属结合前后所对应吸收峰的变化,可以表征其在重金属吸附过程中的作用。在此试验中,3415 cm-1处附近的-OH特征峰峰形变宽,吸收峰向低频移动,说明Cd处理导致小飞蓬根细胞壁上的羟基官能团参与了与Cd的络合,而-OH主要源于纤维素、半纤维素和果胶等[26],说明纤维素和果胶等对Cd的化学吸附发挥了一定的作用。1720 cm-1处附近的峰是酯化果胶中酯基的伸缩振动吸收峰[27],Cd处理导致该处特征峰向高频位移,峰值增加,说明了在Cd的胁迫下小飞蓬细胞壁中果胶质甲基酯化程度下降,从而增加了羧基的数量,说明Cd主要是与小飞蓬细胞壁果胶中的羧基官能团结合。这与Renault等[28]的试验结果相似,他们研究发现,拟南芥(Arabidopsis)根细胞壁在盐胁迫后与对照相比,1770 cm-1特征峰峰值增加,向高频位移,通过验证后发现,拟南芥根细胞壁果胶中的羧基是盐胁迫中起主要作用的官能团之一。
另外,本试验发现,Cd胁迫有可能诱导了小飞蓬细胞壁分泌和合成氨基酸、蛋白质和多肽类物质,小飞蓬叶细胞壁的酰胺Ⅰ带(-C=O)和根细胞壁的酰胺Ⅱ带(-CONH)的峰值增强,并向低频发生位移,且光谱强度随着Cd浓度的增加呈现升高的趋势。这与Wei等[29]的研究结果类似,在15 mg·L-1Cd胁迫下,苜蓿叶在酰胺Ⅰ带和Ⅱ带的吸收峰发生位移,表明Cd胁迫可影响蛋白质的合成或使蛋白质结构发生改变。重金属胁迫促进了植物细胞壁分泌氨基酸、多肽和蛋白质类物质,这些物质可能作为Cd的运输载体与Cd发生络合作用,从而减轻了Cd对植物的毒害作用。但是有学者研究发现,果灰藓(Hypnum fertile)可溶性蛋白质和糖类含量随Cd胁迫强度的增加呈先上升后下降的趋势[30]。当重金属胁迫的浓度处于植物耐性范围内时,植物会通过蛋白质、脂类和碳水化合物的代谢对胁迫作出响应,保持蛋白质二级结构稳定,抵御重金属的毒害。此外,分布于红外光谱900~1200 cm-1(糖链的特征峰带)的是多糖信息的指纹区,本试验发现在此区域内的纤维素糖链-C-H弯曲或-C-C、-C-O的伸缩振动峰、果胶C-C或C-O、多糖环结构C-C或C-O的伸缩振动峰的强度降低并发生位移。在重金属的胁迫下,小飞蓬细胞壁也会诱导合成一些纤维素、果胶、碳水化合物等多糖类物质,提高了植物对Cd的耐性及细胞壁对Cd的吸附固定能力,缓解了Cd对植物的毒害作用。但是不同浓度的Cd胁迫下,该处特征峰的峰强随浓度的增加而降低,50 μmol·L-1的Cd更容易促进小飞蓬细胞壁纤维素等多糖的增加,与重金属络合并阻碍Cd进入细胞中。王成等[31]的研究发现,构树(Broussonetia papyriferaL.)幼苗叶片的FTIR光谱中多糖物质所在的吸收峰的强度随Cd胁迫浓度的增加而增加,表明构树幼苗叶片通过合成更多的纤维素、果胶和碳水化合物等成分来响应Cd胁迫强度的增加。在Cd胁迫试验中发现,小飞蓬在50 μmol·L-1Cd胁迫处理时出现了生长不良的现象,而在100 μmol·L-1时植株生长受到明显的抑制,甚至出现枯萎的现象,高浓度Cd胁迫严重影响了植物体内的新陈代谢机能和植株健康,说明小飞蓬细胞壁通过调节羧基、羟基、氨基的含量,合成或代谢脂类、果胶、蛋白质、多糖等物质使其在一定的重金属浓度范围内表现出耐性。
4 结论
(1)在Cd胁迫下,小飞蓬将进入其根、叶组织内的Cd合成颗粒状晶体,皮层组织是小飞蓬吸附固定Cd的重要部位,有效降低了Cd对组织结构的毒害作用,保证其进行正常的营养物质吸收和水分运输。
(2)经化学改性后,小飞蓬根、叶细胞壁对Cd的吸附量均有不同程度的降低,其中,根细胞壁上起主要作用的官能团是羧基和氨基,而叶细胞壁上羧基和果胶的作用较突出。
(3)在Cd胁迫下,小飞蓬根、叶细胞壁通过改变各化学组分的含量来调节其趋向有利的稳定的状态;小飞蓬根、叶细胞壁中的羟基、羧基和氨基是Cd的主要结合位点。小飞蓬根、叶细胞壁及其各组分对Cd具有较高的吸附固定能力,是小飞蓬对Cd的耐性及解毒的一种重要机制。

