野生黑枸杞果实中酚类物质的组成分析
赵 旭,王新茹,段长青,何 非,*
(1.中国农业大学食品科学与营养工程学院,葡萄与葡萄酒研究中心,北京 100083;2.农业农村部葡萄酒加工重点实验室,北京 100083;3.宁夏雄牛酒业有限公司,宁夏 银川 750200)
黑枸杞,也称黑果枸杞(Lycium ruthenicum Murr.),为茄科(Solanceae)枸杞属(Lycium L.)棘刺灌木,耐干旱,抗盐碱,主要分布于我国青海、宁夏、新疆、甘肃等地高山沙林地区,在欧洲和中亚地区也有少量分布[1]。过去,因为分布较分散、生长环境恶劣、不易采集等问题而少为人知,相关产业发展也极其有限。近年来,随着人工栽培技术的进步和政府的大力扶持,黑枸杞凭借其浆果味美多汁、营养丰富、保健功能众多等优势逐渐成为我国西部最具特色的果品之一,随之开展了一系列相关专业研究。有研究表明,黑枸杞富含人体必需的18 种氨基酸和K、Na、Fe等人体必需的矿质元素[2-3],其在生长过程中大量积累的枸杞多糖、酚类物质等成分也对人体起到十分积极的保健功效[4],因此在当地被称作“黑色的软黄金”,其食用价值和药用价值相当可观,具备广阔的开发前景。
酚类物质是黑枸杞果实中最主要的功能性成分之一。与成熟后呈红色的中华枸杞(L. chinense Mill.)果实不同,黑枸杞的果实在成熟后呈现紫黑色,这主要是由其果实中大量积累的花色苷造成的,有报道称其花色苷含量最高可达386.9 mg/100 g(以鲜质量计算),其含量超过越橘、黑加仑、桑葚、蓝莓、黑莓等常见的红色或黑色浆果[5]。目前,国内外已经有大量研究关注花色苷对人体的保健功能,如抗氧化、抗癌变、保护人体神经细胞[6]、预防心血管疾病[7]。黑枸杞果实所富含的花色苷成分也成为其作为保健果品,或作为保健食品原材料的物质基础。除此之外,黑枸杞果实还含有丰富的非花色苷酚类物质,这往往是目前大量保健功能研究所忽略的。这些物质虽然没有艳丽的颜色,但一样对人体保健起着重要的功能。例如,苯甲酸、肉桂酸、黄酮醇和黄烷醇类物质,虽然大多有酸、苦的味觉和涩的口感,但均有着广泛的生物活性,对人体也有着抗氧化、抗肿瘤[8]、抗菌[9]等作用。
到目前为止,对黑枸杞果实中酚类物质组成和含量的研究还比较有限,大部分已发表研究仅专注于对黑枸杞果实中酚类物质提取方法的探索或是对其总酚含量的一般性化学分析,至今仍缺少对黑枸杞果实中酚类物质系统性的分析和研究。本研究以产自宁夏的野生黑枸杞新鲜果实为实验材料,采用高效液相色谱-三重四极杆串联质谱(high performance liquid chromatographytriple-quadrupole tandem mass spectrometry,HPLCQqQ-MS/MS)联用技术对黑枸杞果实中酚类物质进行系统的定性、定量分析,可以为黑枸杞果实品质改进、产品的后续研究与真伪鉴定提供一定的理论和实践基础,为我国西部黑枸杞产业持续、健康的发展提供有效的助力。
1 材料与方法
1.1 材料与试剂
野生黑枸杞新鲜果实样品采集于宁夏回族自治区中宁县红梧山产区。其黑枸杞系红梧山区野生黑枸杞品种,经人工移栽至当地山间平原地区,并通过扦插等手段无性扩繁而来,暂命名该品种为‘野之中’,目前正在进行品种审定。挂果黑枸杞植株定植于2013年,其株行距为1 m×2.5 m,通过滴灌系统进行灌溉,其产量控制为200~250 kg/亩,商业采收期于10月中下旬,采收期可溶性固形物15~16 °Brix,可滴定酸(以酒石酸计)5 g/L。本研究在其商业采收期,由不同地块、10 株以上不同黑枸杞植株、树体不同部位上摘取300 粒以上发育正常、无机械损伤、无病虫害侵害的枸杞果粒,以此取样重复3 次,共采集900 粒以上黑枸杞果实,以此获取黑枸杞果实样品。
花色苷标准品,包括花青素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷等;非花色苷酚类物质标准品,包括绿原酸、原儿茶酸、4-羟基苯甲酸、4-羟基肉桂酸、咖啡酸、芥子酸、阿魏酸、槲皮素美国Sigma-Aidrich公司。
1.2 仪器与设备
1200系列HPLC-6410系列QqQ-MS/MS联用仪(配有G1322A真空脱气机、G1312B二元高压梯度泵、G1367C自动进样器、G1316B柱温箱、G1314C VWD检测器)、Poroshell 120 EC-C18色谱柱(150 mm×2.1 mm,2.7 μm)美国安捷伦科技有限公司;SG3200HBT超声波清洗机上海冠特超声仪器有限公司;FD-1A-50冷冻干燥机北京必瑞克生物科技有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;Sorvall ST 16R高速冷冻离心机 美国Thermo Fisher Scientific公司;一次性使用无菌注射器(1 mL) 上海治宇医疗器械有限公司;一次性孔径0.22 μm尼龙66微孔滤膜 天津市津腾有限公司。
1.3 方法
1.3.1 酚类物质的提取
随机称取50 g(>100 粒果)新鲜采集的黑枸杞果实,经液氮速冻后破碎、研磨为粉末状,通过冷冻干燥制成干粉,-40 ℃贮存待用。
黑枸杞果实中酚类物质的提取参考Downey等[10]的方法,并进行一定的改进。
花色苷的提取:准确称取0.100 g制备的黑枸杞果实干粉于2 mL离心管中,加入2.0 mL含1%盐酸的50%甲醇溶液,4 ℃避光超声提取30 min,随即4 ℃、12 000 r/min离心5 min,将上清液转移到10 mL的离心管中,重复上述操作5 次至萃取沉淀物基本无色,合并上清液并将其冻干,用含1%盐酸的50%甲醇溶液定容至2 mL,检测前用0.22 μm针头过滤器过滤,取过滤液待测。
非花色苷酚类物质的提取:准确称取5.000 g制备的黑枸杞果实干粉于锥形瓶中,加入5 mL蒸馏水和 45 mL乙酸乙酯,4 ℃避光200 r/min摇床振荡30 min,转移上清液于250 mL圆底烧瓶中,重复以上操作5 次,合并上清液于圆底烧瓶中,低温真空旋蒸至干,用甲醇定容至5 mL,检测之前用0.22 μm针头过滤器过滤,取过滤液待测。
1.3.2 酚类物质的检测
1.3.2.1 花色苷的HPLC-QqQ-MS/MS检测
色谱条件:色谱柱为安捷伦Poroshell 120 EC-C18色谱柱(150 mm×2.1 mm,2.7 μm)。样品测定前经0.22 μm滤膜过滤,进样量5 μL。洗脱采用的流动相:A为0.1%甲酸溶液,B为含0.1%甲酸的50%甲醇-乙腈溶液。洗脱程序:10%~100%的B相持续20 min,后运行程序5 min。流动相流速为0.4 mL/min。柱温箱温度55 ℃。
质谱条件:电喷雾电离源,正离子模式,喷雾电压4 kV,离子源温度150 ℃,干燥气温度350 ℃,流量12 L/h,雾化器压力35 psi;多反应监测模式检测。
1.3.2.2 非花色苷酚类物质的检测
实验所采用的液相系统和质谱系统与花色苷及其衍生物的检测相同,离子源参数除了采用负离子模式外其余参数均与花色苷及其衍生物的检测相同。
1.4 数据处理
酚类物质的定性结合本实验室所建立的各种酚类物质的质谱信息、光谱信息以及保留时间信息库。采用外标法定量,各花色苷及其衍生物含量均以含有相同花色素基元的-3-O-葡萄糖苷单体标准品的含量计算,各非花色苷酚的含量均以相应的非花色苷酚标准品的含量计算,各酚类物质标准曲线的相关系数均在0.999 7~0.999 9之间,表明各酚类物质在质量浓度范围内线性关系较好。
以果实鲜质量计算酚类物质含量,计算公式如下:

式中:C为酚类物质重含量/(mg/kg);d为提取液中相应物质质量浓度/(mg/L);V为提取所用溶液体积/mL;mt为冻干后所得干粉总质量/g;me为提取所用干粉质量/g;mf为冻干前果实鲜质量/kg。
数据统计与作图通过Excel 2016软件完成。
2 结果与分析
2.1 黑枸杞果实中花色苷的靶标定性、定量分析
通过本课题组建立的植物常见花色苷母离子谱库和经过碰撞诱导裂解产生的碎片离子谱库[11],共从黑枸杞果实中靶标性鉴定得到花色苷类成分20 种,按糖苷及其修饰类型分为5 大类。其中,3-O-单葡萄糖苷类花色苷仅2 种,6-O-乙酰化衍生的3-O-单葡萄糖苷类花色苷5 种,6-O-香豆酰化衍生的3-O-单葡萄糖苷类花色苷5 种,3,5-O-双葡萄糖苷类花色苷4 种,6-O-香豆酰化衍生的3,5-O-双葡萄糖苷类花色苷4 种,不同花色苷成分的液相色谱与质谱信息,及其在黑枸杞果实中的含量测定结果如表1所示。
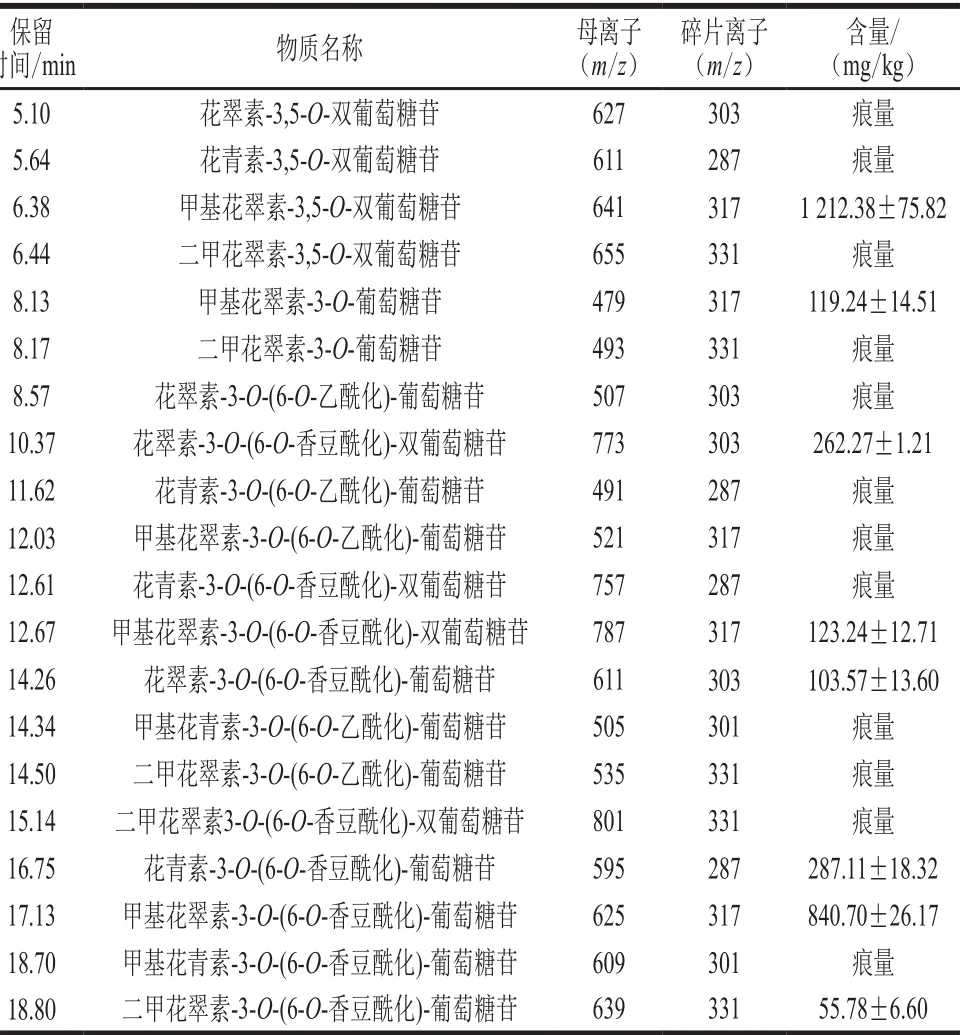
表 1 黑枸杞果实中20 种花色苷的靶标定性、定量检测Table 1 Qualitative and quantitative analysis of 20 anthocyanins in black wolfberries
除3-O-单葡萄糖苷类花色苷,黑枸杞果实中也检测到3,5-O-双葡萄糖苷类花色苷,这也是与许多非欧亚种(non-Vitis vinifera)野生种葡萄等多种红、黑色浆果类水果果实中花色苷的合成与积累相类似的,说明黑枸杞具备较古老且较全面的花色苷生物合成路径。然而,黑枸杞果实中简单的3-O-单葡萄糖苷类花色苷种类极少,仅存在2 种,而3,5-O-双葡萄糖苷类花色苷则有4 种,在对应的3-O-单葡萄糖苷类花色苷之外多了2 种,说明黑枸杞果实5-O-糖苷转移酶具有较高的活性,连同花色苷酰基转移酶的作用,甚至可将其部分3-O-单葡萄糖苷类花色苷底物使用殆尽,而无法检测到。
相应的,黑枸杞果实中生成的单糖苷花色苷和双糖苷花色苷也都可以经历后续的酰基化修饰,特别是6-O-香豆酰化,无论是单糖苷花色苷还是双糖苷花色苷均存在此类后续衍生,但一个花色苷分子中只存在一个6-O-香豆酰基的修饰,不存在双糖苷双6-O-香豆酰基化的情况。6-O-乙酰化只能修饰单糖苷类花色苷,而双糖苷花色苷则不会受到乙酰化的修饰,这在其他大量富含酰基化修饰花色苷的浆果中也是比较少见的,表现了黑枸杞果实花色苷生物合成路径中相关酰基转移酶独特的底物选择特异性。由此可以推测,黑枸杞果实中负责花色苷6-O-乙酰化的脂肪族酰基转移酶仅可以利用3-O-单葡萄糖苷类花色苷为底物,而负责花色苷6-O-香豆酰化的脂肪族酰基转移酶不仅可以利用3-O-单葡萄糖苷类花色苷为底物,也可以利用3,5-O-双葡萄糖苷类花色苷为底物,但均只执行3-O-葡萄糖苷的单酰基化修饰。此外,黑枸杞果实中均不存在咖啡酰化的花色苷。这些特点,一同构成了黑枸杞果实中花色苷合成与积累的特殊模式,可以由此进一步开发黑枸杞果实花色苷指纹图谱,成为黑枸杞果实及其加工产品的真伪辨别工具。
而以花色素糖苷配基而论,甲基花翠素和二甲基花翠素两类花色素衍生而来的花色苷种类是最多的,两者均出现于3-O-单葡萄糖苷、3,5-O-双葡萄糖苷、3-O-(6-O-乙酰化)-单葡萄糖苷、3-O-(6-O-香豆酰化)-单葡萄糖苷和3,5-O-(6-O-香豆酰化)-双葡萄糖苷等不同类型的花色苷。其次是花青素、花翠素的各类衍生化花色苷,均存在于3,5-O-双葡萄糖苷、3-O-(6-O-乙酰化)-单葡萄糖苷、3,5-O-(6-O-乙酰化)-双葡萄糖苷的花色苷。然而,甲基花青素类的花色苷则仅存在于3-O-(6-O-乙酰化)-单葡萄糖苷、3-O-(6-O-香豆酰化)-单葡萄糖苷之中,并未参与3,5-O-双葡萄糖苷类花色苷及其相应的酰基化花色苷的合成与积累。与此相应,在黑枸杞果实中并未检测到花葵素-3-O-单葡萄糖苷及其衍生物的存在,这是与大部分富含花色苷的水果或浆果相一致的。这些均表明在黑枸杞花色苷的合成路径中,类黄酮骨架B环的羟基化和甲基化修饰也有着独特的特异性。

图 1 黑枸杞果实中不同糖苷化及酰基化修饰花色苷组成的分析Fig. 1 Composition of glycosylated and acylated anthocyanins from black wolfberries
如图1所示,黑枸杞果实中所含3-O-单葡萄糖苷类花色苷极少,仅占其花色苷总量的3.00%,相应的3-O-(6-O-乙酰化)-单葡萄糖苷含量更少,仅占总花色苷含量的0.51%,而3-O-(6-O-香豆酰化)-单葡萄糖苷占比最多,达到了55.81%,并且以花翠素和甲基花翠素形成的花色苷为主(单葡萄糖花色苷的44%和35%)。相比而言,黑枸杞果实中3,5-O-双葡萄糖苷花色苷则远高于3-O-单葡萄糖苷类花色苷,其占比达到了30.99%,再次表明黑枸杞果实中5-O-糖苷转移酶具有较高的活性,不仅在花色苷类型上,也在含量上对花色苷的积累起到了决定性的作用。与此同时,本研究中检测到3,5-O-(6-O-香豆酰化)-双葡萄糖苷的大量积累,达到了总花色苷含量的9.69%,从侧面说明了香豆酰化花色苷酰基转移酶在黑枸杞花色苷的生物合成中具有极为重要的作用。
在所有检测出的花色苷中,香豆酰化花色苷所占比例最高,达到了66%,其次为未酰化的花色苷(约为33%),而乙酰化花色苷在黑枸杞果实中的含量很少,几乎不可计量,这也与Zheng Jie等[12]报道的相吻合。由于酰化花色苷的结构更加稳定[13],可以保护植株自身免受紫外线等外界逆境条件的损伤[14],所以黑枸杞果实中大量的酰化花色苷积累可能与其独特的生长地理环境(高海拔)与气候(干燥,强光照)有关,是一种生物适应的表现[15]。
在以5 种花色素为糖苷配基的花色苷中,甲基花翠素衍生物含量最高(58%),其次为花翠素(32%),其他花色素形成的花色苷仅占10%,表明了黑枸杞果实中类黄酮B环双羟基化酶(F3’5’H)极高的生理催化活性。这与闫亚美[16]、谭亮[17]等的研究结果一致,但与张小敏等[18]的研究有所不同。前人研究发现,一般情况下黑枸杞果实仅积累一种花色苷或其衍生物,这可能与前人研究方法的局限性有关。本实验检测到黑枸杞果实中甲基花翠素类花色苷及其衍生物占到了总花色苷含量的近6 成,与前人研究有一定的相似性,也与本实验所用野生黑枸杞果实的独特性有关。
此外,之前一些研究普遍认为黑枸杞中不存在以花青素为基体的花色苷[19-20],然而本研究检测到少量的花青素类花色苷及其衍生物,打破了这一理解。此外,Hu Na等[21]曾经从生长在青藏高原地区的黑枸杞果实中检测到了此类成分,也说明了本研究的可靠性,之前部分研究结果的差异可能更多地来自于当时研究技术的局限性,随着分析仪器灵敏度的提高和检测方法的改进,将会有更加深入和全面的研究结果。
2.2 黑枸杞果实中非花色苷酚类物质的靶标定性、定量分析
通过本课题组建立的植物常见非花色苷母离子谱库和经过碰撞诱导裂解产生的碎片离子谱库,共从黑枸杞果实中靶标性鉴定得到非花色苷类成分16 种。其中,羟基苯甲酸3 种,羟基肉桂酸5 种,黄酮醇8 种,不同非花色苷酚类物质成分液相色谱与质谱信息如表2所示,其组成见图2。

表 2 黑枸杞果实中16 种非花色苷酚类物质的靶标定性、定量检测Table 2 Qualitative and qantitative analysis of 16 non-anthocyanin phenolics in black wolfberries
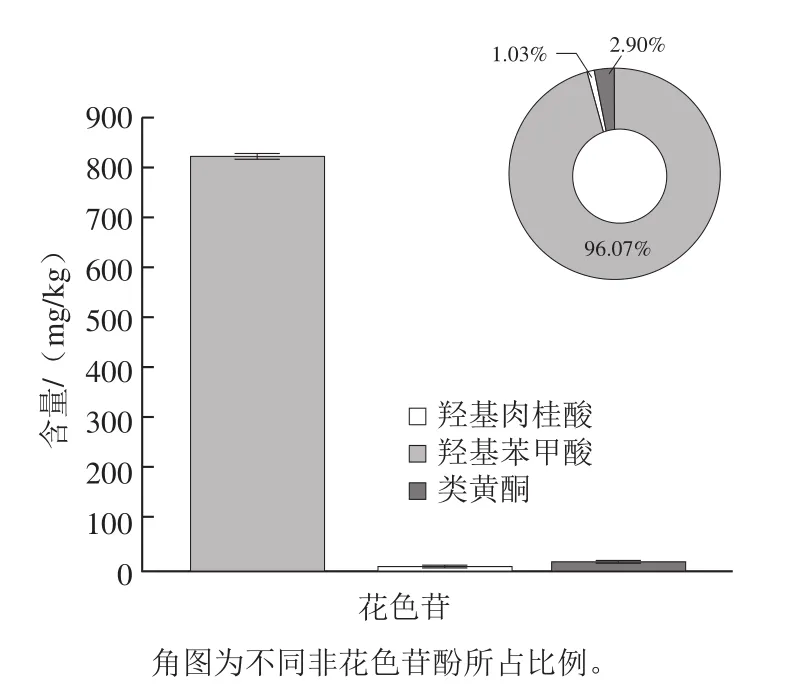
图 2 黑枸杞果实中非花色苷酚类物质组成的分析Fig. 2 Composition of non-anthocyanin phenolics in black wolfberries
与葡萄、黑莓、蓝莓等其他深色浆果类水果相类似,黑枸杞果实中非花色苷酚类物质也主要包括酚酸类物质和黄酮类物质两大类。酚酸类物质中,羟基肉桂酸类物质种类较多,而羟基苯甲酸类物质种类较少,体现了较强的种属特异性。黄酮类物质中,仅检测到了黄酮醇类物质,而没有检测到黄烷醇类物质,即没有检测到缩合单宁(原花色素)及其单体。一般而言,在葡萄等水果和其加工产品(如葡萄酒)中,花色苷几乎不具备任何口感[22],酚酸类物质呈现酸苦的味觉,黄酮醇类物质具有苦味,而黄烷醇类物质则呈现苦和涩的口感,对其风味有着重要的贡献。在黑枸杞果实的感官品评中,在淡淡的苦味之外,几乎不具备涩感,这也是与其酚类物质的组成和它们对果实风味的贡献相一致的。
在黑枸杞的黄酮醇类物质中,除少数几种未经糖苷化修饰之外,多数经历了不同的糖苷化修饰,主要是葡萄糖苷化和半乳糖苷化,且全部为3-O-单糖苷化,未出现3,5-O-双糖苷化及其进一步的酰基化修饰,这也与其他大部分浆果类水果中黄酮醇的合成与积累模式基本相一致[23-24]。
然而,从未糖苷化黄酮醇及糖苷化黄酮醇的糖苷配基角度而言,却又存在着独特的表现模式。简而言之,主要以槲皮素类为代表的B环双羟基化配基(5 种)为主,另有以山柰酚类为代表的B环单羟基化配基2 种,仅存在1 种B环三羟基化配基(丁香亭),未检测到其他浆果中常见的杨梅酮类黄酮醇。这意味着黑枸杞果实中黄酮醇类黄酮骨架B环的修饰以C3′的F3H修饰为主,与之相比C3′5′修饰能力较弱。这也构成了黑枸杞黄酮醇类物质较为特别的合成和积累模式,与其花色苷组分相类似,也可以用于特征辨别性指纹图谱的构建和使用。
在所有检测到的非花色苷酚类物质中,以酚酸类物质绿原酸含量最高,达到761.24 mg/kg,占总非花色苷酚类物质的88%;咖啡酸次之,达到38.43 mg/kg,再次才为4-羟基肉桂酸,含量达到28.15 mg/kg,以上三者均为肉桂酸类酚酸物质,表明了黑枸杞在酚酸类物质积累上的特异性。相比而言,其他酚酸类物质含量均低于10 mg/kg,含量最高的非花色苷类黄酮物质槲皮素,其含量也仅为12.9 mg/kg。所以,绿原酸、咖啡酸、4-羟基肉桂酸和槲皮素为黑枸杞果实中主要且特征性的酚酸类物质成分,尤以绿原酸为主,这与楼舒婷[25]、陈晨等[26]的报道基本一致。大量研究表明,绿原酸具有抗氧化、抗炎症[27]、抗病毒[28]等药理学活性,能够降低慢性疾病的发生率[29],所以在此方面,丰富的绿原酸可能是黑枸杞活性功能的重要物质基础(花色苷外)。
以现有研究结果可知,黑枸杞果实中主要的非花色苷酚类物质种类与前人报道的类似,但是其种类与含量存在差异,一方面这可能与黑枸杞的品种、栽培环境或栽培条件有关,另一方面也可能源自于样品处理方式的差异和检测方法的不同。
刘凤兰等[30]研究表明,对于黑枸杞多酚物质的提取来说,冷冻干燥的方式可以有效地抑制热敏性物质发生化学或物理变化,由此得到的花色苷与其他酚类物质的含量最高;而HPLC-QqQ-MS/MS联用技术的检测方法是本实验室通过科学的探索与改进所确定的最优方案,所以也可能因提取工艺的不同导致测得酚类物质含量有所差异[31]。总体而言,本课题研究采用的方法可以在最大限度上提取黑枸杞的花色苷类物质和非花色苷酚类物质,并可以通过精准的仪器分析技术对其进行定性、定量分析。本研究结果将会为后续研究有所铺垫,也为进一步的深入研究提供一定的参考依据。
3 结 论
甲基花翠素和花翠素衍生物为黑枸杞果实中存在的主要花色苷,分别占总花色苷含量的58%和32%,二者总量可达花色苷总量的90%。其中,甲基花翠素-3,5-O-双葡萄糖苷的含量最高,达1 212.38 mg/kg,同时检测到少量的花青素衍生物。高度的香豆酰化是黑枸杞花色苷存在形式的一个特点,是否与其特殊的生长环境有关,尚有待于进一步研究。在检测到的非花色苷酚类成分中,绿原酸的含量极为丰富,达到761.24 mg/kg,咖啡酸次之,达到38.43 mg/kg。本研究对黑枸杞果实中20 种花色苷与16 种非花色苷酚的靶标性检测,为全面认识黑枸杞果实中的酚类化合物组成及其含量提供依据,同时也为黑枸杞的高效利用提供必要的基础。

