皮肤鳞状细胞癌小鼠模型的光声成像及光声谱分析
文龙 潘晶 王佩茹 张浩南 张国龙 王学鼎 程茜 王秀丽
1安徽医科大学上海皮肤病临床学院 上海市皮肤病医院光医学治疗科,上海 200443;2同济大学物理科学与工程学院声学研究所,上海 200092;3上海市皮肤病医院光医学治疗科 同济大学医学院光医学研究所 200443;4Department of Biomedical Engineering,University of Michigan,Ann Arbor,MI 48109,USA
皮肤鳞状细胞癌(简称鳞癌)是一种发生于上皮细胞的常见皮肤恶性肿瘤[1],其确诊依赖于组织病理检查,但存在有创、耗时长、过程繁琐等不足。生物医学光声技术(photoacoustic)是一种基于光声效应的无创诊断技术[2],近年已成为临床医学影像领域的研究热点。光声效应的原理为脉冲激光或连续调制激光被组织吸收后,引起组织周期性热弹体积胀缩并以声波形式传输出来,即光声信号[3]。这些信号携带了组织的光学、弹性、热力学和结构等丰富的理化信息,通过处理分析后可用于疾病的诊断与组织的评估[4]。目前光声技术在皮肤疾病中的研究较少,主要是基于对所获光声信号进行图像重建,达到对皮肤组织进行组织结构或功能成像[5-7]。在皮肤肿瘤研究方面,多数研究聚焦于黑素瘤的光声成像研究[8-9],但皮肤鳞癌的光声研究仅有个别报道[10]。我们拟采用光声成像及光声谱技术研究两种皮肤鳞癌小鼠模型,初步探索光声技术在皮肤鳞癌无创诊断中的应用。
一、材料与仪器
6~8周龄健康雌性SPF级BALB/C裸鼠60只(上海杰思捷实验动物有限公司,合格证号:18030521-4),动物实验许可证[SCXK(沪)2018-0004],体重约20 g,饲养于同济大学医学院SPF级实验动物中心,予以标准灭菌饲料和洁净水饲养。人皮肤鳞癌A431细胞株(上海中乔新舟生物有限公司);小鼠皮肤鳞癌XL50细胞系(中国典型培养物保藏中心,编号:C201827);小鼠胚胎成纤维细胞3T3细胞株(中国科学院上海细胞生物学研究所)。DMEM培养基、胎牛血清、0.25%胰蛋白酶(美国Gibco公司),RPMI 1640培养基、磷酸盐缓冲液、青霉素/链霉素双抗(美国Hyclone公司)。Acoustic X光声成像系统(日本PreXion公司)。光声谱检测系统:脉冲激光器(美国OPOTEK公司),针式水听器(美国Onda公司),放大器(日本Olympus公司),示波器(美国Teledyne LeCroy公司)。
二、建立XL50、A431裸鼠模型
取处于对数生长期的XL50细胞(与3T3细胞以5∶1比例混合)、A431细胞均按6×106个/只接种于裸鼠右侧背部近上肢处,各接种30只,接种后按上述条件饲养。每日测量肿瘤直径,选取肿瘤直径为5~7 mm的小鼠各20只供实验检测,分别简称为X-SCC、A-SCC。
三、光声成像及光声谱检测
光声成像时,用850 nm LED光源,脉冲重复频率为4 kHz,脉冲宽度为70 ns,光功率密度<5.98×103W/m2。成像平均次数为640次。使用阵列超声探头进行成像检测,探头的中心频率为9 MHz。将超声耦合剂涂抹于瘤体及对侧正常皮肤表面,成像探头垂直于瘤体及正常皮肤进行肿瘤和正常皮肤成像。
使用光声谱检测系统对两种皮肤鳞癌及左侧背部正常皮肤进行光声谱检测。检测时,对肿瘤及正常皮肤组织进行重复频率为10 Hz、脉冲宽度5 ns的脉冲激光辐照,产生的光声信号经耦合剂耦合,由针式水听器(带宽1~20 MHz)接收;使用光阑控制使肿瘤与正常组织的激光辐照光斑尺寸相同,光斑直径为8 mm。将获得的两种瘤体与正常组织的光声数据进行能量归一,使用MATLAB 2016软件进行数据分析,再用pWelch函数对光声数据进行时频转换,计算并绘制得到光声功率谱,并在1.5~10 MHz声频范围内进行线性拟合,提取光声功率谱的拟合斜率。
四、组织病理学检查
光声检测完成后,颈椎脱臼法处死小鼠,使用6 mm环钻钻取肿瘤组织及对侧正常皮肤,4%中性甲醛固定后行组织病理检查。
五、统计学处理
六、结果
1.两种皮肤鳞癌裸鼠模型光声成像结果:850 nm波长下光声成像显示,两种皮肤鳞癌裸鼠模型各20只瘤体均可见较强的血红蛋白光声信号,正常皮肤未见明显光声信号(图1)。
2.两种皮肤鳞癌裸鼠模型光声谱的声功率谱:光声信号经MATLAB 2016软件分析及处理后,得到声功率谱及拟合斜率(图2)。X-SCC模型肿瘤组织声功率谱拟合斜率(-1.827±0.153)低于正常皮肤组织(-1.059±0.118),差异有统计学意义(t=3.973,P<0.001);A-SCC模型肿瘤组织声功率谱拟合斜率(-1.537±0.126)亦低于对侧正常皮肤组织(-0.960±0.260),差异有统计学意义(t=2.166,P=0.043)。
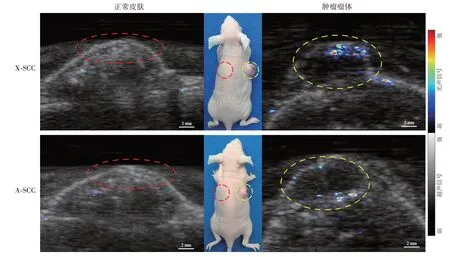
图1 小鼠鳞状细胞癌裸鼠模型(X-SCC)及人皮肤鳞状细胞癌裸鼠模型(A-SCC)正常皮肤与肿瘤瘤体光声成像图光声信号强度在光声成像中以红蓝伪彩表示,两种瘤体(黄色虚线圆圈所示)可见较强的血红蛋白光声信号(伪彩颜色越红表示光声信号越强),而正常皮肤(红色虚线圆圈所示)未见明显光声信号
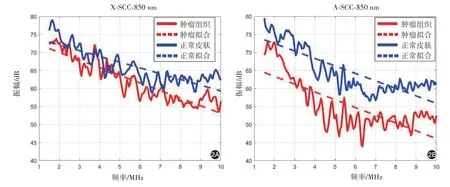
图2 小鼠鳞状细胞癌裸鼠模型(X-SCC)及人皮肤鳞状细胞癌裸鼠模型(A-SCC)正常皮肤与肿瘤瘤体的光声声功率谱曲线及拟合斜率2A:X-SCC;2B:A-SCC
3.两种皮肤鳞癌裸鼠模型组织病理结果:20只X-SCC小鼠肿瘤组织病理均可见肿瘤细胞致密排列,血管散在分布,相比正常皮肤组织血管增多并出现坏死出血;20只A-SCC小鼠肿瘤组织病理均显示肿瘤细胞呈团块样,相比正常皮肤组织血管增多。见图3。
七、讨论
近年来,皮肤镜、光学相干断层成像(OCT)、皮肤共聚焦显微镜等在皮肤肿瘤无创诊断领域取得一定进展[11-14],但以上技术均以光学成像为基础,光在生物组织中具有强散射性,故穿透深度有限。以声成像为基础的技术如高频超声,可以提供较深的成像深度[15],然而其信号反差源于生物组织的声阻抗差异,因此难以区分化学性质有所差异但物理性质相差不大的肿瘤组织与正常组织。

图3 小鼠皮肤鳞状细胞癌裸鼠模型(X-SCC)及人皮肤鳞状细胞癌裸鼠模型(A-SCC)正常皮肤与肿瘤组织病理(图中标尺=100 μm)X-SCC肿瘤组织中肿瘤细胞致密排列,血管增多并出现坏死出血;A-SCC肿瘤组织中肿瘤细胞呈团块样,血管增多
光声技术利用光声效应形成光声信号,这些信号携带了组织的光学、弹性、热力学和结构等丰富的理化信息。我们前期研究中,已将自行搭建的光声成像系统用于胆管癌的成像,成功获得胆管癌的光声图像[16],还验证了光声功率谱用于前列腺癌诊断的可行性,获得前列腺癌的光声谱特征[17]。本研究中,我们将光声检测用于X-SCC及A-SCC裸鼠模型的在体检测。肿瘤的发生发展需要大量的营养物质供应,故往往伴随肿瘤新生血管的生长[18],组织内血红蛋白含量可以间接反映肿瘤相关新生血管的生长。因此,我们检测850 nm波长(血红蛋白特征吸收波长)处光声信号,光声成像显示两种皮肤鳞癌裸鼠模型的瘤体内可见强的光声信号,说明肿瘤中含丰富的血红蛋白,这与病理显示鳞癌瘤体内血管、血液增多相符。既往研究报道,基于血红蛋白特征波长的光声成像能够实现对肾癌种植瘤内新生血管的检测[19],因此,结合本研究的结果可以推测光声可以对皮肤鳞癌进行血液成分的成像从而反映肿瘤中增多的血管。
光声谱检测结果显示,该系统成功地获得了两种皮肤鳞癌与正常皮肤组织的光声信号,信号较稳定。同时,对所获的光声数据进行能量归一计算拟合斜率,显示两种皮肤鳞癌模型肿瘤组织声功率谱拟合斜率均为负值,且均低于正常皮肤组织。光声功率谱的拟合斜率的绝对值反映了组织中高频信号的相对量,高频信号越多代表组织结构越不均匀或异质性越大。Huang等[17]对不同分期的前列腺癌组织的研究表明相较于早期前列腺癌而言,晚期前列腺癌组织的拟合斜率绝对值明显升高,对应病理也显示晚期前列腺癌的异质性增高。本研究结果显示皮肤鳞癌组织的拟合斜率绝对值相较于正常皮肤组织明显升高,而组织病理结果也显示鳞癌中肿瘤细胞排列紧密,结构异质性高,与斜率的统计分析结果一致。因此,光声功率谱拟合斜率可以反映皮肤鳞癌的组织结构变化。
综上所述,我们成功获得皮肤鳞癌的光声成像和光声谱数据,同时通过检测两种皮肤鳞癌裸鼠模型肿瘤组织与正常皮肤850 nm波长处光声信号,发现两种鳞癌裸鼠模型光声信号的声功率谱的斜率均显著低于正常组织。本研究中仅选取血红蛋白特征吸收波长,获得的肿瘤光声数据较单一,今后我们将研究更多组分如胶原、色素、脂质等物质的特征波长下的光声数据,期望得到皮肤鳞癌以及更多的皮肤肿瘤的光声数据,并在光谱及声谱两个维度展开研究,以期能初步对皮肤肿瘤进行光声的无创诊断。
利益冲突所有作者均声明不存在利益冲突

