H9N2亚型禽流感病毒样颗粒疫苗的制备研究
潘 学,陈新武,季雅宁,李雪松,刘芹防,陈鸿军,杨健美,滕巧泱,李泽君
禽流感(avian influenza,AI)是由正粘病毒科A 型流感病毒(Avian influenza virus,AIV)引起的禽类高度接触性传染病,有16个HA亚型和9个NA 亚型[1]。根据禽流感病毒致病性的不同,可分为高致病性禽流感病毒和低致病性禽流感病毒。目前,中国的低致病性禽流感疫情主要以H9亚型为主。1994 年首次在鸡群中分离到H9N2亚型AIV[2],该亚型AIV广泛存在于我国大部分地区[3]。H9N2 亚型AIV虽然不能造成禽类大量死亡,但是由于该病毒传播能力极强,存在范围极广,可导致产蛋下降和免疫抑制病,并且AIV与其他病原共感染时常导致高死亡率,给我国养禽业造成了巨大的经济损失。
接种疫苗是预防禽流感发生与传播最有效的手段之一。上海市动物疫病预防控制中心2009年监测报告显示[4],在上海三大活禽批发市场采集的样品中,H9亚型AIV平均阳性率为8.14%,并且在免疫H9N2亚型AIV灭活苗后抗体合格率达到100%的样品中分离到8株H9亚型AIV(8/90)。2009~2010年对禽流感流行病学的研究显示,H9抗体较高的免疫鸡依然携带H9N2亚型AIV。现有的H9N2亚型AIV灭活疫苗免疫鸡后,虽然能使鸡产生较高的抗体,但已经不能有效地保护其免受当前H9N2亚型AIV流行株的攻击。因此,商品化H9N2亚型AIV灭活疫苗的制备毒株急需更新。
病毒样颗粒(virus-like particle,VLP)疫苗因其安全性和抗病毒的有效性,成为近年研究的热点[5]。目前,已经有乙型肝炎病毒和人类乳头瘤病毒VLP疫苗上市[5-6]。VLP没有病毒核酸,不能自主复制,非常安全。VLP在形态上与真正病毒粒子相同或相似,作为颗粒性抗原可激活树突状细胞等抗原提呈细胞,被其提呈给T、B淋巴细胞,从而有效地诱导机体产生有效的免疫保护反应。同时,VLP具有广泛的交叉免疫作用,这一点是应对当前流感病毒抗原变异快速的关键[7-9]。与传统鸡胚培养方式相比,VLP疫苗还具有反应快速的优势。目前,国外研究人员利用杆状表达系统平台,已经成功制备了H1N1、H3N2、H5N1、H5N3等亚型流感病毒的VLPs[8-11]。研究结果显示,仅需流感病毒的HA和NA两个蛋白,即可完成流感VLPs的合成和出芽[12-13]。
本研究将H9N2亚型AIV的HA和NA基因优化成昆虫细胞所偏嗜的密码子,通过杆状病毒表达系统成功的表达出只有HA和NA蛋白所构成的VLP,优化了VLP形成的条件,为H9N2亚型AIV的VLP疫苗产品研发及其临床应用奠定了基础。
1 材料与方法
1.1 毒株、细胞、感受态、载体 H9N2亚型禽流感病毒A/Chicken/Shanghai/441/2009(H9N2)(简称为SH441)由上海兽医研究所动物流感病原生态学创新团队保存,前期研究表明该病毒具有良好的免疫原性;草地贪夜蛾(Spodoptera frugiperda)Sf9细胞系由上海兽医研究所动物流感病原生态学创新团队保存;E.coli DH5α感受态细胞购自北京全式金公司;DH10Bac感受态细胞购自上海超研生物科技有限公司;pFastBackTMDual杆状病毒表达质粒由上海兽医研究所动物流感病原生态学创新团队保存。
1.2 主要试剂 Sf-900TMII SFM昆虫细胞培养基、Cellfectin® II Reagent转染试剂、S.O.C. Medium、PureLinkTMHiPure Plasmid Miniprep Kit、Grace’s Insect Cell Culture Medium(Unsupplemented)、Grace’s Insect Cell Culture Medium(Supplemented)、500 mL三角瓶均购自Invitrogen公司;胎牛血清购自Gibco公司;Sal I、Xba I、Nhe I和Xho I等限制性内切酶均购自NEB公司;同源重组酶ClonE press II购自北京全式金公司;DNA凝胶回收试剂盒、质粒提取试剂盒购自QIAGEN公司。
1.3 病毒RNA的提取和RT-PCR扩增 按照天根生化科技有限公司抽提RNA试剂盒的说明书抽提总RNA,随后用12 bp通用引物(表1)反转录成cDNA。利用同源重组特异性引物pFast-HA-F、pFast-HA-R 和pFast-NA -F 、pFast-NA-R(表1),经TaKaRa高保真聚合酶(pyrobest DNA polymerase )扩增得到毒株SH441的HA和NA开放阅读框。
1.4 H9N2亚型AIV的HA和NA基因的优化与合成 将H9N2亚型AIV毒株SH441的HA和NA开放阅读框的密码子,按照昆虫细胞所偏嗜的密码子进行优化后,由金唯智生物科技有限公司合成并克隆至pMD-19T载体。以上述重组质粒为模板,利用同源重组特异性引物opti-pFast-HA-F、opti-pFast-HA-R和opti-pFast-NA-F、opti-pFast-NA-R(表1),经pyrobest DNA polymerase扩增得到优化后的HA和NA目的片段,分别命名为optiHA和optiNA。
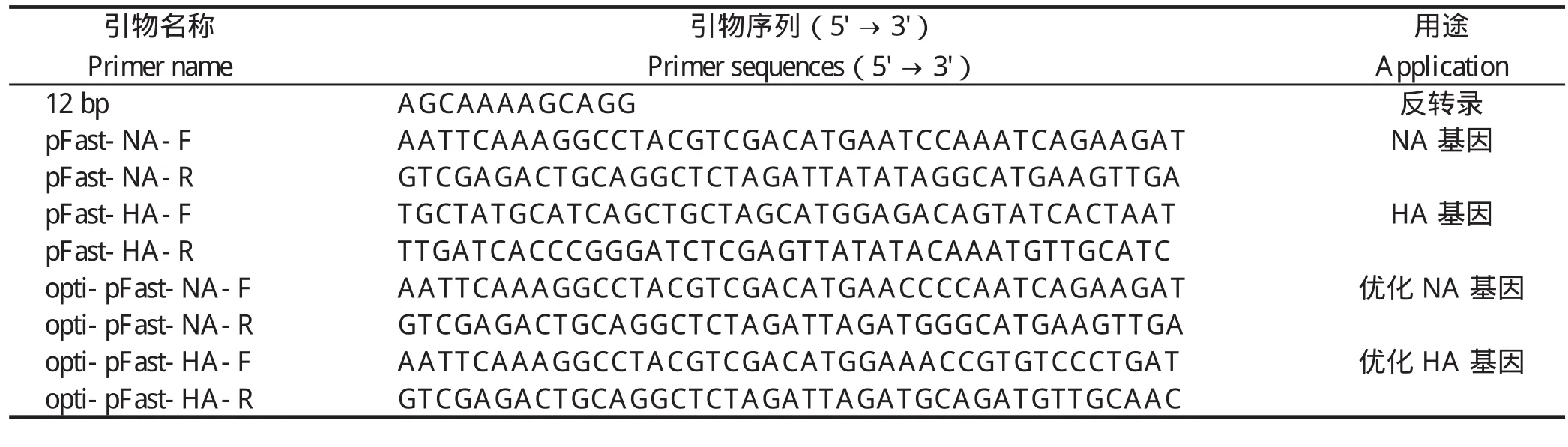
表1 PCR所用引物Table1 The primers for PCR
1.5 含有目的基因的重组供体质粒的构建与鉴定 将pFastBackTMDual载体用SalI和XbaI双酶切,制备线形载体,酶切产物胶回收后,利用同源重组试剂盒分别将经相同酶切的NA或optiNA连接至线形载体pFastBackTMDual,构建重组质粒,并分别命名为pFastBackTMDual-NA和pFastBackTMDual-optiNA。随后构建的质粒分别经NheI和XhoI双酶切后,利用同源重组酶将HA连接至pFastBackTMDual-NA质粒,命名为pFastBackTMDual-HANA;将optiHA连接至opti-pFastBackTMDual-NA质粒,命名为pFastBackTMDual-optiHANA。连接产物转化于 DH5α 感受态细胞,挑取单克隆。提取质粒分别用特异性引物进行PCR鉴定,并进行测序验证。PCR鉴定过程中所用到的特异性引物:pFast-HA-F、pFast-HA-R、pFast-NA-F、pFast-NA-R、opti-pFast-HA-F、opti-pFast-HA-R和opti-pFast-NA-F、opti-pFast-NA-R(表1)。
1.6 含有目的基因的重组杆粒的构建与鉴定 将供体质粒pFastBackTMDual-HANA和pFastBackTMDualopti HANA分别转化到含有Bacmid和 Helper质粒的大肠杆菌 DH10Bac 感受态细胞中,经3次的抗性和蓝白斑筛选,挑取白色单个克隆,再次划线于新鲜LB 平板,37℃过夜培养后,挑取白色单个克隆,扩大培养后提取DNA,分别命名为Bacmid-
HANA和Bacmid-optiHANA,使用特异性引物进行 PCR 鉴定。PCR鉴定所用的特异性引物:pFast-HA-F、pFast-HA-R、pFast-NA-F、pFast-NA-R、opti-pFast-HA-F、opti-pFast-HA-R和opti-pFast-NA-F、opti-pFast-NA-R。
1.7 重组杆状病毒的获得 按照 Invitrogen 公司 Bacto-Bac Baculovirus Expression System 技术手册使用Cellfectin reagent,分别将Bacmid-HANA和BacmidoptiHANA转染对数生长期的Sf9昆虫细胞,27℃培养 3~5 d,直至 70%~80%细胞出现病变,收获培养上清和细胞,300×g离心15 min,上清即为原代毒种(P1 代),4℃避光保存备用。将P1代毒种在Sf9昆虫细胞上扩大培养1次后即为P2代毒种,测定病毒滴度后,将病毒分装,保存于4℃或-80℃备用。
1.8 Western blot 鉴定目的蛋白表达 Sf9昆虫细胞生长至 80%~90%时,接种P2代重组杆状病毒,27℃培养3~5 d,直至70%~80%的细胞出现病变,收获培养上清和细胞,300×g离心15 min。将收获的样品用样品缓冲液重悬,煮沸 5 min,经10%SDSPAGE 电泳后,转印硝酸纤维素膜,用5%的脱脂乳室温封闭2 h。加入抗H9N2亚型禽流感病毒的鸡血清(1∶1000稀释)作为一抗,置于4℃摇床过夜。TBST洗膜3次,每次10 min,加入1∶2000稀释的HRP羊抗鸡IgG(Sigma)作为二抗。TBST洗膜3次,每次10 min,共3次,将膜置于发光液中浸泡约1 min,然后曝光。
1.9 VLP的超离与纯化 将4瓶长满T75细胞瓶中的Sf9昆虫细胞完全转移到一次性500 mL三角瓶中,加200 mL培养液培养。然后接种重组杆状病毒,27℃、110 r/min培养36 h后,4℃、300×g离心,去除细胞脆片及杂质。收集上清,置于超速离心机,4℃、159 930×g离心 6 h。离心后轻轻弃去上清,用 200 μLPBS重悬沉淀物并混匀,过蔗糖梯度(40%、50%、60%三种不同浓度)后,4℃、159 930×g离心6 h。吸取不同浓度蔗糖之间的病毒条带于新的离心管中,加入适量的PBS以洗脱蔗糖,沉淀用100 μL去离子水重悬。
1.10 透射电子显微镜观察VLP形态 将超离纯化的VLP进行50倍稀释后,固定于铜网,用磷钨酸复染,于透射电子显微镜下(日本 GEM2100)观察。
2. 结果
2.1 H9N2亚型AIV的HA和NA基因的密码子优化 由于不同宿主所偏嗜的密码子不同,因此将H9N2亚型AIV毒株SH441 HA和NA的开放阅读框的密码子优化成昆虫细胞所偏嗜的密码子,并分别命名为opti-HA(图1A)和opti-NA(图1B)。
2.2 pFastBack重组质粒的构建与鉴定 为了在杆状病毒系统中表达H9N2亚型AIV的HA和NA蛋白,我们利用同源重组的方法构建了两种不同的质粒:pFastBackTMDual-HANA和pFastBackTMDualoptiHANA。获得的重组质粒用SalI、XbaI、NheI和XhoI限制性内切酶酶切处理,皆得到与预期大小相符的片段(图2)。
2.3 Bacmid重组质粒构建与鉴定 将供体pFastBackTMDual-HANA和pFastBackTMDual-optiHANA转化DH10Bac感受态细胞,获得了相应的Bacmid重组质粒,分别命名为Bacmid-HANA和BacmidoptiHANA。以提取的重组质粒DNA为模板,用相应的特异性引物进行PCR,结果显示,在1000~2000 bp之间出现特异性条带,与预期大小一致(图3)。测序结果也表明,该质粒中含有的目的基因片段与预期序列完全一致,所构建的载体是正确的。
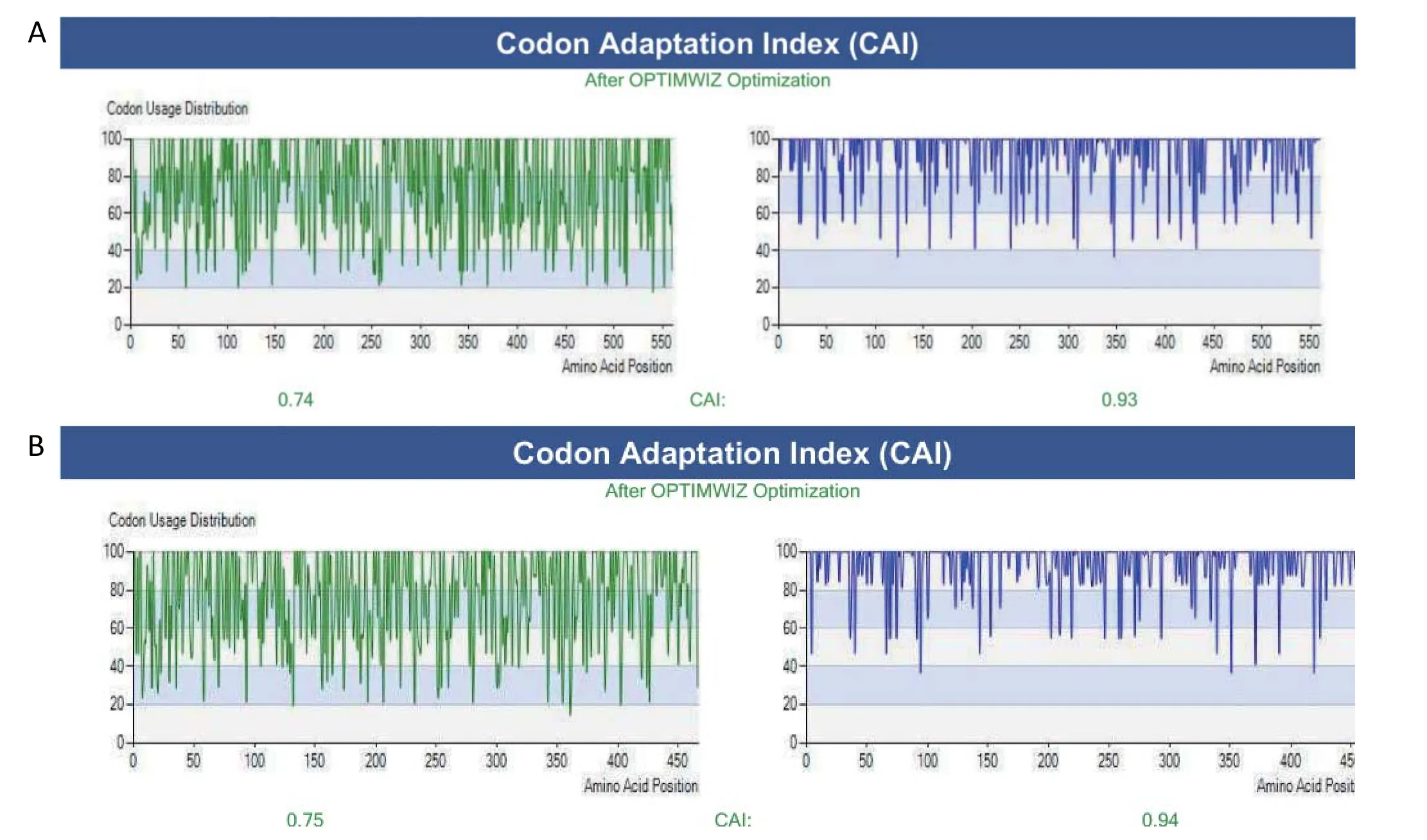
图1 HA和NA基因的密码子优化结果Fig.1 The optimized codons for HA gene(A) and NA gene(B)
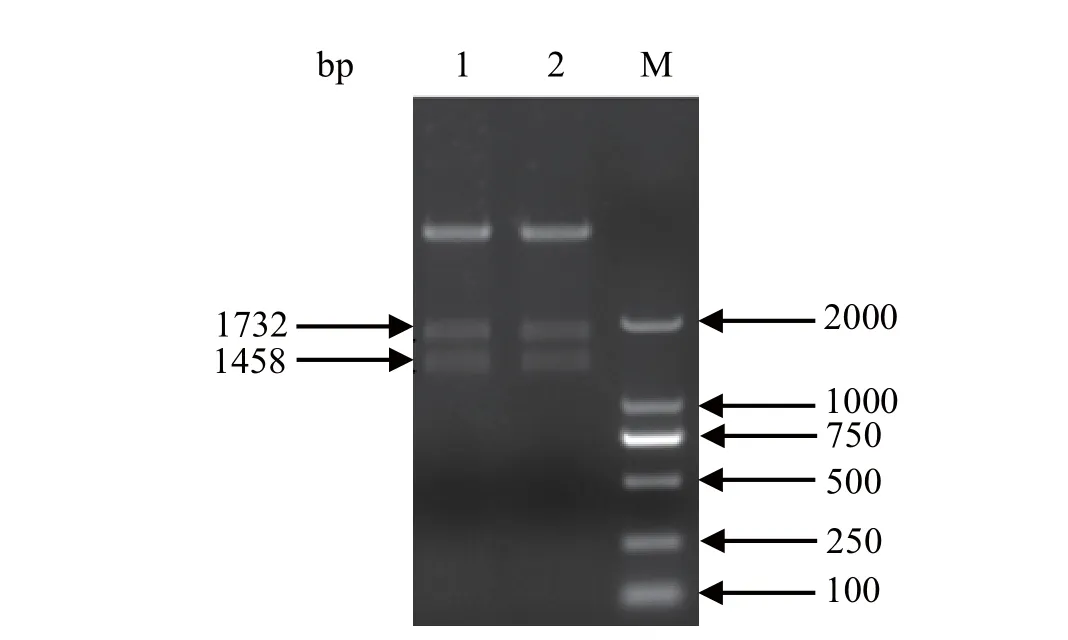
图2 重组质粒pFastBackTM Dual-optiHANA和pFastBackTM Dual-HANA的PCR鉴定Fig. 2 PCR identifi cation of pFastBackTM Dual-optiHANA and pFastBackTM Dual-HANA
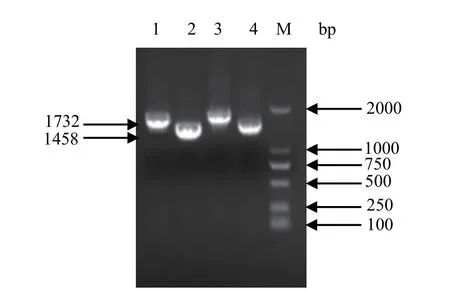
图3 rBacmid-optiHANA和rBacmid-HANA的PCR鉴定Fig.3 PCR identifi cation of rBacmid-optiHANA and rBacmid-HANA
2.4 重组质粒转染细胞病变结果 利用Cellfectin®II Reagent转染试剂分别将1 μg的Bacmid-HANA和Bacmid-optiHANA重组质粒转染到Sf9昆虫细胞中,每天观察细胞病变,并在转染后12、24、36、48、72 h测血凝。转染72 h,Bacmid-HANA和BacmidoptiHANA重组质粒转染的细胞均产生细胞病变(图4)。进一步研究表明,Bacmid-optiHANA重组质粒转染的细胞上清中检测到血凝,HA效价为24,而未经优化的Bacmid-HANA重组质粒转染的细胞上清中未检测到血凝。结果表明,插入优化的HA和NA基因的Bacmid重组质粒,转染Sf9细胞后不但能形成重组杆状病毒,而且表达分泌型的HA蛋白和NA蛋白到细胞上清中。插入未经优化的HA和NA基因的Bacmid重组质粒,转染Sf9细胞后可形成重组杆状病毒,但无法表达分泌型的HA蛋白和NA蛋白到细胞上清中。
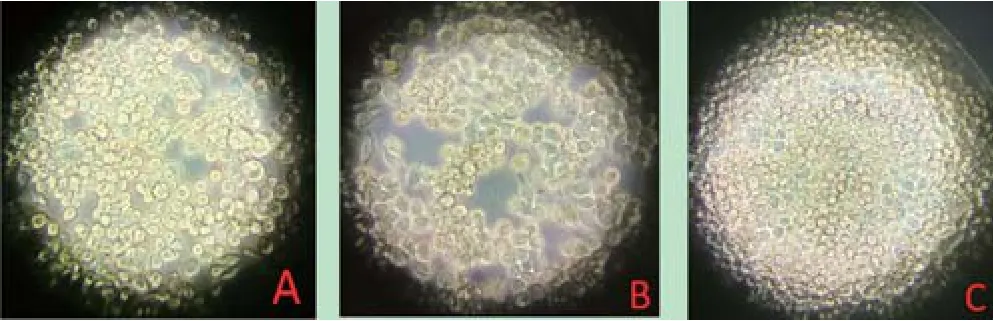
图4 重组质粒转染Sf9昆虫细胞后的病变Fig.4 Pathological changes of Sf9 cells transfected with recombinant plasmids
2.5 Western blot检测目的蛋白的表达 将重组杆状病毒感染昆虫细胞,感染后72 h收集上清,用抗H9N2亚型AIV的鸡血清作为一抗和HRP标记的羊抗鸡IgG作为二抗,进行Western blot分析。结果显示,插入优化的HA和NA基因的杆状重组病毒感染Sf9细胞后,在55~70 kDa之间有两条特异性条带,与预期的大小基本一致,但插入未优化的HA和NA基因的杆状重组病毒未能在Sf9细胞中表达目的蛋白(图5)。
2.6 透射电子显微镜观察流感病毒样颗粒 将插入优化的HA和NA基因的杆状重组病毒感染Sf9细胞,离心获得的上清经超速离心法浓缩后,再用蔗糖梯度离心的方法纯化,然后在透射电子显微镜下观察。结果表明,杆状重组病毒感染Sf9细胞后的上清中可以观察到病毒样颗粒,并且形态呈多样性(图6),与野生型的流感病毒特性一致。
3 讨论
不同的宿主对密码子的偏爱性不同,所以不同宿主使用不同密码子的频率不同,导致异源基因的表达受宿主的影响[14]。将Sf9 细胞偏嗜的密码子与人类偏嗜的密码子进行比较,发现两者丝氨酸、丙氨酸、精氨酸、甘氨酸及终止密码子等均不同[15]。研究表明,密码子优化后所表达的流感病毒蛋白的量明显高于未优化所表达的蛋白量[16]。因此,在不改变H9N2亚型AIV HA和NA蛋白氨基酸序列的基础上,本研究对HA和NA基因的密码子进行了优化,使其能在昆虫细胞中更高效的表达。血凝试验和Western blot结果皆证实优化的HA和NA基因在杆状病毒表达系统中表达成功,并分泌于上清中。而未优化密码子的HA和NA基因无法在杆状病毒表达系统中表达。可见,将目的片段的密码子优化成偏嗜杆状病毒的密码子,是目的蛋白在该系统中成功表达的重要因素之一。
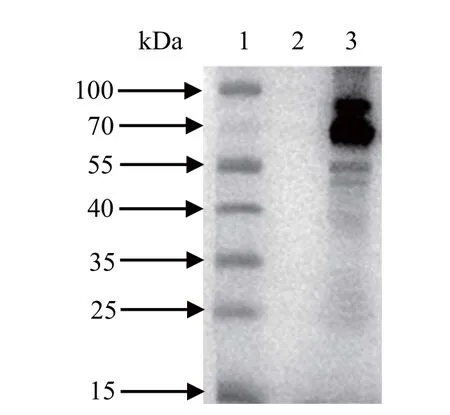
图5 Western blot检测目的蛋白在Sf9细胞中的表达Fig.5 Western blot detection of the target protein in Sf9 cells
图6 病毒样颗粒电镜图Fig.6 Electron micrograph of VLP
VLP疫苗以其安全性和抗病毒的有效性成为疫苗研究的热点,流感病毒VLPs疫苗具有巨大的开发与应用前景。目前国内H9N2亚型AIV的VLPs疫苗研制几乎处于空白状态。研究表明,流感病毒颗粒组装的模型是基质蛋白(M1)与细胞膜上的“脂筏”区域连接,并与HA和NA胞内区相互作用,从而启动病毒组装和出芽的过程[17-19]。有学者指出流感病毒的HA和NA在流感VLP的合成、出芽和表达过程中是必须的[12]。对于影响流感VLP形成的关键病毒成分一直存在争议。在本研究中,经密码子优化的HA和NA基因所构建的质粒转染细胞72 h后,便能在上清中检测到血凝,并且经电镜可观察到VLP。结果表明,本研究通过杆状病毒成功表达了H9N2亚型禽流感病毒HA和NA蛋白,且该两个蛋白可形成VLP,为后续VLP疫苗的开发与应用奠定了基础。
——一道江苏高考题的奥秘解读和拓展

