火鸡疱疹病毒荧光定量PCR检测方法的建立及初步应用
白银荣,张志飞,李雪松,刘芹防,陈鸿军,杨健美,李泽君,滕巧泱,张七斤
(1.内蒙古农业大学,呼和浩特 010018;2.中国农业科学院上海兽医研究所,上海 200241)
火鸡疱疹病毒(Herpesvirus of turkey,HVT)是Ⅲ型马立克氏病病毒(Marek’s disease virus,MDV),属于疱疹病毒科、疱疹病毒甲亚科、马立克氏病毒属,为线性双链DNA病毒[1]。HVT是细胞结合性疱疹病毒,能够感染鸡胚成纤维细胞(chicken embryo fibroblast,CEF)并产生病变。鸡感染HVT后可终生携带,但是无致病性[2-3]。自20世纪70年代HVT被发现以来,一直作为活疫苗预防MDV感染,效果良好[4]。目前,HVT活疫苗已广泛地应用于1日龄雏鸡来预防马立克氏病[5-6]。
在体外,通常采用蚀斑技术对HVT疫苗免疫效力和增殖情况进行检测,但该方法准确性低,重复性差,易受许多因素的影响,而且操作繁琐,周期长,很难应用于大量样品的快速检测。本研究拟建立一种快速、简便、敏感、特异且准确的HVT荧光定量PCR检测方法,为及时检测HVT的病毒含量提供有效的手段。
1 材料与方法
1.1 材料
1.1.1 病毒毒株、SPF鸡胚和CEF细胞 火鸡疱疹病毒FC-126疫苗冻干毒购自哈尔滨兽药厂;鸭瘟病毒(Duck plague virus,DPV)、传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)、鹅细小病毒(Goose parvovirus,GPV)、血清4型禽腺病毒(Fowl adenovirus serotype 4,FADV4)和FADV8均由本实验室提供;SPF鸡胚由北京梅里亚维通实验动物技术有限公司提供;采用9~11日龄SPF鸡胚制备原代细胞。
1.1.2 载体和受体菌 pMD19-T载体购自TaKaRa公司;大肠杆菌DH5α购自北京天根生物技术有限公司。
1.2 主要试剂和仪器 2×HieffTMPCR Master Mix购自 圣生物公司;DNA分子量标准(DL2000)购自TaKaRa公司;Ezup柱式病毒DNA抽提试剂盒购自生工生物工程股份有限公司;DMEM购自Hyclone公司;0.25%胰酶购自Gibco公司;胎牛血清购自Biosun公司;质粒小量提取试剂盒和PCR产物回收试剂盒购自Axygen公司;荧光定量PCR仪购自Eppendorf公司;紫外分光光度计购自Thermo公司;UV-2000型紫外分析割胶仪购自上海天能科技有限公司。
1.3 引物设计 根据NCBI登录的HVT FC-126毒株(AF281966)的sorf1基因序列,应用Beacon Designer 8设计特异性引物和探针(表1)。引物和探针由上海华津生物科技有限公司合成。

表1 引物和探针信息Table 1 The sequences of primers and probe
1.4 标准质粒的构建 在CEF上扩增病毒,病变达到80%~90%时,收集细胞并提取总DNA,具体方法参照Ezup柱式病毒DNA抽提试剂盒说明书。以提取的HVT基因组DNA为模板,PCR扩增sorf1基因。PCR反应体系:ddH2O 19 μL、2×HieffTMPCR Master Mix 25 μL、上游引物(10 μmol/L)2 μL、下游引物(10 μmol/L)2 μL、DNA模板2 μL。反应条件:95℃预变性3 min;94℃变性30 s,60℃退火45 s,72℃延伸10 s,进行30个循环;72℃再延伸7 min。PCR扩增产物经纯化后,连接于pMD19-T载体。PCR检测为阳性的菌液送上海擎科生物公司测序。将测序正确的菌液进行PCR扩增并提取质粒,命名为p-sorf1。测定质粒浓度后用公式计算质粒拷贝数,10倍梯度稀释后作为标准品,即浓度分别为1×1010、1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100copies/μL。
1.5 反应条件优化及标准曲线建立 在同一浓度模板的反应体系中,采用正交试验法对引物浓度进行优化。以1.4中经10倍梯度稀释的重组质粒标准品作为模板,利用优化的反应条件,在Mastercycler®RealPlex2荧光定量PCR仪上进行检测,获得模板拷贝数与临界循环数(cycle threshold,Ct)的标准曲线。
1.6 敏感性 将重组质粒进行10倍梯度稀释,分别以1×106、1×105、1×104、1×103、1×102、1×101、1×100copies/μL为模板,利用优化的反应条件进行荧光定量PCR检测。通过不同浓度标准品的Ct值,判定该方法所能检测的最小DNA拷贝数。以梯度稀释的质粒为模板,HVT-F和HVT-R为引物(表1),采用常规PCR方法来扩增HVT,用1%琼脂糖电泳鉴定PCR产物。
1.7 特异性 分别以DPV、ILTV、GPV、FADV4和FADV8的基因组DNA为模板,设空白对照,按优化的反应体系进行荧光定量PCR,检测该方法的特异性。
1.8 重复性试验 选取1×1010、1×109、1×108、1×107、1×106copies/μL 5个不同浓度的标准品,进行组间和组内重复性检测,每个样品重复3次,计算变异系数。
1.9 临床样品检测 对本实验室采集的82份样品按1.4中方法提取基因组DNA,分别使用建立的HVT荧光定量PCR方法以及常规PCR方法来进行检测。
2 结果
2.1 标准品制备及鉴定 普通PCR可扩增出约85 bp的特异性条带,与目的片段大小一致(图1)。将该片段连接于pMD19-T载体,获得重组质粒p-sorf1,测序结果显示与原序列完全一致。提取的质粒DNA经紫外分光光度计测定浓度为62 ng/μL,OD260/OD280比值为1.98,符合纯度要求。经公式:Copy Number = ( amount× 6.022×1023) /(length×1×109×660),计算出阳性重组质粒的拷贝数为2.0×1010copies/μL。
2.2 荧光定量PCR标准品的制备及标准曲线的建立 经优化后最终确定的PCR反应体系:ddH2O 6.4 μL、2×Premix ExTaq10 μL、上游引物(10 μmol/L)0.6 μL、下游引物(10 μmol/L)0.6 μL、探针(10 μmol/L)0.4 μL、模板2 μL。最佳反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环。将p-sorf1质粒梯度稀释后制备标准品,稀释浓度分别为1×1010、1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102copies/μL。以各个浓度的质粒作为模板,经qPCR扩增,获得标准曲线方程:y=-3.42logx+41.21(图2),相关系数R2为0.999,说明建立的qPCR方法标准曲线的线性关系良好;扩增效率为107%,产物的Ct值与浓度呈良好的线性关系。
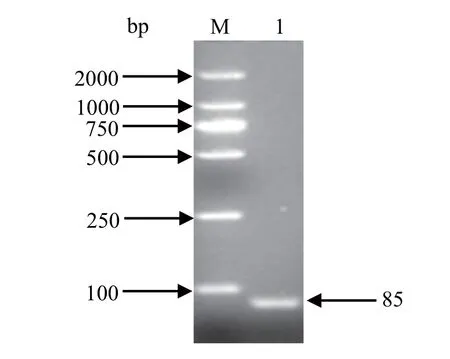
图1 sorf1基因的PCR扩增结果Fig.1 PCR results of sorf1 gene

图2 荧光定量PCR检测的标准曲线Fig.2 Standard curve of fl uorescence quantitative PCR
2.3 敏感性分析 将质粒进行10倍梯度稀释,分别以1×106、1×105、1×104、1×103、1×102、1×101、1×100copies/μL为模板,利用优化的反应条件进行荧光定量PCR检测,结果为阳性的最高稀释度的质粒浓度为1×102copies/μL(图3),而普通PCR检测的灵敏度为1×103copies/μL(图4),可见,荧光定量PCR的敏感性是普通PCR的10倍。2.5 特异性分析 检测结果表明,应用建立的TaqMan荧光定量PCR进行检测,仅HVT有特异性扩增曲线,而DPV、ILTV、GPV、FAdV-4和FAdV-8均为阴性(图5),表明该方法具有良好的特异性。

图3 荧光定量PCR的敏感性检测Fig.3 Sensitivity of fl uorescence quantitative PCR
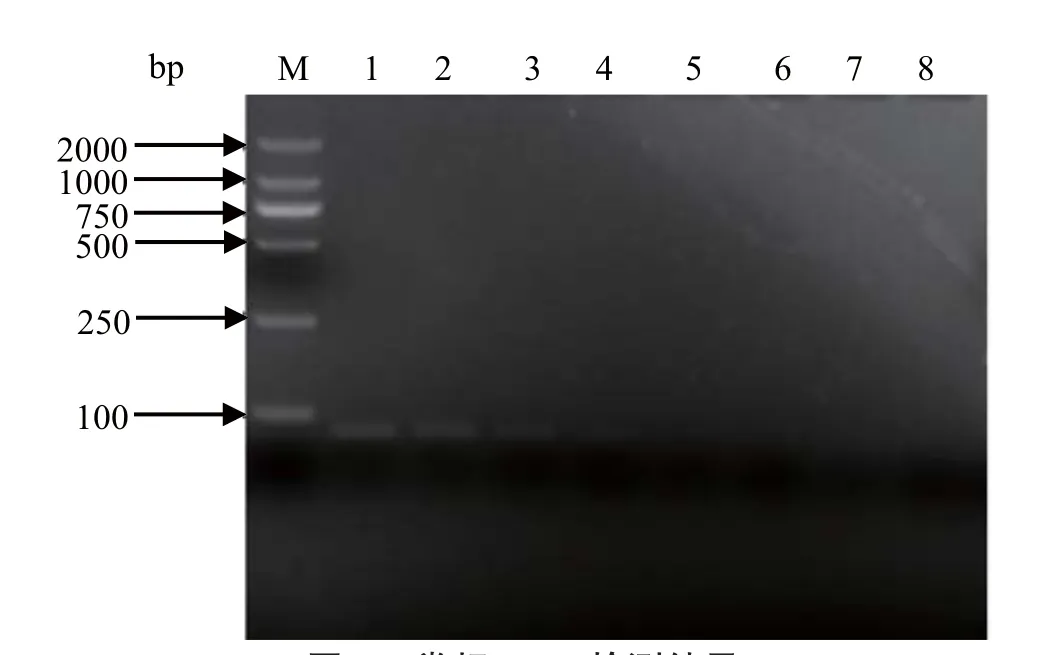
图4 常规PCR检测结果Fig.4 Result of the conventional PCR

图5 荧光定量PCR检测方法的特异性Fig.5 Specifi city of fl uorescence quantitative PCR
2.6 重复性分析 将重组质粒分别进行10倍梯度稀释,选取浓度为1×1010、1×109、1×108、1×107、1×106copies/μL的重组质粒作为模板,验证建立的荧光定量PCR方法的重复性。由表2可知,组间和组内变异系数均小于1%,表明本研究所建立的荧光定量PCR检测方法重复性良好。

表2 荧光定量PCR检测方法的重复性Table2 Repeatability of fl uorescence quantitative PCR
2.7 临床样品检测 分别使用建立的HVT荧光定量PCR方法和普通PCR方法对本实验制备的82份HVT病毒样品进行检测。以p-sorf1质粒标准品为阳性对照,超纯水为空白对照。检测结果显示,荧光定量PCR检测出43份阳性样品,普通PCR检测出30份阳性样品,进一步证实建立的荧光定量PCR方法较普通PCR更敏感。
3 讨论
HVT与马立克氏病毒在遗传学和血清学上具有相关性,一直作为活疫苗用于预防马立克氏病[4,7]。同时,HVT作为载体携带外源保护性抗原具有许多优势:对鸡和其他动物无致病性,较为安全;接种后鸡体能产生长达数周的病毒血症,从而刺激机体产生较高的抗体水平;HVT疫苗生产成本低,可冻干,贮存和运输方便[8-9]。国内外对以HVT为载体的禽病重组疫苗已开展了大量的研究,如传染性法氏囊病(infectious bursal disease,IBD),新城疫(newcastle disease,ND)和禽流感(avian influenza,AI)等[10]。快速、准确有效地判断HVT在细胞和机体内的复制情况,是HVT载体疫苗研究的重要基础。
本研究通过条件优化,最终建立了较为理想的HVT荧光定量PCR检测方法。标准曲线的相关系数为0.999,线性关系良好,扩增效率为107%(扩增效率应为0.8~1.2,以接近1为最佳)。该方法可特异性检测到HVT,灵敏度较普通PCR提高1个数量级,提高了检测病原的敏感性。检测临床样品时,建立的HVT荧光定量PCR检测方法较普通PCR的方法的检测率提高了16%。结果表明,本研究所建立的HVT荧光定量PCR检测方法,具有较好的准确性、特异性和敏感性,为评估HVT免疫情况及其新型疫苗的后续研发奠定了基础。
——一道江苏高考题的奥秘解读和拓展

