卵巢成熟性畸胎瘤合并腹膜胶质瘤病一例报告
胡超,朱诚程,占旖晴,鲁凯俊,张轶清
腹膜胶质瘤病(gliomatosis peritonei,GP)是一种 罕见的疾病,是成熟神经胶质细胞在腹膜或其他脏器表面播散性种植,形成许多单一的、成熟的神经胶质结节,常伴发卵巢畸胎瘤,以未成熟卵巢畸胎瘤较多见,大部分预后良好。因其发病率极低,且表现为粟粒样播散种植,易被年轻医师误诊为原发肿瘤的恶性转移。本文回顾了皖南医学院附属弋矶山医院妇产科收治的1例卵巢成熟性畸胎瘤(mature teratoma,MT)合并GP的临床资料并结合文献复习,旨在探讨其临床特点、治疗及预后。
1 病例报告
患者 女,19岁,因下腹胀1个月余,于2017年9月23日收入皖南医学院附属弋矶山医院治疗,无恶心、呕吐、畏寒、发热等伴随症状,大小便正常。14岁月经初潮,平素月经规律,周期28 d,经期4~7 d,月经量偏多,伴大量血凝块,无痛经。未婚,有性生活史,否认其他慢性病史,否认既往手术史,妇科检查示右附件区触及一大小约15 cm×10 cm囊性包块,压痛(±)。入院后盆腔B型超声(B超)示:右侧卵巢显示不清,右侧附件区见一类圆形囊实性肿块,大小约147 mm×90 mm,边界清,包膜完整、清晰,部分呈不规则的团块状强回声,后部回声明显衰减,肿块周边及内部血管稀少,呈星点彩流,考虑右侧卵巢畸胎瘤可能性大;盆腔少量积液;子宫及左侧附件未见明显异常。腹部计算机断层扫描(CT)平扫示:盆腔内囊实性占位,考虑为畸胎瘤可能性大,未见其他明显异常(见图1,见封三)。肿瘤标志物检查示:CA125为456.80 U/mL,CA19-9为77.72 U/mL。初步诊断:右附件包块,考虑畸胎瘤可能性大。

图1 腹部CT平扫
排除手术禁忌证后于2017年9月28日行开腹探查术,术中见盆腔包块来源于右卵巢,肿物大小约15 cm×10 cm,囊实性,大网膜与包块粘连,粘连处大网膜质硬,大网膜上附着密集粟粒样小结节,子宫前壁浆膜层及左侧卵巢表面亦见散在结节,大小约0.3~2 cm,肝脏表面未见明显结节,肝周有淡黄色腹水。留取腹腔灌洗液后行右侧卵巢肿瘤切除+大网膜切除+左卵巢、子宫浆膜层结节活检术。术中快速病理示:①(右侧附件)成熟性囊实性畸胎瘤,见脑组织,瘤体直径约15 cm;经大量取材,未见未成熟的成分;②(左侧部分卵巢、大网膜及子宫浆膜面)腹膜神经胶质瘤病。标本肉眼所见:卵巢肿物大小约15 cm×10 cm,呈不规则椭圆形,包膜基本完整,表面凹凸不平,部分附着于大网膜,切面囊实性,部分区域见灰白色鱼肉状物,质软。大网膜表面可见散在灰白色粟粒样小结节,质韧,大小约0.3~2 cm。病理切片(HE染色)示:卵巢肿物由3个胚层组织组成,其中包含皮肤组织、呼吸道、消化道成份及大量神经胶质成份等,3个胚层均分化成熟(见图2,见封三)。腹腔散在粟粒样结节,镜检均为神经胶质组织,无明显异型性及核分裂象,边界清楚,无浸润,部分结节周围伴淋巴细胞浸润及纤维化(见图3,见封三)。腹腔灌洗液镜检亦未找见恶性肿瘤细胞。经充分取材,均未见未成熟原始神经管及幼稚性胚胎成分。GP的神经胶质结节免疫组织化学检查示:胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(+),性别决定相关转录因子2[SRY(sex determining region Y)-box 2,SOX2](+),Vimentin(+),S-100(+)。最终诊断:右卵巢MT合并GP。

图2 卵巢MT(HE×100)
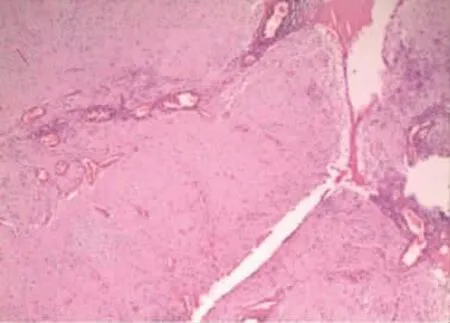
图3 腹膜神经胶质组织(HE×100)
患者术后1个月初次随访,CA125为50.53 U/mL,CA19-9为31.26 U/mL,3个月后复查 CA125为 23.57 U/mL,CA19-9为22.57 U/mL,行盆腔B超检查未见明显肿瘤残余。末次随访系术后1年,肿瘤标志物及腹盆腔B超均提示正常。该患者术后未进行任何治疗,目前状况良好,仍在继续随访中。
2 讨论
2.1 临床特点GP是一种罕见的卵巢畸胎瘤相关并发症,由Neuhäuser[1]于1906年首次报道,迄今仅记录了100余例,大部分合并未成熟卵巢畸胎瘤,少数罕见的GP病例报告的原发性畸胎瘤来源于胃、胆囊等[2],且有关于GP与妊娠和脑积水脑室-腹腔分流的个别报告,胶质结节大部分位于腹膜及盆腔器官表面,小部分病例位于肝脏表面,甚至转移至胸膜[3]。患者主要为女性,但也有1例男性GP患者的报道[4],发病年龄为大部分在10~20岁,最小年龄仅10个月,中位年龄是18岁。原发肿瘤多为巨大卵巢畸胎瘤,平均直径国内、外分别为20 cm和25 cm,胶质小灶大小0.5~3 cm。Yoon等[5]通过比较卵巢非成熟性畸胎瘤(ovarian immature teratoma,OIT)伴GP和OIT未伴GP,发现OIT伴GP的肿瘤直径更大。多数患者因腹部明显隆起或腹胀就诊,少数因肿瘤蒂扭转或破裂引起剧烈腹痛就诊。部分患者可伴有腹水及淋巴结累及,陶瑜等[6]报道的8例GP患者中有6例出现腹水,最多可达到2 000 mL,冯会敏等[7]报道的15例患者中有5例淋巴结中发现成熟神经胶质组织。GP通常无法在术前作出明确诊断,但CT可发现盆腔多个大小不等结节与子宫、腹膜、肠管等分界不清,伴对比增强,正电子发射计算机断层扫描(PET-CT)可显示同一部位有强烈的氟脱氧葡萄糖(fluorodeoxyglucose,FDG)积累[8],且在大部分患者中观察到的CA125水平升高,可能与存在大而广泛的肿瘤有关。卵巢畸胎瘤合并GP开腹后肉眼可见巨大原发肿瘤与周围组织粘连或有包膜撕裂,神经胶质结节粟粒样分布于大网膜或其他部位,结节界限清楚。胶质瘤病理通常为分化成熟的神经胶质细胞,无明显异型性及核分裂象,免疫组织化学结果显示GFAP阳性,证实组织是神经胶质来源,SOX2为阳性,八聚体结合转录因子4(octamer-binding transcription factor-4,OCT4)和胚胎干细胞特异性同源框蛋白(embryonic stem cell specific homeobox protein,NANOG)均为阴性,这些结果均提示GP通常有良好的预后[9]。
2.2 发病机制任何级别的卵巢畸胎瘤均可合并GP,但GP的病因尚不清楚,根据目前的文献报道,关于GP的发生机制主要有3种理论。第1种理论认为GP系原发畸胎瘤的包膜破裂致腹膜种植,或通过血管、淋巴管播散。因为部分GP仅在第2次手术中发现,在部分病例中,胶质结节常附着于与包膜缺损处相邻的网膜,在Robboy等[10]报道的12例病例中,有11例囊肿要么有撕裂,要么附着于网膜或附件。成熟的胶质组织出现在主动脉旁淋巴结和盆腔淋巴结中也提示病灶可通过淋巴扩散。第2种理论认为GP在遗传学上与畸胎瘤无关,而是来源于正常组织。Ferguson等[11]使用多态微卫星(Microsatellite,MS)位点来定位 GP的来源,研究显示胶质植入物和正常组织呈现杂合性,而畸胎瘤在相同的MS位点呈现纯合性。这些结果提示,GP中的胶质植入物与卵巢畸胎瘤无关,而是来自于正常细胞,如多能干细胞,其在畸胎瘤分泌的一些因子的刺激下,腹膜干细胞发生的胶质定向分化[9]。第3种理论认为GP系成熟胶质组织的挤压和扩散所致。部分GP病例发生于脑室-腹腔分流术后,考虑系神经胶质组织通过分流转移并植入腹膜,在没有卵巢肿瘤征象以及肿瘤标志物正常的情况下,神经胶质组织通过脑室分流被认为是导致患者并发GP的主要原因[12]。
2.3 转归及预后原发肿瘤的性质、分期、分级与GP的预后关系密切。目前认为GP的生物学行为大多为良性,Müller等[13]进行文献回顾发现,GP有3种不同的转归:第1种是GP无症状,直至2次手术才发现;第2种是GP可能经历“成纤维细胞转化”,并逐渐消失;第3种是极少部分GP可转化为恶性胶质肿瘤,如多形性胶质母细胞瘤或恶性神经外胚层肿瘤,此类转归常导致患者死亡。大多数关于GP的文献都是案例,目前只有6篇文献报道的病例超过5 例,包括 Norris等[14]报道的 7 例,Harms等[15]报道的13 例,Yoon 等[5]报道的 16 例,Bentivegna等[16]报道的9例,Liang等[9]报道的14例以及Wang等[17]报道的8例,这些病例均未发现关于GP的恶变。但Shefren等[18]曾报道过l例16岁GP患者,首次手术后5年GP转变为恶性神经胶质瘤病,另Dadmanesh等[19]报道了1例13岁GP患者,首次手术后8年GP转化为恶性神经外胚层肿瘤。在大多数病例中,广泛种植的胶质结节几乎不可能被完全切除,但这些病变可以在很长一段时间内完全静止。甚至有学者研究发现当OIT合并GP患者的腹膜种植病灶完全由成熟神经胶质组织组成时,甚至比OIT不伴有GP的预后更好[15]。虽然GP几乎不影响患者整体的生存时间,但GP与OIT患者的频繁复发及较短的无复发生存期相关[5]。一项由英国儿童癌症研究小组开展的针对儿童成熟和未成熟颅外畸胎瘤的大型研究显示,10例患有GP的OIT患者中有3例(30%)复发,而无GP的44例OIT患者中有仅2例(4.5%)复发[20],而Yoon等[5]研究的15例OIT合并GP患者中有6例(40%)复发,而对照组OIT未合并GP的27例患者中仅有1例(3.7%)复发,这也预示着GP可能是OIT患者频繁复发的不良预后因素。另外,在1年内复发的患者中,复发中多为未成熟畸胎瘤,且病理分级与原发肿瘤相同,而超过1年后复发的肿瘤可以为MT,说明未成熟畸胎瘤有向MT分化的趋势。
2.4 治疗及随访由于GP发病率极低,病例较少,目前缺乏统一的治疗标准。目前治疗的共识是在广泛取材均系成熟种植灶的情况下,根据原发肿瘤的性质、分期、分级决定治疗方案,而不是以胶质细胞植入物为主要方向。OIT合并GP患者以年轻女性及儿童较多见,除发生在儿童时期可呈现为良性生物学行为外,其原发肿瘤都为潜在恶性或恶性肿瘤,对于希望保留生育功能的OIT合并GP的年轻患者,不论期别早晚,只要子宫及对侧卵巢正常,均可进行保留生育功能的手术,即切除患侧附件及大网膜,且可仅对可疑淋巴结进行活检,无需进行盆腔淋巴结清扫术,术后根据肿瘤的分级选择合理的联合化疗,化疗方案以BEP方案多用。卵巢MT合并GP预后较好,在广泛取材,经病理检验未见不成熟组织的情况下,年轻患者可仅行卵巢肿瘤切除术+大网膜切除术,并对可疑淋巴结进行活检。神经胶质组织转移至淋巴结的病例极为罕见,但根据既往文献报道,淋巴结胶质瘤的预后良好,在排除转移成分含有不成熟组织后则无需进行辅助化疗[17]。因为腹膜胶质结节的广泛种植,完全切除病变组织通常是非常困难的,这也是其复发率较高的原因之一,此外,GP术后粘连发生率较高,所以术中需要更细致的操作以避免肿瘤破裂,防止粘连,减少复发[21]。
幸运的是,大部分残留的腹膜胶质结节可以长时间处于静止状态,但在罕见的情况下,极少部分的患者因残留病灶发生恶性转化而造成不良结果,因此,长期的术后随访是肯定的。但对于这些患者的随访时间没有明确的指导。参照2012欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)非上皮性卵巢癌临床实践指南:推荐在术后2年内每3个月1次随访,第3~5年每6个月1次,或至肿瘤进展;随访内容包括病史、体格检查、盆腔检查和肿瘤标志物。对保留生育功能的术后患者,每6个月接受1次盆腔超声检查,有临床指征时应行腹部和盆腔CT。有学者提出磁共振成像(MRI)和肿瘤标志物是一种安全有效的监测卵巢畸胎瘤和GP复发的方法[17],增强CT和FDG-PET-CT也可用于监测该疾病[8]。
综上所述,GP是一种临床罕见疾病,系成熟的胶质组织在腹膜表面种植,通常并发于任何级别的卵巢畸胎瘤。在广泛取材均系成熟种植灶的情况下,根据原发肿瘤的性质、分期、分级决定治疗方案。但由于成熟胶质组织的广泛种植,很难进行彻底切除。虽然大部分残留的腹膜胶质结节可以长时间处于静止状态,但有极少部分病灶有恶变可能,所以该疾病需要长期随访。

