应用蛋白质芯片CM10检测弱精子症患者精浆标志物
徐建新 吕胜启 朱 涛 方登攀
1.江汉大学附属医院泌尿外科(湖北武汉 430015),2.武汉大学人民医院泌尿外科(湖北武汉 430060),
弱精子症是男性不育最常见的疾病之一,但其发病机制尚不十分清楚,阻碍了弱精子症临床诊断和治疗的进展。蛋白质芯片可以筛选出生物标志物已经取得阶段性进展,因此针对精液异常的弱精子症患者,我们采用CM10芯片结合蛋白组学技术对精浆样本进行检测及统计分析,确立与弱精子症发病机制相关的重要蛋白,是探寻男性不育原因的一条新思路,这将为探讨弱精子症的诊疗研究提供重要依据。
资料和方法
一、临床资料
所有标本均于2017年3月~2017年12月取自江汉大学附属医院检验医学中心,按世界卫生组织诊断标准行3次精液常规分析后,选取结果符合弱精子症诊断标准者45例,为弱精子症(RJ)组,平均年龄33岁。对照组38例,年龄25-38岁,来源于正常健康男性自愿者捐献的精液标本,为正常(N)组;研究对象采集精液前禁欲5~7d,待标本完全液化后,按精子分析仪对标本进行检测,测定精液标本的颜色、pH值、精子计数、精子活力、液化时间、及畸形率等。精液标本放入无菌离心管中,离心分离精浆,取上层精浆标本1~3mL装入Ep管中,快速置入液氮冷冻保存。
二、研究方法
(一)精浆标本处理
从液氮罐中取出精液样品,冰冻精浆冰上融解;离心(42×g,4℃)5min,取上清液备用;取 20μl U9 缓冲液(1%DTT,9mol/L 尿素,2%CHAPS)加入 10μl精浆置入EP管中,并将样品充分混匀,冰浴振荡30min(500r/min); 在 160μl的 50mmol NaAC,pH4 结合缓冲液中加入40ul上述变性的样本,4℃保存备用。
(二)芯片处理
取出CM10的芯片,在芯片背后标记操作者的姓名、时间,芯片种类等资料,将芯片经10mol/LHCL活化处理10min,再用结合缓冲液(50mM NaAC,pH4.0)处理10min,将芯片装入生物芯片处理器。再用振荡器轻微震动芯片5min,甩掉缓冲液。重复上述操作一次。将100μl处理好的样品加入在芯片处理器每个孔中,置振荡器(MS1Minishaker)42×g,室温孵育 1h。
(三)上机检测
每孔加入50mmol/L NaAc结合缓冲液200ul,置振荡器(MS1 Minishaker)42×g震荡5min,取出芯片风干,每孔加入SPA饱和液0.5μl,5min后重复加入SPA饱和液0.5ul,芯片干燥后即可上机测定。
三、蛋白质指纹图谱
利用NP20芯片对TOF质谱仪进行校正,采用激光源强度为160,检测器灵敏度为8,真空度为8.387e-007 Torr,最高扫描分子质量Mr50000Da,最低分子质量为1000。所有芯片按照上述条件检测。
四、统计学处理
筛选符合正态分布的样本采用Ciphergen protein chin software分析两组样本的相关性,所有数据均经SPSSl6.0统计软件包处理,两组样本比较采用t检验,P<0.05时为差异有显著性。
结 果
用CM10芯片结合蛋白质芯片-飞行时间质谱技术对两组精浆样本进行比较分析,捕获两组标本的蛋白质指纹图谱。
在CM10蛋白质芯片上共检测到118种有差异的蛋白峰,弱精子症组较正常组有2处蛋白峰表达降低,差异有显著性(P<0.05),其中 M/Z 为 6811.14、15520.4;弱精子症组较正常组有2处蛋白峰表达增高,差异有显著性(P<0.05),M/Z 为 2760.30、14772.0,见表 1。

表1 弱精子症(RJ)组与正常(N)组精浆中差异蛋白质列表(x±s)

表2 CM10蛋白质芯片筛选到的弱精子症差异蛋白
讨 论
弱精子症是指精液参数中前向运动的精子(a和b级)小于50%或a级运动的精子小于25%的病症,故又称为精子活力低下。男性不育是严重的社会及医学问题[1],这一疾病严重困扰着患者和医生,而弱精子症是引起男性不育的重要因素之一,文献报道,因精子活力低下而导致的男性不育约占所有男性不育致病因素的50%[2]。弱精子症的发病机制十分复杂,涉及到精子运动结构和功能的异常、信号传导通路异常等因素。临床上弱精子症的治疗困扰着临床医师,各种经验性的治疗用来改善精子活力,但疗效甚微。研究发现,导致精子活力下降与蛋白质酪氨酸磷酸化、染色体异常、精浆异常、精索静脉曲张、内分泌因素、生殖道感染等很多因素相关[3,4]。精液质量与微量元素含量的变化有关,酶活性降低或酶类缺乏与精子运动也有关系,两者都可以引起精子受精能力低下。精子活力对于男性生育力的维持至关重要,但目前对于弱精子症患者精浆中蛋白质的变化及其生物学功能的基础研究甚少。
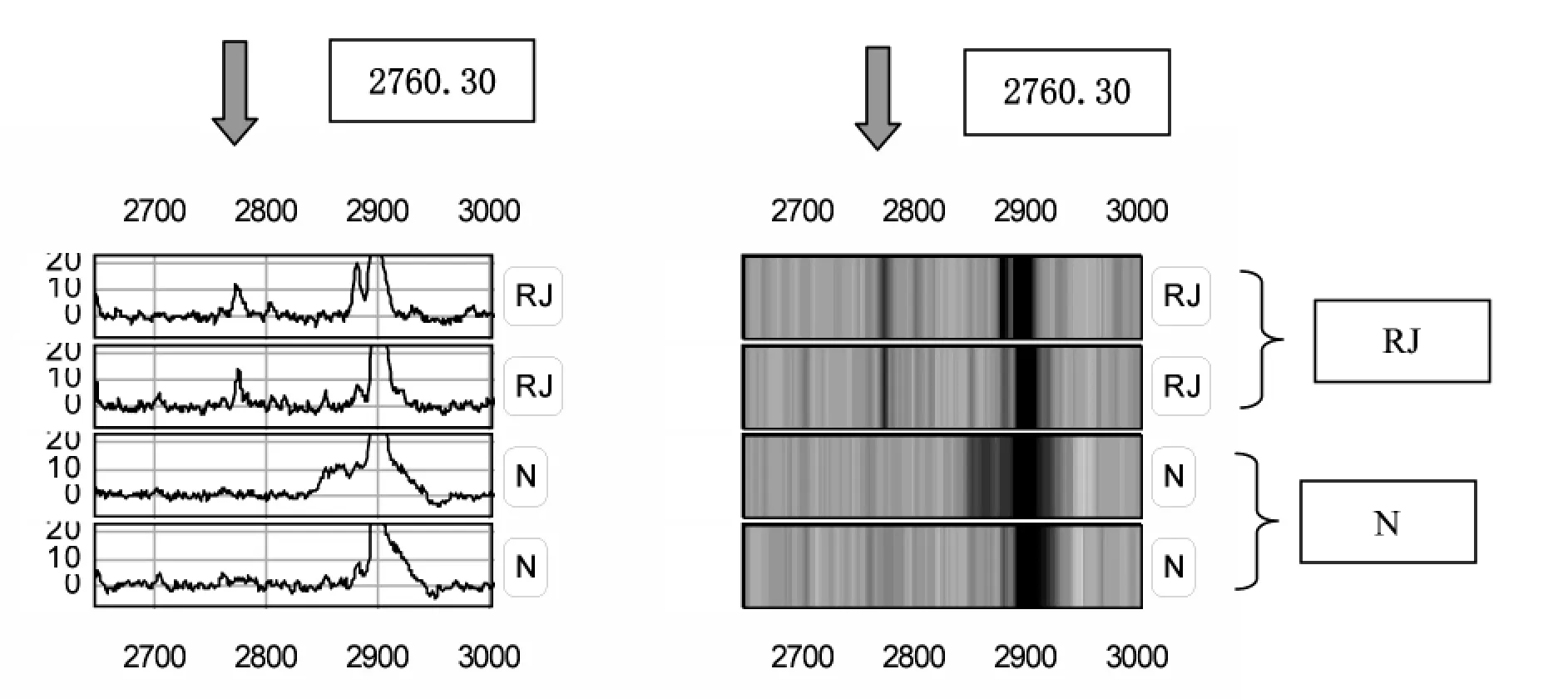
图1 差异蛋白的指纹图谱及差异蛋白凝胶状示意图(M/Z2760.30)
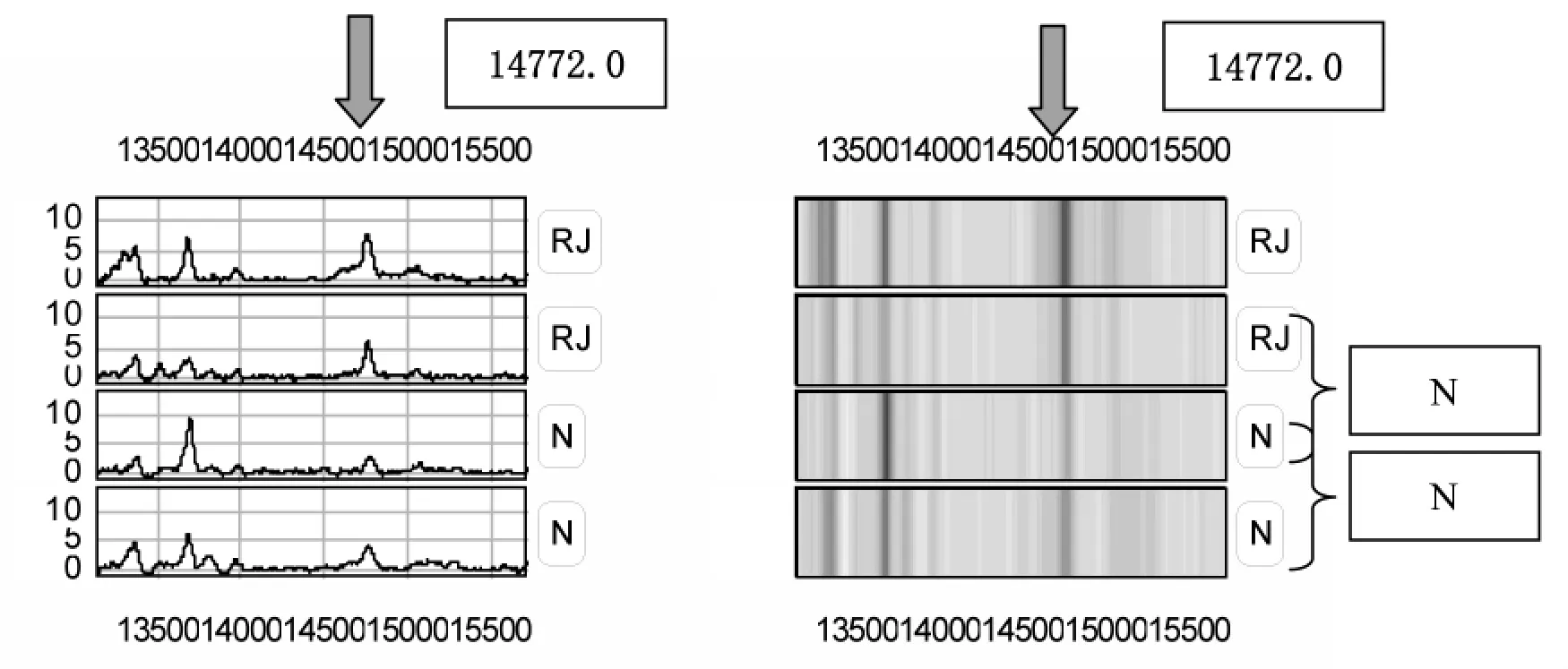
图2 差异蛋白的指纹图谱及差异蛋白凝胶状示意图(M/Z14772.0)
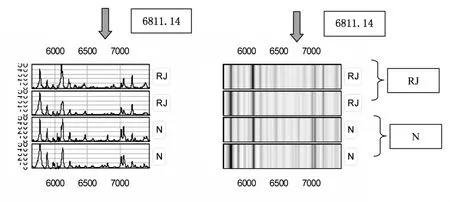
图3 差异蛋白的指纹图谱及差异蛋白凝胶状示意图(M/Z6811.14)
蛋白质芯片-飞行时间质谱技术(SELDI-TOF-MS)是一种对所有蛋白质进行分离、图谱化、鉴定,探寻疾病的生物标志物、药物靶点具有高度灵敏度、自动化、微型化的检测工具[5]。通过检测蛋白质的分子质量进而对蛋白质分子的修饰、蛋白质分子的鉴定来进行研究,可以探究蛋白质的细胞定位和信号传递与调控作用,阐明相关疾病的分子机制。运用蛋白组学技术对精浆中差异蛋白质进行研究,可以为精子的受精能力、发育、运动等相关研究提供有利线索,可望对于弱精子症的诊断和治疗提供新的思路。

图4 差异蛋白的指纹图谱及差异蛋白凝胶状示意图(M/Z15520.4)
目前,将蛋白质组学技术应用于男性不育的相关研究,可以筛查出差异表达蛋白用于疾病诊断、治疗和预防的标志物,并且收到较好效果。杨欢等应用H4蛋白质芯片检测少精子症患者的精浆,发现有1处蛋白峰明显降低,其相对分子量为M/Z11022.9,在SAX-2芯片上发现有1处蛋白质峰较正常生育男性精浆明显升高,其分子量为M/Z16751.6[6]。Kempisty等对100例弱精子症患者和70例正常生育男性精子中的PRM转入水平进行研究,发现弱精子症组PRM转入水平较正常组显著降低(P<0.01)[7]。景晓玮等利用聚合酶链式反应技术对弱精子症患者精子中GRISP2基因进行研究,并认为GRISP2蛋白及基因是进一步研究弱精子症的分子靶点[8]。Liu FJ等应用等利用SELDI-TOF-MS技术检测了年老及年轻患者弱精子症精液中PATE1蛋白质的差异性,发现PATE1蛋白是可能为弱精子症发病机制的一个靶点[9]。Smith等[10]报道精子特异性的硫氧还蛋白Txndc2、Txndc3在保护精子细胞免受氧化应激损伤的过程中起到关键作用。
我们采用CM10蛋白质芯片结合蛋白组学技术对正常生育男性和弱精子症患者的精浆蛋白质进行筛查,建立正常(N)组与弱精子症(RJ)组精浆差异蛋白凝胶状示意图及指纹图谱,并发掘弱精子症患者中特异性的蛋白质标志物。通过实验检测到118种有差异的蛋白峰和弱精子症相关,结果证实弱精子症组较正常组相比存在着差异蛋白质,捕获到的4种差异蛋白质有统计学意义,弱精子症组精浆较正常组蛋白质谱相比有两处蛋白质峰明显降低,其中M/Z为6811.14、15520.4,差异有显著性(P<0.05)。较正常组有2处蛋白峰明显增高,其分子量M/Z为2760.30、14772.0,差异有显著性(P<0.05);说明精浆中这些差异蛋白质的含量变化很可能与弱精子症的发病机制有着重要相关性,可以将这4种差异蛋白质作为弱精子症临床筛查的精浆标志物。其他学者也利用SELDI-TOF-MS技术筛查出了正常男性和弱精子症患者精浆蛋中的一些差异蛋白质,这些实验结果均有助于扩充蛋白质数据库,有助于对其发病机制的进一步研究[11]。
但是,目前我们还不能直接给出这些差异蛋白质的生物学功能和结构等信息,若对所测蛋白质进一步分离研究,搜索相关数据库,更深入的了解这些差异蛋白质的生物学功能本质,同时研究弱精子症的信号传导机制,最终有助于阐明弱精子症的发病机制,并可望对弱精子症的诊疗开辟新的途径。

