果皮中酚类物质含量、抗氧化活性及在体外消化过程中成分的变化
徐洪宇,蒯宜蕴,詹壮壮,董娟娥*
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100;2.吉林化工学院生物与食品工程学院,吉林 吉林 132022)
研究表明,机体内不稳定的活性氧能与生物大分子如蛋白质、脂质、脱氧核糖核酸及核糖核酸发生破坏性反应,导致细胞结构和组织损伤或基因突变。而植物中含有丰富的生物活性成分(如抗坏血酸、酚酸、类黄酮、单宁酸等)可抑制体内氧自由基和脂质过氧化物的反应,适当摄入水果和蔬菜可以降低因自由基引发的疾病,如心脑血管和某些类型癌症的发病率和死亡率[1-4]。相关研究报道,水果中占较大比重的果皮,因含有丰富的酚类物质而具有良好的抗氧化、抗炎和抑菌等活性,其活性与所含酚类物质含量呈正相关,具有很高的利用价值[5-6]。
然而,酚类等活性物质因其结构特点,在胃肠道消化过程中会发生降解或转化,致使肠道对其吸收较差,即生物利用率低。因此,研究酚类物质在胃肠道消化过程中的稳定性,有助于阐明酚类物质发挥生物学功能的作用机理。模拟消化研究中,体内消化即动物实验更确切、更贴近生理,但是耗时长、费用昂贵,且由于个体差异等原因会造成结果重复性较差,而体外模拟消化相较于动物实验具有简单、快速、成本低、重复性较高等优点[7]。Burgos-Edwards等[8]对生长在南美洲的一种小浆果进行体外模拟胃肠消化研究,结果表明,胃肠消化后总酚、总黄酮含量降低约50%,而花色苷类物质损失率达80%,在消化过程中,因酚类物质含量的降低,导致其抗氧化活性降低。而蜂蜜经体外模拟胃肠消化后,酚类物质呈现出高稳定性,因此蜂蜜中酚类物质的生物利用率高[9]。对石榴汁经体外模拟胃肠消化后其酚类物质稳定性和抗氧化活性的研究发现,体外模拟胃液消化后,总酚含量和总黄酮含量明显增加,但是经过体外模拟肠液消化后,酚类物质的含量明显下降[10]。
本研究以21 种果皮作为实验材料,对其总酚、总黄酮含量以及抗氧化活性进行检测,从中筛选出酚类物质含量高、抗氧化活性强的果皮;利用体外模拟胃肠消化,研究酚类物质在食用过程中的稳定性和生物利用率,运用超高效液相色谱-二极管阵列检测器/电喷雾飞行时间质谱(ultra performance liquid chromatographydiode array detector/electrospray ionization-time of fi ght-mass spectrometry,UPLC-DAD/ESI-TOF-MS)检测模拟消化前后酚类物质的变化,以期为功能性食品研制及综合开发果皮中活性物质提供一定的理论依据和科学指导。
1 材料与方法
1.1 材料与试剂
新鲜水果(火龙果、香蕉、橘子、香瓜、橙子、芒果、木瓜、哈密瓜、西瓜、菠萝、柠檬、山竹、猕猴桃、桂圆、葡萄、榴莲、菠萝蜜、石榴、百香果、荔枝、牛油果)购于吉林市大润发超市。
福林酚试剂 天津市大茂化学试剂厂;没食子酸、鞣酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 美国Sigma公司;2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)、芦丁(生化试剂) 国药集团化学试剂有限公司;胃蛋白酶 美国GenView公司;胰蛋白酶 北京鼎国昌盛生物技术有限责任公司;猪胆酸钠 上海如吉生物科技有限公司;MD44透析袋 北京索莱宝科技有限公司。
1.2 仪器与设备
WGLL-65BE型电热鼓风干燥箱、FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;FA1004A型电子天平、722S可见分光光度计 上海精天电子仪器有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;AcquityTMultra型UPLC仪(配备UPLC-Triple-TOF/MS系统) 美国Waters公司;Triple TOF 5600+型飞行时间质谱(配有电喷雾离子源) 美国AB SCIEX公司;Minispan离心机 德国Eppendorf公司;XS105分析天平瑞士Mettler Toledo公司。
1.3 方法
1.3.1 材料预处理
新鲜水果冲洗干净,去果肉,留皮,45 ℃下烘干,粉碎,过80 目筛,收集备用。
1.3.2 果皮提取物制备
称量烘干后的果皮粉各1.000 g,将各样品中加入15 mL体积分数为70%的乙醇溶液,超声提取30 min,收集提取液。按上述步骤进行3 次超声提取,将提取液旋蒸浓缩,用蒸馏水定容至50 mL。
1.3.3 果皮提取物中酚类物质含量测定
1.3.3.1 总酚含量测定
采用Folin-Ciocalteu测定法[11],分别取0.2 mL待测样品溶液于试管中,加入2.5 mL 0.1 mol/L的福林-酚试剂,5 min后加入2.5 mL 7.5 g/100 mL Na2CO3溶液,水浴30 min,取出于725 nm波长处测定吸光度(A725nm)。空白组以蒸馏水替代。每组平行测定3 次。以A725nm为纵坐标(y1),没食子酸质量浓度为横坐标(x1),绘制标准曲线,得到没食子酸标准曲线方程为y1=2.105 0x1+0.153 8(R2=0.999 2),根据标准曲线计算样品中总酚含量。
1.3.3.2 总黄酮含量测定
总黄酮含量测定采用许宗运等[12]的方法,略作修改。分别吸取0.5 mL待测样品溶液于试管中,加入2 mL蒸馏水及0.15 mL 5 g/100 mL NaNO2溶液,6 min后加入0.15 mL 10 g/100 mL Al(NO3)3溶液;6 min后再加入2 mL 1.0 mol/L NaOH溶液和0.2 mL蒸馏水,静置15 min,于510 nm波长处测吸光度(A510nm)。空白组以蒸馏水替代。以A510nm为纵坐标(y2)、芦丁标准品质量浓度为横坐标(x2),绘制标准曲线,得芦丁标准曲线方程为:y2=0.644 6x2+0.172 6(R2=0.999 1),根据标准曲线计算样品中总黄酮含量。
1.3.4 抗氧化活性测定
1.3.4.1 DPPH自由基清除能力测定
参照Hatano等[13]的方法,取1 mL不同质量浓度的果皮提取物,加入3 mL 0.2 mmol/L的DPPH乙醇溶液,混匀后加入4.0 mL乙醇,室温下避光反应30 min后于517 nm波长处测定吸光度(A517nm)。空白组以蒸馏水替代。按式(1)计算样品的DPPH自由基清除率。

式中:Ac1、As1分别为空白组和不同质量浓度样品组的A517nm。
1.3.4.2 ABTS阳离子自由基清除能力测定
参照Re等[14]的方法,略作修改。将10 mL 7 mmol/L的ABTS溶液与10 mL 2.45 mmol/L的过硫酸钾溶液混合,于室温、阴暗条件下静置14~16 h,使用前用0.2 mol/L磷酸盐缓冲液(pH 7.4)将其稀释至734 nm波长处的吸光度(A734nm)为0.72~1.20,即得到ABTS工作液。现配现用。
取不同质量浓度的果皮提取物各1 mL,加入ABTS工作液4 mL,反应6 min后于734 nm波长处测吸光度(A734nm)。空白组以蒸馏水替代。按式(2)计算样品的ABTS阳离子自由基清除率。
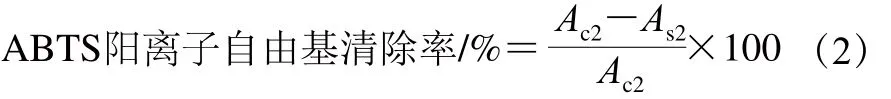
式中:Ac2、As2分别为空白组和不同质量浓度样品组的A734nm。
1.3.5 模拟体外消化
1.3.5.1 模拟胃液消化
采用Bouayed等[15]方法,分别于2 个100 mL具塞锥形瓶中加入25 mL 9 mg/mL NaCl溶液、6 mL 0.1 mol/L盐酸溶液、4 mL 4 mg/mL胃蛋白酶溶液(采用0.1 mol/L盐酸配制),混合均匀后,调节pH值至2.0~2.5。各加入(1.000 0±0.000 2)g样品,一份于37 ℃、100 r/min条件下水浴振荡,分别在0、1、2、3、4 h取上清液备用分析;另一份在胃液消化1 h后继续进行肠液消化。
1.3.5.2 模拟肠液消化
将1.3.5.1节胃消化液继续加入4 mL生理盐水、1 mL 0.5 mol/L NaHCO3溶液,调节pH值至7.5,于37 ℃、100 r/min条件下摇床振荡45 min,再加入18 mL模拟肠液(采用0.1 mol/L NaHCO3溶液配制胰液-胆汁混合液:2 mg/mL胰液、12 mg/mL胆汁),于37 ℃、100 r/min条件下摇床振荡,分别在1、2、3、4 h取上清液,备用分析。
1.3.5.3 人工肠液透析
透析袋剪取一定长度后用生理盐水将内外清洗干净,其中一端先用皮筋系紧,加入8 mL生理盐水和2 mL 0.5 mol/L NaHCO3溶液,系紧透析袋,另一端并放入1.3.5.1节模拟胃液消化液中,于37 ℃、100 r/min条件下摇床振荡45 min,调节pH值至6.5~7.0,透析袋外加入18 mL上述模拟肠液,于37 ℃、100 r/min条件下摇床振荡,分别于1、2、3 h取透析袋内液体和透析袋外上清液,备用。
1.3.5.4 生物利用率测定
生物利用率是指从食物中释放出来、在小肠壁的阻碍及选择透过作用下,可进入血液被人体吸收利用的营养物质占摄入食物总量的比例。按照式(3)计算各成分的生物利用率[16]。
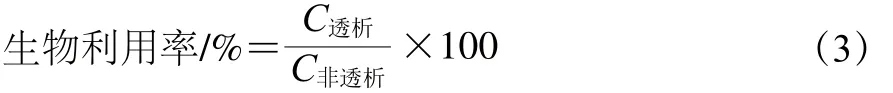
式中:C透析为该成分在透析袋内的含量/(mg/g);C非透析为该成分在透析袋内外的总含量/(mg/g)。
1.3.6 酚类物质分析
取10 mg样品溶解于1 mL甲醇中,超声10 min,10 000 r/min离心30 min,取上清液用于测试。
UPLC条件为:色谱柱:安捷伦ZORBAX-SB C18(100 mm×2.1mm,3.5 μm);以体积分数0.1%甲酸溶液为流动相A,0.1%甲酸-乙腈溶液为流动相B。线性梯度洗脱程序为:0 min,5%流动相B;2 min,5%流动相B;25 min,40%流动相B;33 min,95%流动相B;流速0.8 mL/min;柱温30 ℃;检测波长254 nm;进样量5 μL。
MS条件为:负离子扫描模式;扫描范围(m/z):100~1 500;雾化气压力:55 psi;气帘气压力:35 psi;离子源温度:550 ℃;离子源电压:-4 500 V。一级扫描:去簇电压:100 V;聚焦电压:10 V。二级扫描:使用TOF MS-Product Ion-IDA模式采集质谱数据,诱导碰撞解离能量分别为20、40、60 V,进样前采用校正液传送系统做质量轴校正,使质量轴误差小于2 mg/kg。
1.4 数据统计与分析
所有实验数据均为3 次重复实验结果的平均值。采用IBM SPSS Statistics 22软件处理数据,并用方差分析进行最小显著性差异法多重差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 果皮提取物中酚类物质含量分析
由图1可知,选取的21 种果皮中总酚和总黄酮含量差异明显。总酚含量范围为(1.12±0.70)~(58.09±0.46)mg/g,其中石榴皮中总酚含量最高,其次是山竹皮((52.09±1.52)mg/g),菠萝蜜皮中总酚含量最低;总黄酮含量范围为(1.01±0.04)~(47.50±0.39)mg/g,其中总黄酮含量最高的是石榴皮,山竹皮总黄酮含量次之,为(36.07±0.46)mg/g,含量最低的为柠檬皮。
本实验中测定的石榴皮中总酚含量与胡淳淳[17]测定的单瓣红果石榴皮中总酚含量(58.43 mg/g)相似,同时其所测定的11 个品种的石榴果皮中总黄酮含量范围为(4.43~9.32 mg/g),明显低于本实验所测得的数值,说明石榴品种和产地的不同,果皮中酚类物质含量差异较大。陈海光等[18]测得山竹皮中总酚含量为20.4 mg/g,明显低于本实验所测得的数值,产生明显差异的原因可能是提取溶剂不同以及其总酚含量以鲜质量计量。山竹皮中总黄酮含量明显低于张泽生等[19]采用体积分数95%乙醇提取酚类物质所测得的总黄酮含量(80 mg/g)。可见,不同的提取溶剂对酚类物质的提取效果有明显影响。

图1 21 种果皮中总酚和总黄酮含量Fig. 1 Contents of total phenolic components and total flavonoids in 21 fruit peels
综上,选取酚类物质含量较高的石榴和山竹果皮进行抗氧化活性分析以及后续的模拟胃肠液消化及成分鉴定。
2.2 石榴皮和山竹皮提取物的抗氧化活性

图2 石榴皮和山竹皮提取物的抗氧化活性Fig. 2 Antioxidant activity of pomegranate peel and mangosteen peel extracts
以BHT为对照,测定石榴皮和山竹皮提取物对DPPH自由基和ABTS阳离子自由基清除能力。由图2A可知,在5~55 μg/mL范围内,3 组样品对DPPH自由基清除率随着质量浓度的增加而增加,且清除能力为BHT>石榴皮提取物>山竹皮提取物。计算DPPH自由基清除率的半抑制浓度(half maximal inhibitory concentration,IC50),得到山竹皮提取物IC50为16.4 μg/mL,石榴皮提取物IC50为12.3 μg/mL。质量浓度在15~55 μg/mL范围内时,石榴皮提取物与BHT的DPPH自由基清除能力接近。李国秀等[20]测得石榴皮多酚(1~30 mg/L)对DPPH自由基具有较强的清除能力,其IC50为5.33 mg/L,而陶钰等[21]得到山竹对DPPH自由基清除能力的IC50为32.5 μg/L,均明显不同于本实验结果,产生差异的原因可能是本实验中为样品未经过纯化的粗提物,其中含有不具有抗氧化活性的物质。由图2B可知,随着质量浓度(8~88 μg/mL)的增加,BHT、石榴皮及山竹皮提取物的ABTS阳离子自由基清除能力不断增强,且清除能力为BHT>石榴皮提取物>山竹皮提取物。计算得到ABTS阳离子自由基清除率的IC50分别为:山竹皮提取物45.9 μg/mL、石榴皮提取物20.4 μg/mL,说明石榴皮提取物中清除ABTS阳离子自由基的活性物质含量较高。质量浓度在24~88 μg/mL范围内时,石榴皮提取物对ABTS阳离子自由基的清除率成一定的剂量-效应关系,超过40 μg/mL后其对ABTS阳离子自由基清除率的增长趋于平缓,且此时与BHT清除能力接近。
通过上述分析可知,石榴皮提取物中酚类物质含量及抗氧化活性均强于山竹皮提取物,因此,选取石榴皮提取物为研究体外模拟胃肠消化材料,探究其经过模拟胃肠液消化后酚类化合物的释放量,并通过透析袋模拟肠道的吸收作用考察其生物利用率。
2.3 模拟胃肠道消化时间对石榴皮提取物中酚类物质释放量的影响


图3 模拟胃肠液消化时间对石榴皮提取物中酚类物质释放量的影响Fig. 3 Effect of simulated gastrointestinal digestion time on the release of phenolic compounds from pomegranate peel extract
石榴皮提取物在模拟胃液、肠液消化过程中总酚释放量随消化时间变化情况如图3A、C所示。模拟胃液消化0~4 h内,总酚释放量呈增加趋势。消化前3 h总酚释放量增长较缓慢,3~4 h时出现明显加快,4 h时达到(12.86±0.15)mg/g,比消化0 h时增加13%。在模拟肠液消化中总酚释放量呈先增加后减少趋势,在2 h时达到最大释放量((2.54±0.02)mg/g),2 h后总酚释放量开始下降,在4 h时下降至(2.34±0.03)mg/g。
石榴皮提取物在模拟胃液、肠液消化中总黄酮释放量随消化时间变化情况如图3B、D所示。模拟胃液消化0~4 h内,总黄酮释放量随消化时间延长呈增加趋势,在4 h时达到(4.48±0.04)mg/g,比消化0 h时增加10.62%。在模拟肠液消化过程中,总黄酮释放量呈先增加后减少趋势,在3 h时达到最大释放量((1.15±0.01)mg/g)。
本实验在模拟胃液消化过程中,石榴皮提取物中总酚、总黄酮释放量均随时间延长呈增加趋势,4 h时达到最大释放量,与熊云霞[22]研究苹果皮在模拟胃液消化中总酚和总黄酮释放量情况一致。酚类物质释放量的增加,表明酸性环境破坏了酚类物质与蛋白质、多糖之间的氢键和疏水键,使酚类复合物分解,酚类物质被释放,同时酚-蛋白质复合物中的蛋白质在胃蛋白酶的作用下水解,酚类物质失去束缚导致释放量增加。与模拟胃液消化阶段相比,石榴皮提取物中总酚、总黄酮释放量在模拟肠液消化阶段明显降低,这与Mosele[23]、Lucas-Gonzalez[24]等研究结果一致。模拟胃液消化阶段,胃液呈强酸性,具有较低的pH值,而模拟肠液消化阶段,肠液为碱性,因自身结构特点,酚类物质在酸性环境中结构稳定,而在碱性环境中易发生聚合或降解,使其含量减少[25-27]。石榴皮提取物中总酚、总黄酮释放量在模拟肠液消化中均随时间延长呈先增加后降低的趋势,但二者达到最大释放量时间不同,总酚在2 h时达到最大释放量,总黄酮在3 h时达到最大释放量,这可能与肠液消化过程中所处的碱性环境或在消化酶的作用下,酚类物质的结构发生重组或降解有关,致使总酚、总黄酮含量在不同消化时间发生变化[15-16]。
2.4 模拟胃肠液消化后石榴皮提取物中酚类物质的生物利用率

图4 果皮提取物中酚类物质生物利用率Fig. 4 Bioavailability of phenolic compounds in peel extract
在体外模拟胃肠液消化实验中,使用透析袋来模拟小肠上皮细胞对酚类物质的吸收阻碍作用,从而得到酚类物质的生物利用率[28]。由图4可知,总酚、总黄酮的生物利用率均随消化时间的延长而逐渐增加,且在每个时间点总酚的生物利用率(依次为21.67%、26.77%、31.89%)均强于总黄酮的生物利用率(依次为4.05%、14.40%、27.98%),即透析袋内以酚类化合物为主,可推测人体对多酚类化合物的吸收较多,但石榴皮提取物中酚类物质的生物利用率均低于32%,可能是由于在肠道内的弱碱性条件下酚类物质与其他化合物聚合形成大分子物质,难以通过透析袋而导致的[29]。本实验中消化2 h时总酚生物利用率(26.77%)比谭畅[30]报道的紫薯中总酚生物利用率((18.42±0.33)%)高1.45 倍,而实验中消化2 h时总黄酮生物利用率(14.40%)与其报道的紫薯中总黄酮生物利用率((15.00±0.21)%)相近。可见体外模拟小肠吸收时,消化2 h时石榴皮与紫薯中总酚的生物利用率不同,但总黄酮的生物利用率接近。
2.5 石榴皮提取物中多酚的组成分析
利用UPLC-DAD/ESI-TOF-MS方法对模拟胃肠液消化前后石榴皮提取物中的化学成分进行分析,由图5和表1可知,根据所得的母离子峰、主要碎片峰的MS分析、保留时间以及参考文献[31-32],对其酚类物质中含量较高的化合物进行结构鉴定,确定了α-安石榴苷、β-安石榴苷、鞣花酸己糖苷、鞣花酸脱氧己糖苷及鞣花酸共5 种酚类化合物。化合物1(保留时间6.312 4 min)、2(保留时间7.604 5 min)的母离子[M-H]-分别为1 083.055 8、1 083.055 9,经分析MS/MS裂解图谱、保留时间及查阅文献[33]发现,两者为同分异构体,分别为α-安石榴苷、β-安石榴苷,存在的碎片离子781.056 9( [α-安石榴林—H]-)、781.057 3([β-安石榴—H]-)为化合物1、2去掉一个鞣花酸的离子峰[M—H—302]-。化合物3保留时间为10.138 1 min,母离子[M—H]-为463.049 9,含有m/z为300.999 1、270.988 1等碎片峰,推测该物质含有鞣花酸结构,其中m/z为300.999 1的碎片峰是该物质去掉一个六碳糖基的离子峰[M—H—162]-,因此,该化合物鉴定为鞣花酸己糖苷。化合物4的保留时间为12.338 9 min,母离子[M—H]-为447.055 1,存在碎片离子300.998 5( [鞣花酸—H]-)、271.060 2([鞣花酸—CO—H]-),由化合物3可知,化合物4为化合物3脱去六碳糖基上的一个氧,因此化合物4为鞣花酸脱氧己糖苷。化合物5的保留时间为12.924 4 min,母离子[M—H]-为300.998 7,含有m/z为229.013 4、185.023 2、145.028 9等碎片峰,确定该物质为鞣花酸。
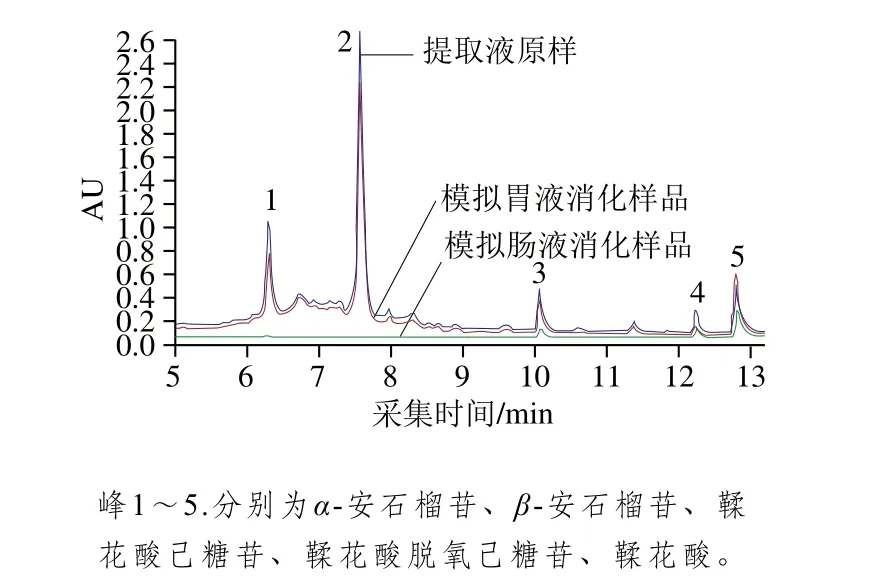
图5 石榴皮提取物中多酚经胃肠消化后的UPLC图谱变化Fig. 5 UPLC chromatogram of polyphenols in pomegranate peel extract after simulated gastrointestinal digestion

表1 石榴皮提取物中多酚经胃肠消化后的组分变化Table 1 Changes in pomegranate peel polyphenols after simulated gastrointestinal digestion
根据MS峰面积对石榴皮提取物中酚类物质在模拟胃液、肠液消化后进行定量分析,从而得到模拟胃肠消化中多酚类化合物含量的变化。由表1可知,与未经消化时相比,鉴定出的5 个酚类物质在模拟胃液消化阶段,除鞣花酸的含量增加外,其余酚类物质含量均降低,损失率大小为:鞣花酸脱氧己糖苷(60.63%)>α-安石榴苷(20.98%)>鞣花酸己糖苷(7.20%)>β-安石榴苷(6.06%)。鞣花酸脱氧己糖苷的损失率了达到60.63%,而鞣花酸的损失率为-34.93%,可见在模拟胃液消化阶段鞣花酸脱氧己糖苷中鞣花酸与脱氧己糖连接的糖苷键断裂,从而使其含量明显降低,鞣花酸含量增加,而鞣花酸等酚酸类化合物在酸性胃液中结构较稳定,其含量变化较小。相关研究报道,酸性胃液和胃蛋白酶的相互作用促进了聚合多酚水解为单体酚类化合物,单体酚类在酸性条件下结构稳定[34-35]。经过模拟肠液消化后,5 种酚类物质的含量下降明显,其中α-安石榴苷(损失率98.90%)和β-安石榴苷(损失率99.70%)的含量下降尤为显著,这是因为α-安石榴苷和β-安石榴苷中含有的酚羟基在碱性环境中反应生成酚醛类物质,而酚醛类物质因其结构特点很容易与其他物质相互作用被降解[29,36]。
3 结 论
在测定的21 种果皮中,石榴皮中含有丰富的酚类物质,并具有较强的抗氧化活性;体外模拟胃肠消化过程中,相较于肠液消化过程的高损失率,石榴皮提取物中酚类物质在胃液消化过程存在较稳定;总酚的生物利用率高于总黄酮;利用UPLC-DAD/ESI-TOF-MS方法鉴定石榴皮提取物中含量较高的5 种酚类化合物(α-安石榴苷、β-安石榴苷、鞣花酸己糖苷、鞣花酸脱氧己糖苷及鞣花酸)在胃肠消化过程中的变化,可知胃液消化过程中各酚类化合物损失率小,且部分酚类化合物转化为鞣花酸,但在肠液消化阶段各酚类物质损失率均在60%以上,进一步说明石榴皮提取物中酚类物质在酸性环境中结构稳定。

