茉莉酸甲酯处理对猕猴桃软腐病菌作用机制及果实品质的影响
黎晓茜,龙友华,2,*,尹显慧,2,吴小毛,2,赵志博,樊 荣,莫飞旭,蒋艳玲,黄亚欣,唐靖文
(1.贵州大学农学院,贵州 贵阳 550025;2.贵州大学作物保护研究所,贵州 贵阳 550025;3.修文县猕猴桃产业发展局,贵州 贵阳 550200)
猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物的浆果果实,富含VC、多种矿物、氨基酸等营养物质,是三大新兴水果之一[1-3]。近年来,猕猴桃软腐病发生较为严重,造成采前落果、贮藏期果实腐烂率升高,严重影响猕猴桃果实品质及市场销售[4]。猕猴桃软腐病主要由葡萄座腔菌(Botryosphaeria dothidea)、拟茎点霉菌(Phomopsis sp.)等真菌单独或复合侵染引起[4-6];周游[7]研究发现B. dothidea、可可毛色二孢(Lasiodiplodia theobroma)和小新壳梭孢(Neofusicoccum parvum)可引起猕猴桃软腐;Lee[8]、Thomidis[9]等研究表明间座壳属(Diaporthe sp.)真菌亦能引起猕猴桃软腐病。目前猕猴桃软腐病的防治研究以化学防治和生防菌株筛选为主[10-12],长期施用化学农药容易使真菌产生抗药性,破坏生态环境安全及影响农产品质量安全;生防菌株对贮藏期果实防治效果较好,但田间施用限制因素较多,防控效果往往不稳定;因此,迫切需要开发利用绿色、安全、高效的植物源药剂防控猕猴桃软腐病[13]。
茉莉酸甲酯(methyl jasmonate,MeJA)作为植物体内的一种天然化学物质,可调节植物的生长发育,诱导植物防御性基因表达[14-16]。目前MeJA已广泛应用于苹果[17]、梨[18]、桃[19]、芒果[20]、辣椒[21]、番茄[22]、小麦[23]等农林经济作物的病害防控,也能有效地控制一些果蔬的釆后真菌性病害[24-25],改善果实品质[26]。MeJA可诱导寄主植物产生一系列防御反应,例如诱导病害防御基因的表达,诱导几丁质酶、β-1,3-葡聚糖酶等植物防御酶活力的提高,以及植保素的合成等[27-32]。还有研究表明,MeJA可以提高果实中的蛋白质和糖含量[33-34]。但目前尚不清楚MeJA能否有效防控猕猴桃软腐病、是否影响猕猴桃果实产量和品质。
本研究利用不同浓度的MeJA处理猕猴桃软腐病致病菌葡萄座腔菌,通过检测菌丝的电导率、蛋白质和核酸外渗、细胞壁主要酶活力以及细胞结构变化等方面,探究MeJA对猕猴桃软腐病菌的抑制活性及相关机制;使用0.50 mmol/L MeJA处理不同生长期的猕猴桃果实,探究MeJA对猕猴桃软腐病防控效果及其对果实品质的影响,以期为葡萄座腔菌引起的猕猴桃软腐病的绿色防控提供参考。
1 材料与方法
1.1 材料与试剂
B. dothidea菌种由贵州大学农产品质量安全实验室提供。
以选取种植于贵州省修文县久长镇和小菁乡实验基地的‘贵长’猕猴桃为供试品种,树龄4 年,‘T’型架栽培,树势整齐一致,除实验处理的差异外,其他农事操作、管理水平均一致,在果实采收期,选择晴朗天气时集中采收。
MeJA(纯度≥95%)、N-乙酰-D-氨基葡萄糖、Tris-HCl缓冲液(pH 7.5)、醋酸钠缓冲液(pH 5.0)、昆布多糖 北京索莱宝科技有限公司;质量分数0.3%四霉素水剂 辽宁微科生物有限公司;几丁质粉上海生工生物工程有限公司;二甲胺基甲硼烷(dimethylaminoborane,DMAB) 上海百舜生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS) 国药集团化学试剂有限公司。
1.2 仪器与设备
SW-CJ-1BU型洁净工作台 苏州安泰空气技术有限公司;生物显微镜 宁波舜宇仪器有限公司;DDSJ-319L型电导率仪 上海仪电科学仪器股份有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;GY-4数显式果实硬度计 乐清市艾德堡仪器有限公司;PAL-1型折光仪 北京阳光亿事达贸易有限公司。
1.3 方法
1.3.1 MeJA处理对猕猴桃软腐病葡萄座腔菌的作用机制
1.3.1.1 MeJA对葡萄座腔菌室内毒力测定
采用菌丝生长速率抑制法[35],先将MeJA配制成浓度为0(对照)、0.50、1.00、2.00、4.00、8.00 mmol/L的母液,再以母液、培养基体积比1∶9制成含0(对照)、0.05、0.10、0.20、0.40、0.80 mmol/L MeJA的PDA平板。利用打孔器打取直径5 mm、培养4 d后的新鲜菌饼,置于含不同浓度MeJA的PDA平板中央,每培养皿接1 个菌饼,每个处理组4 次重复。接菌后将PDA平板置入28 ℃培养箱培养。待对照平板菌落直径长至5~6 cm,利用十字交叉法测量菌落直径,按式(1)计算抑菌率。根据抑菌率及药剂浓度之间的线性关系计算得出毒力回归方程、相关系数及有效抑制中浓度(concentration for 50% of maximal effect,EC50)。

1.3.1.2 细胞膜通透性的测定
真菌细胞膜受到抑菌剂的破坏时,菌体的天然屏障被打破,使其细胞内含物质渗出,从而导致菌体培养液的电导率上升;因此菌体培养液相对电导率的改变、内含物质的相对泄漏度可作为反映真菌细胞膜的通透性重要指标[36-37]。本研究采用电导率法[38]测定不同浓度MeJA对葡萄座腔菌细胞膜通透性的影响。在PD培养液中接入1 块直径为5 mm的葡萄座腔菌菌饼,于28 ℃下静置培养7 d。从中挑出菌丝球,用蒸馏水洗涤数次,5 000 r/min离心10 min,滤纸吸干水分,称取菌丝0.8 g放入装有20 mL浓度分别为0(对照)、0.05、0.10、0.20、0.40、0.80 mmol/L MeJA溶液的离心管中混匀,每个处理3 次重复。分别在混匀后0、1、3、6、12、24、48 h利用电导仪测定培养液电导率,并按式(2)计算相对电导率;取2.0 mL培养液,5 000 r/min离心5 min,测定上清液在280 nm(蛋白质)和260 nm(核酸)波长处的吸光度,按式(3)计算细胞蛋白质和核酸类物质相对泄漏度[38]。

1.3.1.3 扫描电子显微镜及透射电子显微镜观察菌丝超微形态及结构
分别从含有0(对照)、0.80 mmol/L MeJA的PDA培养基上生长的葡萄座腔菌菌落边缘取直径为5 mm的菌饼。扫描电子显微镜组以质量分数2.5%戊二醛固定液(50 mL磷酸盐缓冲液(pH 7.4)加10 mL质量分数25%戊二醛溶液蒸馏水定容至100 mL,下同)4 ℃固定12 h,然后用磷酸盐缓冲液(pH 7.4)冲洗3 次,每次15 min,乙醇(体积分数30%、50%、70%、80%、90%)逐级洗脱,叔丁醇与无水乙醇按体积比1∶3、1∶1、3∶1逐级洗脱,每次10 min,再经过干燥、粘样、镀膜,于扫描电子显微镜下观察拍片。
透射电子显微镜组以质量分数2.5%戊二醛固定液固定12 h,质量分数1%锇酸固定液固定2~3 h,乙醇(体积分数30%、50%、70%、80%、90%)逐级梯度脱水,纯丙酮、包埋液(体积比2∶1)进行包埋处理,质量分数3%醋酸铀-枸橼酸铅双染色法染色后,对切片进行透射电子显微镜观察并拍照,每个样品至少观察10 份超薄切片[38]。
1.3.1.4 葡萄座腔菌几丁质酶活力的测定
取1.3.1.2节培养的病原菌菌丝体,5 000 r/min离心5 min,将沉淀转入研钵中,加Tris-HCl缓冲液(0.05 mol/L,pH 7.5),液氮研磨破碎,转入离心管中,生物显微镜观察,无完整细胞后,4 ℃、5 000 r/min离心15 min,上清液即为粗酶提取液。取两支离心管,分别取200 μL粗酶液(以先煮沸5 min粗酶液作为对照)与200 μL胶状几丁质混匀后,37 ℃下保温1 h,加入200 μL硼酸钾(0.8 mol/L),沸水浴5 min,冷却,加3 mL质量浓度1 g/100 mL DMAB溶液,37 ℃保温20 min,冷却,测定544 nm波长处吸光度,同时以N-乙酰-D-氨基葡萄糖绘制标准曲线,每分钟催化生成1 μg N-乙酰-D-氨基葡萄糖时所用酶量定义为1 个酶活力单位(U)[39]。
1.3.1.5 葡萄座腔菌β-1,3-葡聚糖酶活力的测定
取1.3.1.2节培养的病原菌菌丝体,5 000 r/min离心5 min,弃上清液。称取0.3 g菌丝,用液氮研磨后加入1 mL 0.05 mol/L醋酸钠缓冲液(pH 5.0)转入离心管。4 ℃、5 000 r/min离心20 min,上清液蒸馏水透析4 h,在4 ℃下二次水透析12 h后,即为粗酶提取液。取100 μL粗酶液(以加入100 μL沸水浴处理10 min的粗酶液为对照),加入质量浓度0.1 g/100 mL昆布多糖溶液400 μL,40 ℃水浴30 min,然后加入2 mL DNS,沸水浴10 min,立刻用流动水冷却,用紫外-可见分光光度计测530 nm波长处吸光度,利用葡萄糖标准曲线计算β-1,3-葡聚糖酶活力,每分钟催化昆布多糖产生1 μg葡萄糖所需的酶量为1 个酶活力单位(U)[40]。
1.3.2 MeJA处理对猕猴桃软腐病防控效果和果实品质的影响
1.3.2.1 田间实验设计
田间实验选择两个实验基地,分别为贵州修文县久长镇茶山村绿园猕猴桃种植基地(果园1)和贵州省修文县小菁乡农业科技实验示范基地(果园2)。果园1:平均海拔为1 395 m,亚热带季风性湿润气候,年平均气温12.8 ℃,降雨量1 180 mm;果园2:平均海拔1 320 m,年平均气温13.6 ℃,降雨量1 185.8 mm。两个果园的土壤均为黄棕壤。
采用随机区组设计,处理A:幼果期(7月18日)喷施0.50 mmol/L MeJA水溶液(含质量分数0.1% Tween-80以增加MeJA的溶解,下同);处理B:壮果期(8月20日)喷施0.50 mmol/L MeJA水溶液;处理C:壮果期0.50 mmol/L MeJA水溶液进行浸果;处理D:幼果期、壮果期分别喷施0.50 mmol/L MeJA水溶液;CK1:壮果期喷施3.00 mg/L 0.3%四霉素水剂;CK2:喷施0.1% Tween-80溶液,每处理重复3 次。2 个果园均以此设计进行实验。果实按小区采收,每小区100 个果,常温(25 ℃)条件下贮藏直至果实完全软化。
1.3.2.2 发病率、病情指数、防效的测定
果实软腐病病害发生调查参照张承等[41]的方法。分级标准为:0级,未发病;1级,0 cm<病斑直径≤1 cm;2级,1 cm<病斑直径≤2 cm;3级,2 cm<病斑直径≤3 cm;4级,3 cm<病斑直径≤4 cm;5级,4 cm<病斑直径≤5 cm;6级,病斑直径>5 cm。分别按式(4)~(6)计算发病率、病情指数和防效。

1.3.2.3 果实品质及贮藏性能测定
果实品质测定参照张承等[41]研究方法。利用分析天平测定单果质量,利用游标卡尺测定单果横径(赤道长轴)、纵径(果蒂至果脐距离)、侧径(赤道短轴);利用PAL-1型折射仪测定果实中可溶性固形物质量分数;可溶性糖质量分数采用蒽酮比色法测定;VC含量用2,6-二氯靛酚滴定法测定;可滴定酸质量分数采用酸碱滴定法测定;叶绿素采用体积分数98%乙醇提取,其含量采用紫外-可见分光光度计法测定;可溶性蛋白含量采用考马斯亮蓝染色法测定;硬度采用GY-4数显式果实硬度计测定;质量损失率采用称质量法测定,并按式(7)进行计算。

1.4 数据统计分析
基础数据采用Microsoft Office 2010软件进行统计分析并作图,采用DPS 7.05数据处理系统计算杀菌剂的毒力回归方程、EC50及95%置信限,应用Duncan's新复极差法进行差异性分析(P<0.05为差异显著;P<0.01为差异极显著)。
2 结果与分析
2.1 MeJA对葡萄座腔菌的抑菌活性
2.1.1 MeJA对葡萄座腔菌抑菌率的影响
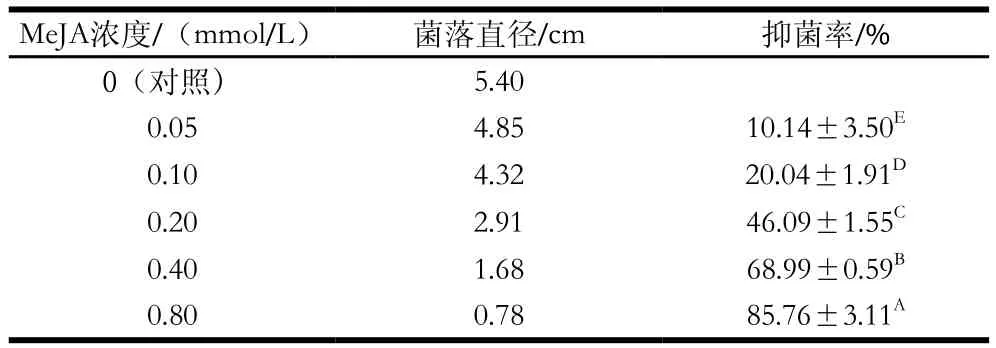
表1 MeJA对葡萄座腔菌的抑菌率Table 1 Inhibition rate of MeJA against Botryosphaeria dothidea
由表1可知,MeJA对葡萄座腔菌菌丝生长有明显的抑制作用,培养4 d后随着MeJA浓度的升高菌落直径逐渐减小,抑菌率呈极显著增加趋势(P<0.01),说明在0~0.80 mmol/L范围内,MeJA浓度越高,对猕猴桃软腐病菌葡萄座腔菌抑制效果越好。计算MeJA对葡萄座腔菌的毒力回归方程为y=6.272 05+2.009 16x,EC50为0.232 7 mmol/L,R2为0.997 6,95%置信限为(0.055 4,0.977 9)。
2.1.2 MeJA对葡萄座腔菌细胞膜通透性的影响
2.1.2.1 MeJA对葡萄座腔菌菌丝相对电导率的影响
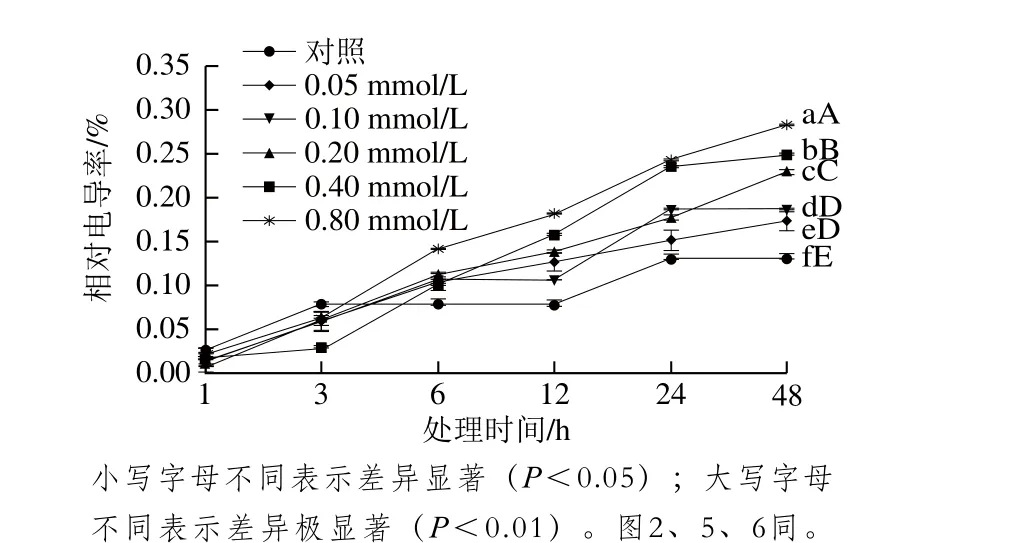
图1 MeJA对葡萄座腔菌相对电导率的影响Fig. 1 Effect of MeJA on the relative conductivity of Botryosphaeria dothidea
从图1可以看出,随着MeJA处理时间延长和浓度升高,葡萄座腔菌相对电导率呈增加趋势。在6 h后相对电导率差异较明显,处理48 h后,0.05、0.10、0.20、0.40、0.80 mmol/L处理组葡萄座腔菌相对电导率分别比对照组高32.83%、42.78%、75.23%、89.89%、117.63%,同对照组相比,差异达极显著水平(P<0.01)。表明MeJA可破坏葡萄座腔菌细胞膜稳定性,且随MeJA浓度的升高和处理时间的延长,MeJA对葡萄座腔菌细胞膜破坏程度增强。
2.1.2.2 MeJA对葡萄座腔菌细胞蛋白质和核酸类物质外渗的影响
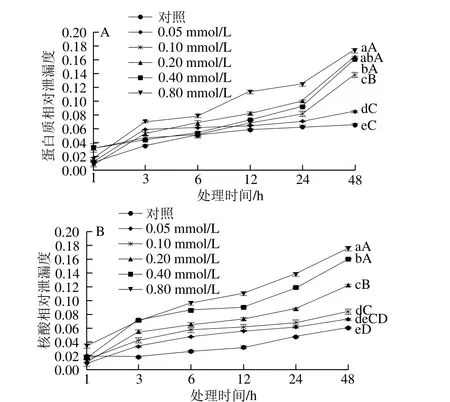
图2 MeJA对葡萄座腔菌菌丝蛋白质(A)和核酸类物质(B)相对泄漏度的影响Fig. 2 Effect of MeJA on leakage of protein (A) and nucleic acid (B)from Botryosphaeria dothidea mycelia
由图2A、B可知,随着MeJA浓度的升高和处理时间的延长,葡萄座腔菌细胞蛋白质和核酸相对泄漏度呈逐渐升高的趋势,48 h后蛋白质和核酸相对泄漏度同对照相比明显升高,此时0.80 mmol/L MeJA处理组葡萄座腔菌细胞蛋白质、核酸相对泄漏度分别比对照分别高出1.65 倍和2.0 倍,差异极显著(P<0.01)。结果表明,MeJA对葡萄座腔菌细胞膜破具有破坏作用,且处理浓度越高、处理时间越长,MeJA对葡萄座腔菌细胞膜破坏程度越严重。
2.1.3 MeJA对葡萄座腔菌菌丝超微形态的影响
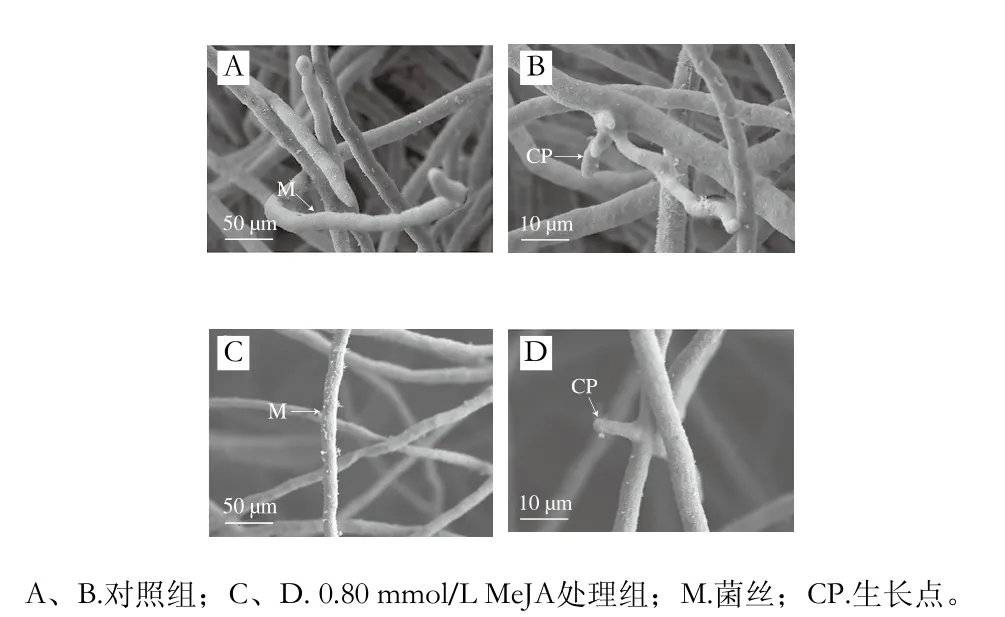
图3 MeJA对葡萄座腔菌菌丝超微形态的影响Fig. 3 Effect of MeJA on morphology of Botryosphaeria dothidea mycelial
由图3可知,对照组葡萄座腔菌菌丝形态正常且菌丝浓密,菌丝表面光滑且生长均匀,生长点多且饱满。经0.80 mmol/L MeJA处理后,菌丝表面粗糙且菌丝稀疏,菌丝生长点少,表明菌丝生长受到抑制。
2.1.4 MeJA对葡萄座腔菌菌丝超微结构的影响
正常葡萄座腔菌的细胞壁光滑完整,细胞内空腔较少,细胞核、线粒体完整,颗粒蛋白较多,胞内细胞质颜色较深(图4A、B);而经过0.80 mmol/L MeJA处理的葡萄座腔菌细胞壁有溶解现象,线粒体形状变得不规则,部分细胞核有分解的趋势(图4C),空腔明显增加,颗粒蛋白较少,且细胞质比正常细胞颜色浅(图4D)。
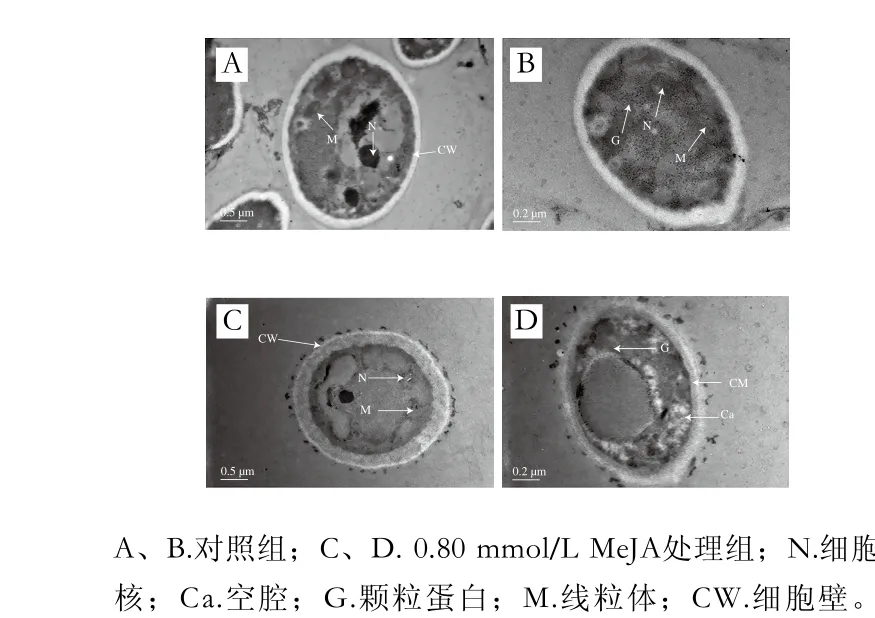
图4 MeJA对葡萄座腔菌菌丝超微结构的影响Fig. 4 Effect of MeJA on ultrastructure of Botryosphaeria dothidea mycelial
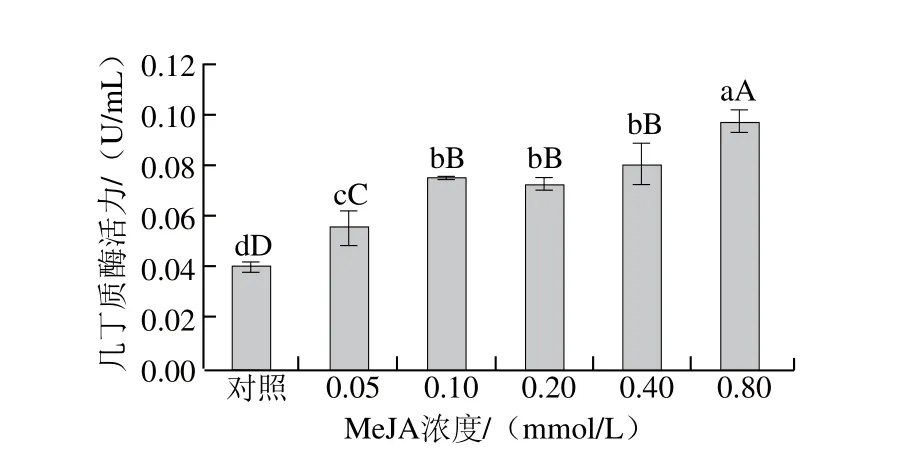
图5 MeJA对葡萄座腔菌几丁质酶活力的影响Fig. 5 Effect of MeJA on chitinase activity fromBotryosphaeria dothidea mycelia
如图5所示,随着MeJA浓度的增加,葡萄座腔菌菌丝细胞壁几丁质酶活力逐渐升高,同对照组相比差异极显著(P<0.01)。结果表明,葡萄座腔菌经MeJA处理后,几丁质酶活力增强,使病菌细胞壁几丁质不断降解,引起几丁质组成成分N-乙酰-D-氨基葡萄糖含量升高,从而影响病原菌的生长,加速细胞死亡。
2.1.6 MeJA对葡萄座腔菌β-1,3-葡聚糖酶活力的影响
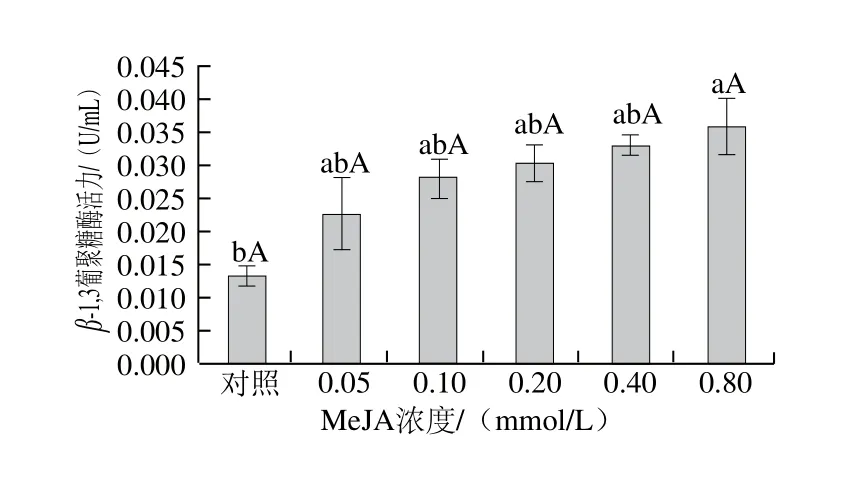
图6 MeJA对葡萄座腔菌β-1,3葡聚糖酶活力的影响Fig. 6 Effect of MeJA on β-1,3-glucanase activity fromBotryosphaeria dothidea mycelia
β-1,3-葡聚糖是病原菌细胞壁主要成分,研究表明壳寡糖作用于菌丝细胞壁,可产生β-1,3-葡聚糖酶水解病原菌细胞壁,可使病原细胞死亡[42]。从图6可以看出,随MeJA浓度增加,葡萄座腔菌菌丝细胞壁β-1,3-葡聚糖酶活力逐渐增强;当浓度为0.80 mmol/L时,同对照组相比差异显著(P<0.05),其余浓度处理组之间差异不显著(P>0.05)。由此推断,加入MeJA后,葡萄座腔菌细胞壁β-1,3-葡聚糖酶活力增强,导致病菌细胞壁β-1,3-葡聚糖水解,从而抑制病原菌的生长。
2.2 MeJA对猕猴桃果软腐病的防控效果及品质的影响
2.2.1 MeJA对猕猴桃果软腐病的防控效果
由表2可知,不同方式MeJA处理对猕猴桃软腐病均有良好的防控效果,贮藏25 d后,果园1中,CK1、CK2平均发病率分别为48.39%、74.65%,除A处理组外,其余处理组平均发病率均极显著低于2 个对照组(P<0.01),防效较好的为处理C,达49.14%,其次为处理A、D,防效分别达35.26%、45.97%;果园2中,CK1、CK2平均发病率分别为53.33%、72.50%,各处理组平均发病率均显著低于2 个对照组(P<0.05),防效较好的为处理C,达77.70%,其次为处理A、D,防效分别达58.35%、69.46%。注:同一果园,同列肩标小写字母不同表示差异显著(P<0.05),同列肩标大写字母不同表示差异极显著(P<0.01)。下同。
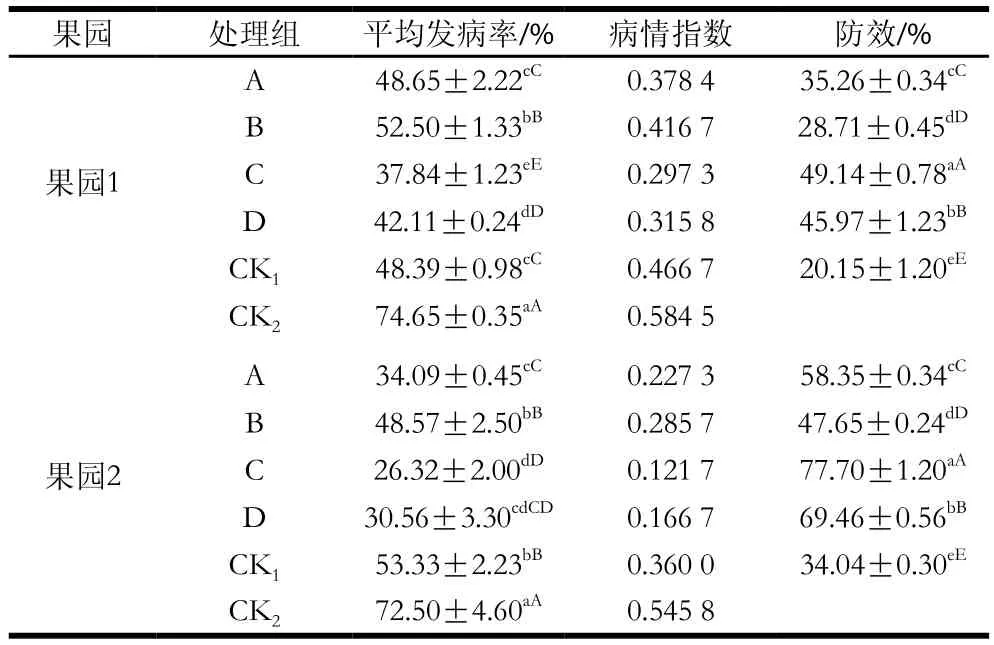
表2 MeJA对防控猕猴桃软腐病的效果Table 2 Control efficiency of MeJA against soft rot of kiwifruits
2.2.2 MeJA对猕猴桃果实外观品质的影响
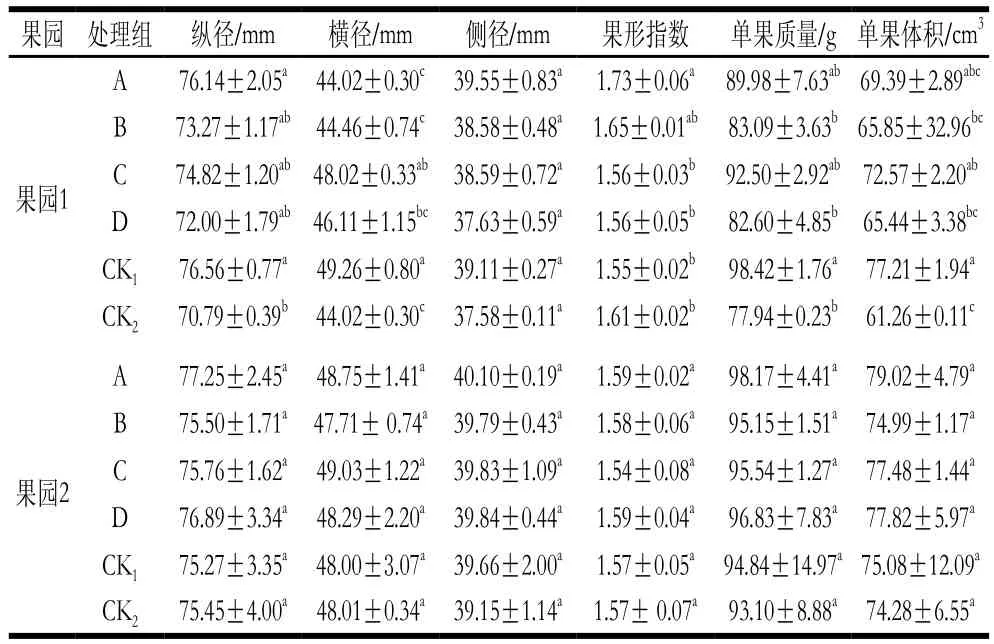
表3 MeJA对猕猴桃果实生长的影响Table 3 Effect of MeJA on the development of kiwifruits
从表3可看出,果园1中,猕猴桃幼果期喷施0.50 mmol/L MeJA(处理A)可显著增加果实纵径,改善果形指数(P<0.05),壮果期0.50 mmol/L MeJA浸果(处理C)可显著增加果实横径、单果体积(P<0.05);果园2中,幼果期喷施0.50 mmol/L MeJA猕猴桃果实各指标同CK1、CK2相比增加,但差异未达显著水平(P>0.05)。表明MeJA处理一定程度上可改善果实外观品质。
2.2.3 MeJA对猕猴桃果实营养品质的影响
由表4可知,采前不同时期MeJA处理后,猕猴桃果实VC、叶绿素、可溶性蛋白含量和可溶性糖、可滴定酸质量分数同CK1、CK2相比有一定提高。表明MeJA处理对猕猴桃果实的品质有一定改善作用,壮果期0.50 mmol/L浸果处理(处理C)效果较好。
表4 MeJA对猕猴桃果实营养品质的影响Table 4 ffect of MeJA on nutritional quality of kiwifruits
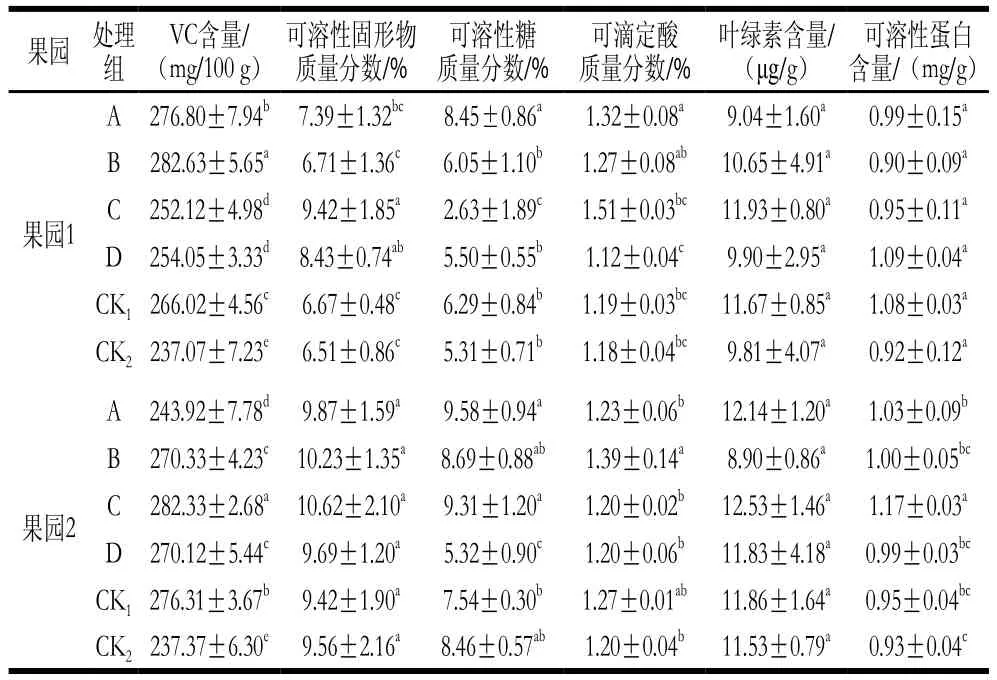
表4 MeJA对猕猴桃果实营养品质的影响Table 4 ffect of MeJA on nutritional quality of kiwifruits
果园 处理组VC含量/(mg/100 g)可溶性固形物质量分数/%可溶性糖质量分数/%可滴定酸质量分数/%叶绿素含量/(μg/g)可溶性蛋白含量/(mg/g)果园1 A 276.80±7.94b 7.39±1.32bc 8.45±0.86a 1.32±0.08a 9.04±1.60a 0.99±0.15a B 282.63±5.65a 6.71±1.36c 6.05±1.10b 1.27±0.08ab 10.65±4.91a 0.90±0.09a C 252.12±4.98d 9.42±1.85a 2.63±1.89c 1.51±0.03bc 11.93±0.80a 0.95±0.11a D 254.05±3.33d 8.43±0.74ab 5.50±0.55b 1.12±0.04c 9.90±2.95a 1.09±0.04a CK1266.02±4.56c 6.67±0.48c 6.29±0.84b 1.19±0.03bc 11.67±0.85a 1.08±0.03a CK2237.07±7.23e 6.51±0.86c 5.31±0.71b 1.18±0.04bc 9.81±4.07a 0.92±0.12a果园2 A 243.92±7.78d 9.87±1.59a 9.58±0.94a 1.23±0.06b 12.14±1.20a 1.03±0.09b B 270.33±4.23c 10.23±1.35a 8.69±0.88ab 1.39±0.14a 8.90±0.86a 1.00±0.05bc C 282.33±2.68a 10.62±2.10a 9.31±1.20a 1.20±0.02b 12.53±1.46a 1.17±0.03a D 270.12±5.44c 9.69±1.20a 5.32±0.90c 1.20±0.06b 11.83±4.18a 0.99±0.03bc CK1276.31±3.67b 9.42±1.90a 7.54±0.30b 1.27±0.01ab 11.86±1.64a 0.95±0.04bc CK2237.37±6.30e 9.56±2.16a 8.46±0.57ab 1.20±0.04b 11.53±0.79a 0.93±0.04c
2.2.4 MeJA对猕猴桃果实贮藏性的影响
2.2.4.1 MeJA对采后猕猴桃果实可溶性固形物质量分数的影响
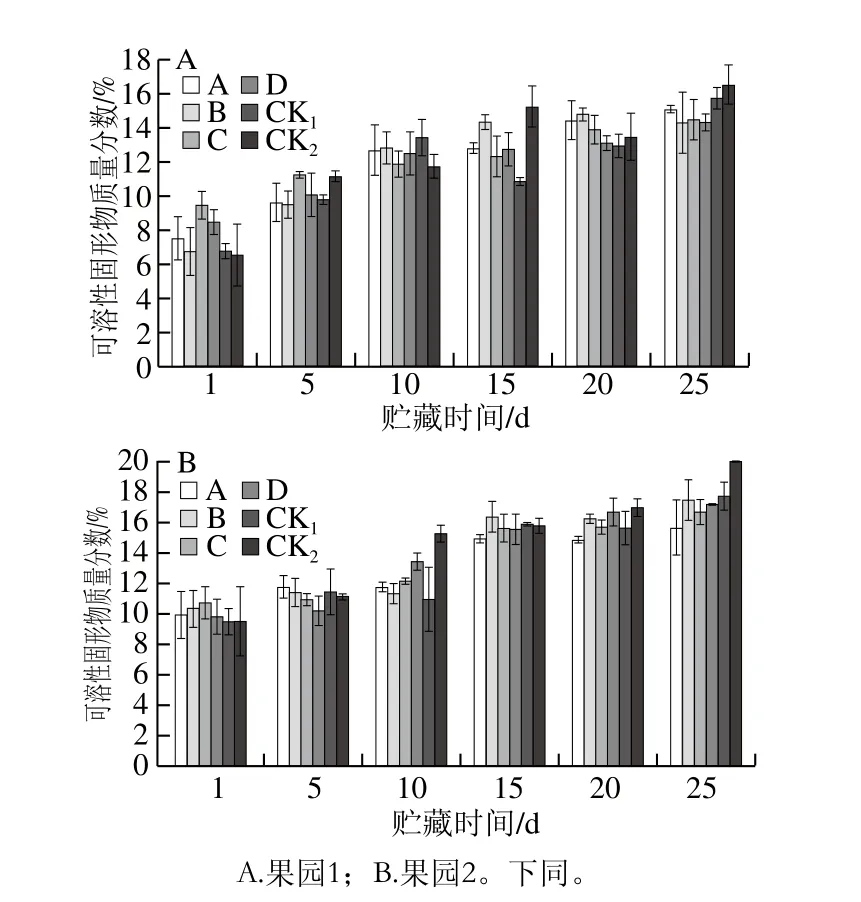
图7 贮藏期猕猴桃果实可溶性固形物质量分数的变化Fig. 7 Changes in soluble solids content of kiwifruits during storage
可溶性固形物质量分数在猕猴桃成熟前会因果实成熟度升高而上升,是衡量果实成熟的标准之一[43]。如图7A、B所示,随着贮藏期的延长,可溶性固形物质量分数呈现逐渐上升的趋势。贮藏25 d时,各MeJA处理组可溶性固形物质量分数均低于CK1、CK2组,果园1、果园2分别以处理D、A效果明显。表明采前MeJA(0.50 mmol/L)处理可以提高猕猴桃果实可溶性固形物质量分数,同时延缓贮藏期间可溶性固形物质量分数的升高,起到延长猕猴桃果实贮藏时间的作用。
2.2.4.2 MeJA对采后猕猴桃果实可溶性糖质量分数的影响
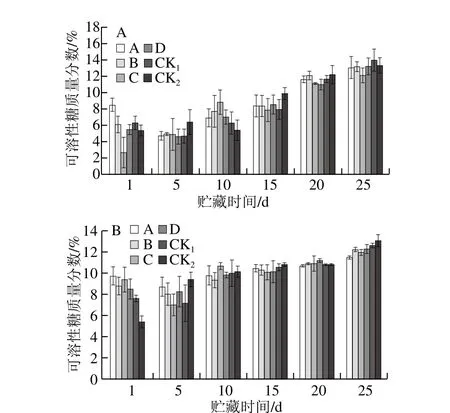
图8 贮藏期猕猴桃果实可溶性糖质量分数的变化Fig. 8 Changes in soluble sugar content of kiwifruits during storage
如图8A、B所示,随贮藏时间的延长,可溶性糖质量分数逐渐升高。贮藏25 d时,果园1中CK1、CK2组可溶性糖质量分数分别为14.00%、13.29%,果园2中CK1、CK2组可溶性糖质量分数分别为12.19%、12.55%,且均高于各MeJA处理组,但差异不明显;果园1、果园2均为处理A、C效果较好。表明以0.50 mmol/L MeJA进行幼果期喷施或壮果期浸果处理可以抑制猕猴桃果实可溶性糖质量分数的升高,有利于果实贮藏保鲜。
2.2.4.3 MeJA对采后猕猴桃果实VC含量的影响

图9 贮藏期猕猴桃果实VC含量的变化Fig. 9 Changes in vitamin C content of kiwifruits during storage
如图9所示,贮藏期各处理组VC含量呈下降的趋势。贮藏25 d,两果园MeJA处理猕猴桃果实VC含量均高于对照组,且贮藏过程中VC含量损失均低于对照组。果园1、果园2均为处理A效果较好,VC含量分别为163.70、
191.85 mg/100 g,明显高于两个对照组,其次分别为处理C、D。表明幼果期喷施0.50 mmol/L MeJA可有效降低贮藏期果实VC的损失。
2.2.4.4 MeJA对采后猕猴桃果实可滴定酸质量分数的影响
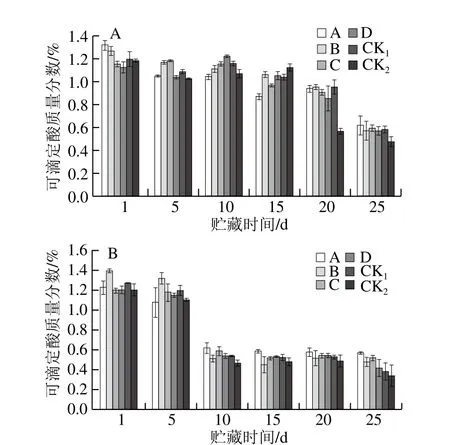
图10 贮藏期猕猴桃果实可滴定酸质量分数的变化Fig. 10 Changes in titratable acid content of kiwifruits during storage
由图10可知,随贮藏时间的延长,可滴定酸质量分数呈下降趋势。除果园1中的CK1组外,其余对照组可滴定酸质量分数下降速度明显快于MeJA处理组,说明采前MeJA处理抑制了猕猴桃的软化。果园1、果园2中均以处理A、C延缓效果较好。表明采前喷施MeJA可有效减少贮藏期可滴定酸质量分数的降低,使得猕猴桃果实保持适宜的糖酸比,有利于猕猴桃的贮藏品质和风味的保持。
2.2.4.5 MeJA对采后猕猴桃果实叶绿素含量的影响
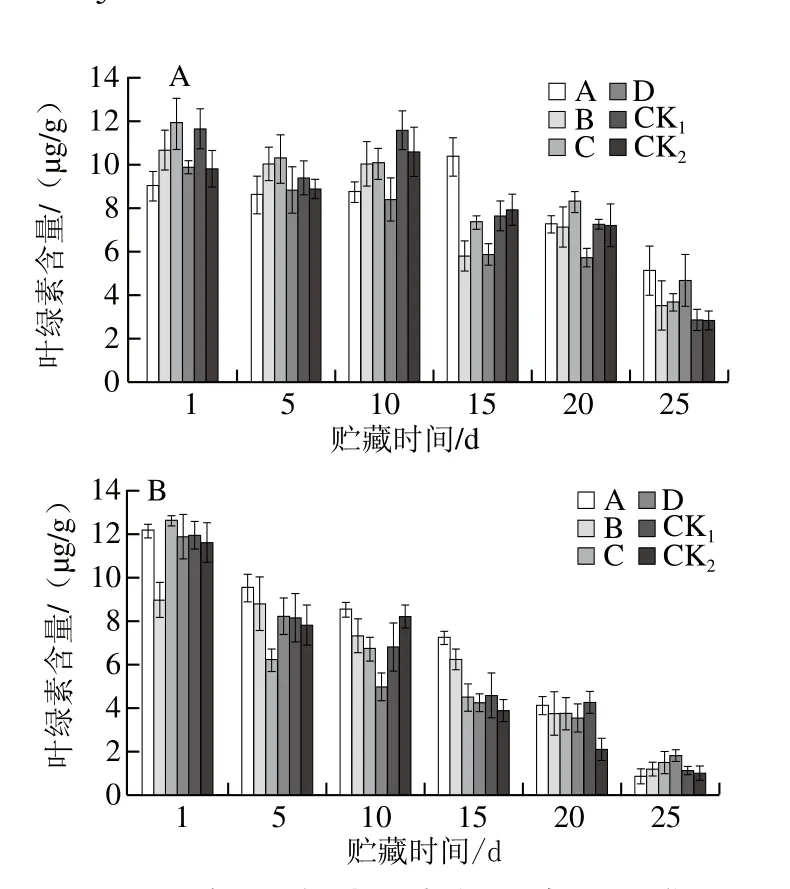
图11 贮藏期猕猴桃果实叶绿素含量的变化Fig. 11 Changes in chlorophyll content of kiwifruits during storage
由图11可知,随着猕猴桃果实软化衰老,果实中叶绿素含量不断降低。贮藏25 d时,果园1中CK1、CK2组叶绿素含量分别为2.93、2.92 μg/g,低于各MeJA处理组;果园2中CK1、CK2叶绿素含量低于C、D处理组。表明适当的MeJA处理可延缓猕猴桃果实贮藏期间叶绿素的损失,对贮藏期果实品质维护起到辅助作用,其中果园1、果园2中分别以处理A、D效果较好。
2.2.4.6 MeJA对采后猕猴桃果实可溶性蛋白含量的影响
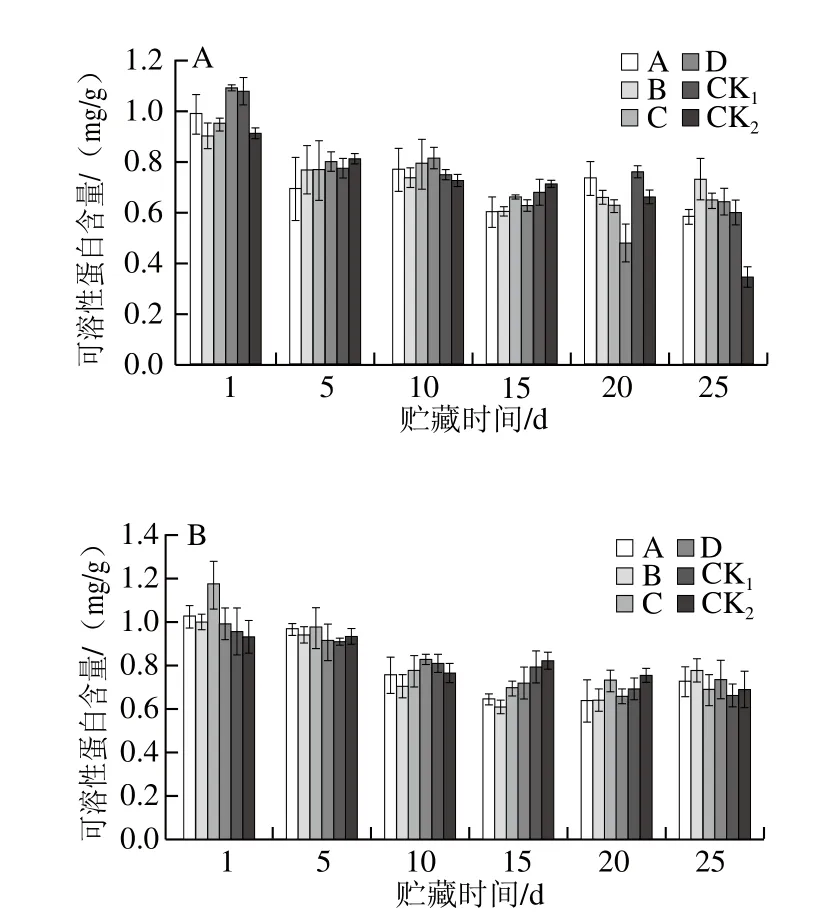
图12 贮藏期猕猴桃果实可溶性蛋白含量的变化Fig. 12 Changes in soluble protein content of kiwifruits during storage
由图12可知,随贮藏时间延长,猕猴桃果实可溶性蛋白含量呈波动下降的趋势。贮藏25 d时,2 个果园CK1组可溶性蛋白含量稍低于各MeJA处理组;果园1中CK2组可溶性蛋白含量为0.35 mg/g,明显低于各MeJA处理组;果园2中CK2组可溶性蛋白含量均稍低于各MeJA处理组。表明MeJA处理可以有效延缓可溶性蛋白损失,在猕猴桃果实贮藏中对果实品质损失起到保护作用,其中,果园1、果园2均以B处理效果较好。
2.2.4.7 MeJA对采后猕猴桃果实硬度的影响
水果的硬度是衡量果实是否成熟的标准之一[43]。如图13所示,随着贮藏时间的延长,果实硬度呈下降趋势,整个贮藏期各处理组猕猴桃果实硬度均高于2 个对照组。贮藏第25天,果园1、果园2中MeJA处理猕猴桃果实的最低硬度均高于2 个对照组。果园1中处理C效果较好,贮藏结束时硬度为3.90 kg/cm2;果园2中处理B效果较好,贮藏结束时硬度为1.84 kg/cm2。表明MeJA处理处理可有效延缓果实软化,延长猕猴桃货架期。
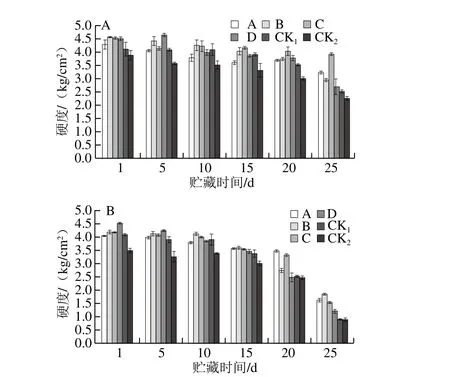
图13 贮藏期猕猴桃果实硬度变化Fig. 13 Changes in firmness of kiwifruits during storage
2.2.4.8 MeJA对采后猕猴桃果实质量损失率的影响
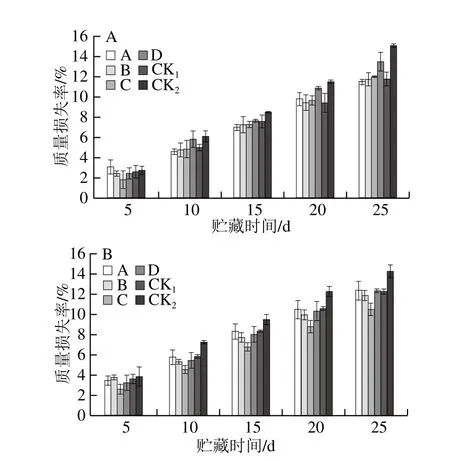
图14 贮藏期猕猴桃果实质量损失率变化Fig. 14 Changes in mass loss rate of kiwifruits during storage
如图14所示,整个贮藏过程中猕猴桃果实质量损失率呈上升趋势。贮藏5 d后,果园1、果园2 中CK2组质量损失率逐渐上升,且上升速率明显高于MeJA处理组;贮藏25 d后,果园1、果园2中效果较好的分别为处理A、C,但CK1组质量损失率与MeJA处理组差异不明显。表明采前MeJA处理可在一定程度上抑制果实水分蒸发和果实内含物质的损失,降低猕猴桃果实质量损失率。
3 讨 论
大量研究结果表明,MeJA可有效地抑制番茄、芒果和苹果等果蔬釆后真菌性病害发生[22,24-26]。本研究表明,0~0.80 mmol/L MeJA对猕猴桃软腐病菌葡萄座腔菌有均有一定抑制作用,且抑制效果随MeJA浓度升高而增强,其EC50为0.232 7 mmol/L。与盘柳依等[44]在猕猴桃软腐病葡萄座腔菌上的研究结果类似,同时李灿婴[19]、孙嘉曼[45]等研究证实离体MeJA具有抑菌作用。此外,本研究发现0.80 mmol/L MeJA处理葡萄座腔菌菌丝体48 h后,可致菌丝细胞细胞壁溶解、胞内细胞器增多且形状变得不规则;同时不同浓度MeJA处理会引起菌丝体相对电导率、蛋白质与核酸相对泄漏度升高,细胞壁主要酶活力增强,从而破坏葡萄座腔菌菌丝细胞膜,影响葡萄座腔菌细胞代谢,达到抑菌或杀菌的作用;但MeJA对葡萄座腔菌是否存在其他方面的影响有待进一步研究。
茉莉酸类化合物处理植物可系统诱导多酚氧化酶、过氧化物酶、脂氧合酶、蛋白酶抑制剂和壳聚糖酶等防御蛋白的活力升高[18]。王英珍等[18]研究表明,采前MeJA处理可有效提高果实中抗病性相关酶的活性,激活果实抗病防御系统,抑制成熟梨果实发病,李灿婴等[46]研究发现MeJA可有效抑制病斑扩展,抑制病害的发生与蔓延。本实验通过果实生长发育期进行MeJA处理,结果表明采前一个月(壮果期)0.50 mmol/L MeJA浸果处理猕猴桃,对软腐病的防效可达77.70%。猕猴桃软腐病是由一种或几种病原菌侵染引起,MeJA处理仍可有效防控其发生,认为MeJA直接抑制葡萄座腔菌引起的软腐病发生的同时可能抑制其他病原菌的生长,或是诱导猕猴桃产生抗性,激活抗病防御机制,通过直接抑菌与诱导抗性形成协同性,有效防控软腐病的发生。
外源MeJA处理能够显著提升农产品品质,延长农产品保鲜时间,在香气提升、次生代谢产物含量增加等方面的效用尤为明显[47]。外源MeJA易进入植物体内,能够有效透过植物细胞膜在植物体内运输并发挥信号转导作用,调节植物体一系列生理生化反应[48]。同时外源MeJA可促进草莓可溶性固形物含量的增加、保持水蜜桃的营养品质、提高猕猴桃可溶性固形物含量[47-51]。本研究发现,MeJA处理可有效提高猕猴桃果实可溶性固形物、可溶性糖质量分数和VC含量,改善猕猴桃品质,与前人研究结果有共同之处。外源MeJA被吸收后可有效发挥信号分子作用,调控相关基因表达,影响相应蛋白质表达,诱导植物体内苯丙氨酸途径关键酶活性上升,促进次生代谢产物的积累[47],这可能是MeJA改善猕猴桃果实营养品质的关键原因。
猕猴桃果实采后贮藏期间生理衰老及品质裂变对果实硬度、糖、酸和水分保持有着重要的影响。硬度的保持可以降低果实软化率、延长贮藏期;水分及内含物质的损失会导致营养、风味的下降[1]。胡文忠等[52]研究发现外源MeJA可抑制果实呼吸强度、保持猕猴桃果实硬度、延缓果实中的VC、可溶性固形物等营养的损失。本研究表明,采前一个月采用0.50 mmol/L MeJA浸果处理可抑制猕猴桃贮藏过程中硬度下降,延缓果实可溶性固形物、可溶性糖和VC的损失,有效延长果实贮藏时间。盘柳依等[53]研究发现外源MeJA可抑制果实的呼吸强度、降低质量损失和腐烂率,从而有效保持猕猴桃果实品质、延长猕猴桃果实贮藏期,与本研究结果基本一致。对于外源MeJA对猕猴桃果实品质和贮藏性能的影响机制、最佳处理时间及对猕猴桃其他方面的影响还有待进一步研究。
4 结 论
本研究发现外源MeJA对猕猴桃软腐病致病菌葡萄座腔菌有抑制作用,EC50为0.232 7 mmol/L;通过MeJA对葡萄座腔菌作用机制的研究,证明了MeJA可直接作用于葡萄座腔菌,增加其菌丝细胞膜通透性,诱导细胞壁水解酶(几丁质酶、β-1,3葡聚糖酶)活力增强,使细胞壁结构发生改变,进而改变细胞内部结构,影响细胞正常新陈代谢,从而达到抑菌的效果。采前一个月以0.50 mmol/L MeJA浸果处理可有效防控猕猴桃软腐病的发生,改善猕猴桃果实品质,减少果实内营养的损失,增强贮藏性能,从而达到保持猕猴桃果实食用价值且延长货架期的效果。

