醋酸水溶液标准平衡常数实验测定方法
李国权,马成有,来雅文
(1.广东农工商职业技术学院,广东广州 511365;2.吉林大学地球探测科学与技术学院,吉林长春 130062)
1 原理
1.1 近似条件醋酸求解平衡常数
醋酸是一元弱酸,在水溶液中部分电离,离解平衡如下:
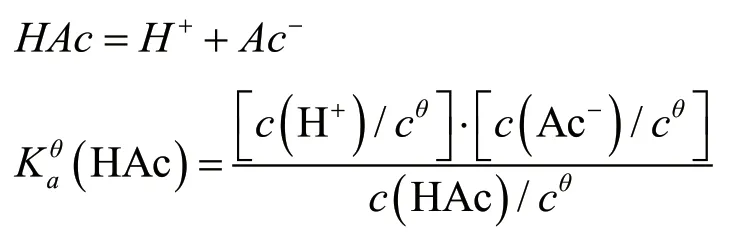
式中:(HAc)为醋酸溶液的标准平衡常数;
c(H+)、c(Ac-)、c(HAc)分别为H+、Ac-、HAc的平衡浓度,单位为mol/L;cθ为标准溶液,即1 mol/L。
如果忽略水的解离对醋酸溶液酸碱度的影响,则有:
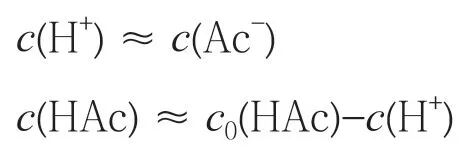
其中c0(HAc)为醋酸的原始浓度。
所以,可得:
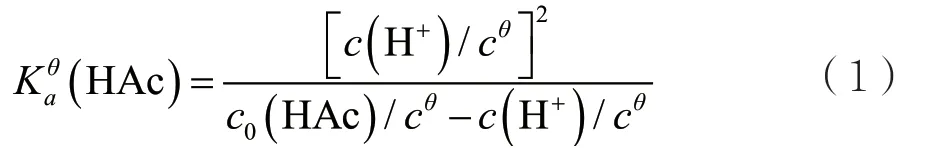
实验中,用pH计测定已知浓度醋酸的pH值,换算成c(H+),进而计算Kaθ(HAc)。为方便理解,将(1)式称为近似式。
醋酸在水溶液的中标准平衡常数Kaθ(HAc)=1.79×10-5,离解程度很小,平衡解离出来的H+的量很少。在式(1)中,与醋酸的初始浓度c0(HAc)相比,c0(H+)可以忽略,即c0(HAc)-c0(H+)≈c0(HAc),所以又得:
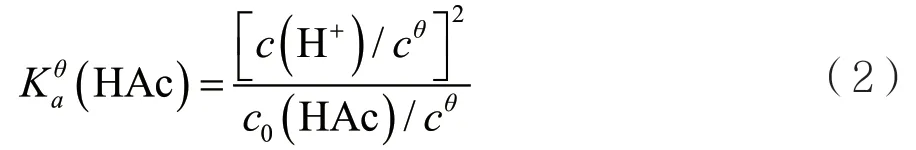
实验中,pH计测定已知浓度醋酸的pH值,换算成c(H+),进而计算Kaθ(HAc)。为方便理解,将(2)式称为最简式。
1.2 精确条件求解醋酸标准平衡常数
对醋酸水溶液列质子平衡方程:
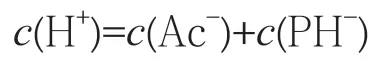
在质子平衡方程式中,根据摩尔分数的定义,有:
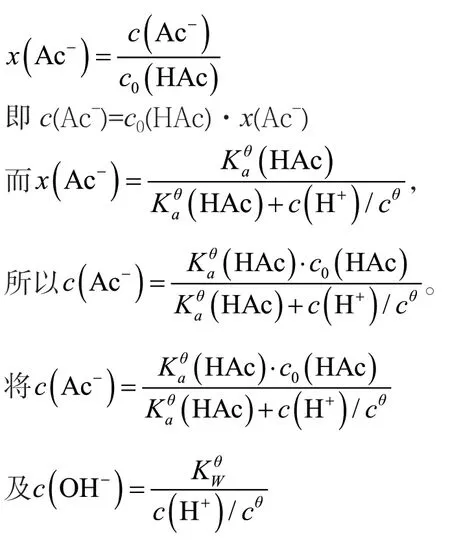
代入c(H+)=c(Ac-)+c(OH-)得:
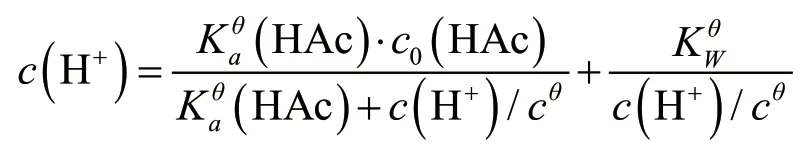
整理得:
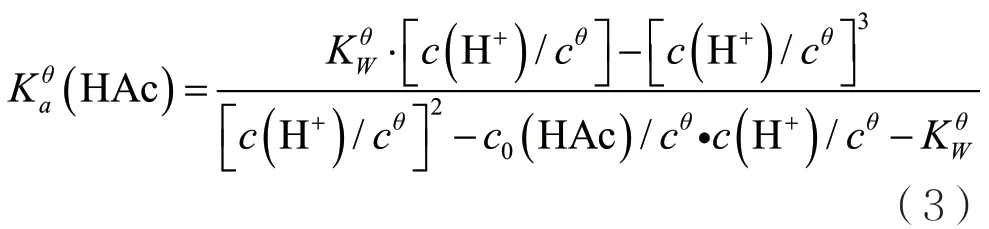
用pH计测定已知浓度醋酸的pH值,换算成c(H+),进而计算Kaθ(HAc)。为方便理解,将(3)式称为精确式。
2 实验
2.1 仪器及试剂
仪器:酸度计,吸量管(5.00 mL、10.00 mL、20.00 mL)烧杯,吸耳球。
试剂:酸酸溶液(已标定0.1034 mol/L)。
2.2 实验步骤
2.2.1 不同浓度的醋酸溶液的配制
用吸量管分别吸取已经标定好的醋酸原液0.00 mL、3.00 mL、6.00 mL、12.00 mL、18.00 mL 于50.00 mL容量瓶中,加蒸馏水稀释定容。醋酸原液已标定,c0(HAc)=0.1034 mol/L。
2.2.2 不同浓度标准系列醋酸pH值的测定
取6只干净且干燥的小烧杯,分别取上述4种浓度不同的醋酸溶液以及醋酸原液20mL左右于小烧杯中,按由稀到浓的顺序用pH计分别测定它们的pH值,记录各溶液的pH值和实验温度。并将pH值换算成c(H+),代入近似式(1)和精确式(2)可算出
3 结果与讨论
3.1 数据记录与处理
从测定分析结果来看,实验测得的醋酸溶液的标准平衡常数不论是通过近似式、最简式,还是精确式计算出来的结果都比理论教材中给定的标准平衡常数值[Kaθ(HAc)=1.79×10-5]要小两个数量级,偏差较大。

表1 实验中测得的有关数据(T=296.15 K)
3.2 数据分析
各不同浓度标准系列醋酸溶液的原始浓度是已知的。
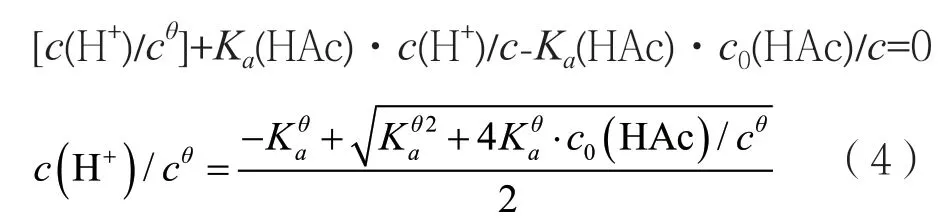
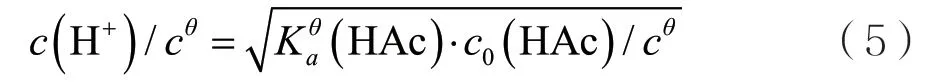
对精确式
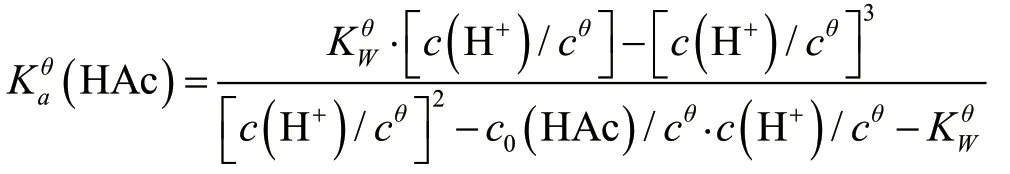
进行处理得:
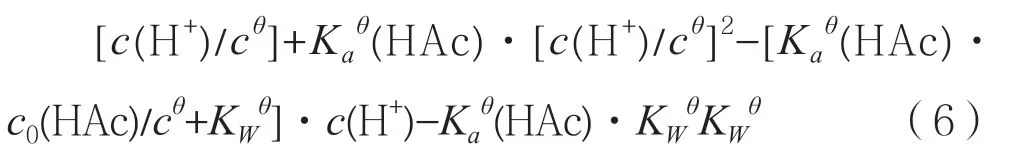
这是关于c(H+)的一元三次方程,可利用计算机编程进行求解c(H+)的值。
通过(4)、(5)、(6)从理论上计算各不同浓度标准系列醋酸溶液的pH、c(H+)。并与实验测得值进行对比。
从表2可以看出,实验测得的pH值比理论计算值都要大一些,即实验得到的c(H+)比理论计算所得都要小一些,从实验获得的醋酸标准平衡常数值比理论要小。随着醋酸浓度的增加,从pH值来看,理论值与实验测定值之间的差距有减小的趋势。在同一醋酸浓度条件下,△pH的幅度相差很小。
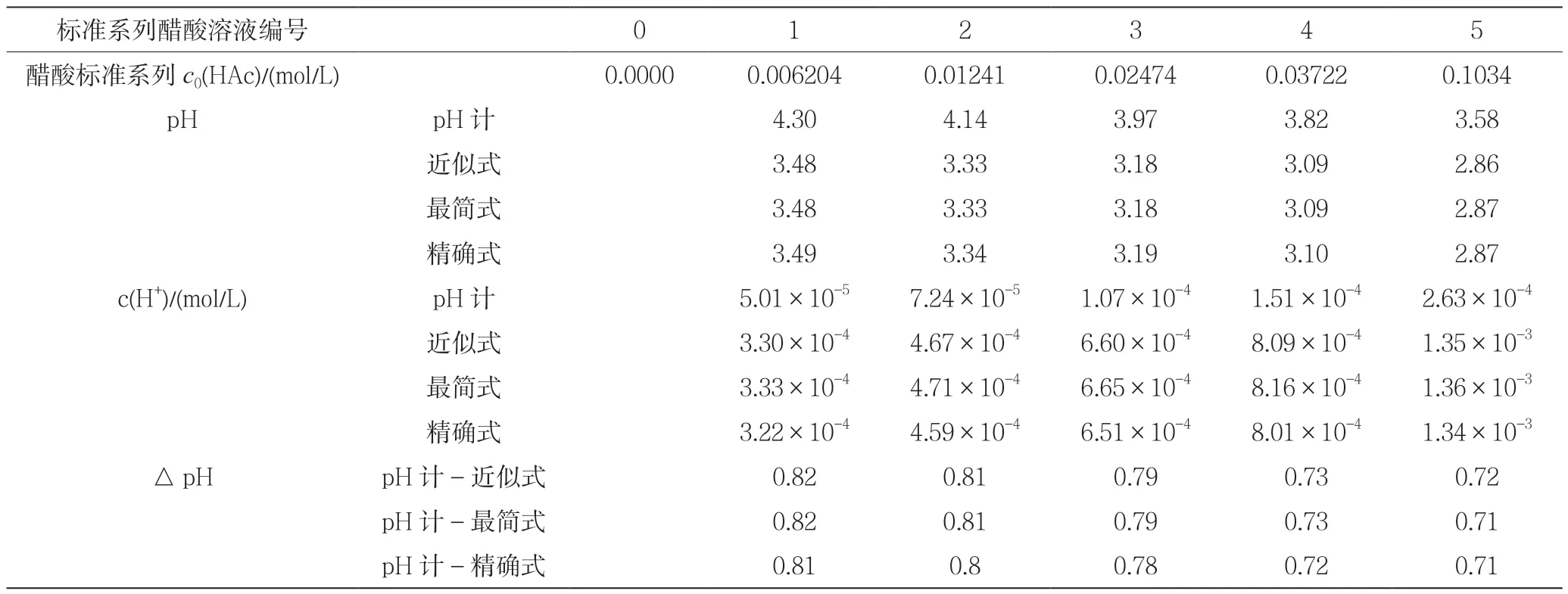
表2 不同浓度标准系列醋酸溶液pH计实验测得氢离子浓度值和理论计算值比较
使用pH计测得氢离子浓度与采用近似式、最简式、精确式等三个理论公式计算所得氢离子浓度有一定偏差,并且同一醋酸初始浓度下,偏差达到一个数量级。原因可能如下。
首先是实验温度,理论计算公式中平衡常数的数值是温度控制在18~25℃条件下,而实际实验室温度并不一定符合这个要求,并且对醋酸解离平衡来说,温度是重要的一个影响因素,温度改变,平衡常数也会发生变化,平衡常数与温度之间的关系由范特霍夫方程联系,在范特霍夫方程中,反应的焓变是一个关键因素,在通常情况下即一定温度范围内,焓变可以近似为一个稳定的常数值,但对醋酸来说,醋酸解离时的焓变随着温度的变化而变化。不但不是一个常数,而且还改变了方向,在288 K时焓变是正值吸热,在298 K时焓变是负值放热。因此,其解离平衡常数随着温度的升高先增大,达到最大值后再减小。
其次要认识到理论计算和实验操作之间存在一定的差距,如何缩短理论与实验之间的距离,这也是科学研究努力的一个方向。
在理论计算标准系列溶液的酸度时,采用的公式有近似式、最简式、精确式三个公式,除精确式,近似式和最简式的适用要有限定的边界条件:水离解的可以忽略,即要满足还有弱酸自身的离解程度相对于弱酸的初始浓度来说是非常弱的,即要满足满足以上两个条件才可以采用最简式计算氢离子浓度,满足即水的离解忽略,可以采用近似式计算氢离子浓度。从实验过程来看,标准系列醋酸浓度最小值为0.006204 mol/L)都能满足上述条件,所以不论是近似式还是最简式都能适用于上述系列醋酸酸度,并且从计算结果也可以看出,在相同的醋酸初始浓度条件下,采用近似式、最简式计算氢离子浓度的结果与精确式计算结果相差很小,最大相差 0.02×10-3mol/L。
在不同浓度标准系列醋酸溶液中,浓度是渐进式变化的。随着醋酸浓度的增加,溶液pH值,公式理论计算值与实验测定值之间的差距稍有减小的趋势。也可以这样说,随着醋酸浓度增大,理论值与实验测定值之间的差距就越小。原因可能就是只有醋酸浓度在一定范围之内,醋酸浓度越大,其酸度的理论计算公式越适合于计算氢离子浓度,实测值和理论值差值会更小。所以可以得出这样的结论,采用实验方法测定醋酸标准平衡常数的实验中,标准系列醋酸浓度不能太低,浓度越高,理论值与实测值差距就会越小,计算得到的标准平衡常数越理想。
4 结论
现象是事物本质的外在反应,现象是由本质问题决定。醋酸水溶液标准平衡常数是醋酸水溶液重要的理化指标。
决定醋酸分子在水溶液中的解离程度大小的关键因素是醋酸分子羧基中氢原子与氧原子之间化学键的强弱。在周围水分子的作用下,氢原子与氧原子可以断开,即解离释放出氢离子。
醋酸分子在水溶液中的解离过程,包括醋酸分子内化学键的破坏、离子的水合、水解作用、溶质粒子的扩散运动等。在该过程中,化学键断裂是吸热的,离子的水合是放热的,离子的水解是吸热的,溶质粒子的扩散也是吸热的。因此醋酸解离过程的热效应是一个综合的热效应,过程中部分时段可能吸热也可能放热。
如果醋酸解离是放热反应,升高温度不利其解离,解离平衡常数减小。如果醋酸解离是吸热反应,升高温度利于其解离,解离平衡常数增大。
另外,在醋酸水溶液中有氢键的存在,醋酸分子与醋酸分子之间的氢键利于醋酸分子稳定,不易解离出氢离子,但温度升高,氢键断裂,利于单个醋酸分子解离,因此温度升高,使得解离平衡常数增大。
因此,醋酸解离受自身分子结构和化学反应热效应共同影响。温度较高时,化学热效应占主导地位;温度较低时,利于氢键形成,分子间缔合稳定,不利于解离氢离子,即解离平衡常数减小。

