CTA预选胸廓内动脉肋间穿支为腹壁下动脉穿支皮瓣乳房重建的受区血管
金贻婷, 储呈玉*, 张 薇, 富丽娜, 汤伟军, 董佳生, 徐 华, 邹 强
(1.复旦大学附属华山医院 a.普外科,b.超声医学科,c.放射科,上海 200040;2.上海交通大学医学院附属第九人民医院整复外科,上海 200011)
乳腺癌严重威胁女性健康,其发病率逐年上升[1]。乳腺癌术后乳房缺失给病人生理、心理造成极大创伤[2]。近年来随着乳房重建技术的发展,乳房切除后即刻重建受到越来越多乳腺癌病人的青睐[3]。自Allen等[4]报道应用腹壁下动脉穿支(deep inferior epigastric perforator,DIEP)皮瓣成功再造乳房以来,DIEP皮瓣因存活率高、组织量丰富、质地与乳房接近、供区瘢痕隐蔽,且手术效果良好、对供区的损伤小等优点,被公认为目前自体组织乳房重建的优先选择之一[5-7]。
目前,DIEP皮瓣乳房重建受区血管的选择,主要以胸廓内动脉 (内乳动脉,internal mammary artery,IMA)为主。解剖血管过程中难免要切除部分肋软骨以暴露血管,增加手术复杂度,且扩大受区的创伤。通过IMA的解剖学研究、临床及影像学检查,发现IMA在第一至第四肋间恒定存在较粗大的穿支血管,可作为稳定、安全的受区血管选择。欧美国家对此类手术有过少量报道,但肋间动脉优势穿支的分布和管径可能随人种不同存在较大解剖差异。目前尚缺乏我国人群的相关研究。因此笔者探索在DIEP皮瓣一期乳房重建病例中,以胸廓内动脉肋间穿支 (internal mammary artery perforator,IMAP)作为受区血管的应用,取得满意效果。
资料和方法
一、一般资料
纳入复旦大学附属华山医院2016年1月至2018年12月DIEP一期乳房重建98例病人(见表1),年龄(40.73±6.15)(27~56)岁,病理诊断为浸润性乳腺癌或原位癌,行改良根治术28例,全乳切除+前哨淋巴结活检70例。
二、术前评估
2016年25例,仅行多普勒超声检查评估(ACUSON S3000,Siemens,Germany,3~5 MHz 及 5~14 MHz探头),体表定位,标记供、受区血管穿支位置(见图1)。未经CTA检查评估。
2017年1月始,所有73例除多普勒超声检查,同时行术前胸腹部CTA评估 (Brilliance 256 iCT,Philips Healthcare,Netherlands)。 CTA 参 数 :120 kVp,250 mA, 探测器 128×0.625 mm, 螺 距0.977,512×512矩阵,350 mm 视野。100 mL 非离子碘化造影剂(Ioversol 350,江苏恒瑞),350 mg I/mL静脉注射,4 mL/s。使用Horos软件重建图像,评估穿支的位置、直径和方向(见图2)。
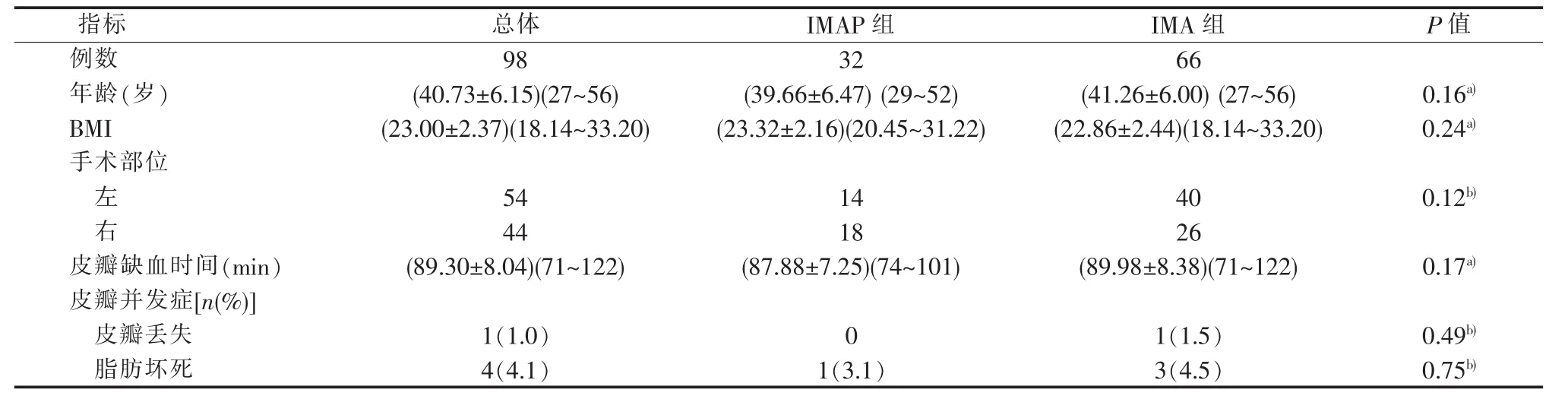
表1 病人特征及皮瓣情况
三、手术方法
术前于立位确定患侧乳腺下皱襞的位置及乳房所缺皮肤和组织量。供区及受区同时开始手术。
(1)受区血管分离和保护:所有病人均行标准化乳腺癌改良根治术或全乳切除+前哨淋巴结活检。在靠近胸骨旁分离内侧乳腺组织时,需注意保留IMAP血管。选择直径≥1 mm且动脉搏动良好的IMAP,用剪刀及双极电凝将穿支血管从胸大肌表面与乳腺内解剖出。避免电刀操作损伤。尽可能游离穿支长度达2 cm,离断并标记(见图3A),留待显微镜下判定能否用作受区血管。选择IMAP作为DIEP皮瓣乳房重建优选受区血管的标准及步骤:①CTA检查提示直径≥1 mm,术中分离并保护;②保留后显微镜下观察,IMAP动脉搏动佳,直径≥1 mm,≥1.5 mm更佳;③术者经验判断,若IMAP条件不佳,血管直径过细,则放弃,切开胸大肌,剥离软骨膜,咬除第三肋软骨,暴露IMA。
图1 术前多普勒超声评估穿支血管和体表定位

图2 术前CTA三维重建评估穿支血管、筛选优势穿支
(2)供区准备:按DIEP皮瓣乳房重建手术常规,DIEP皮瓣游离成形,腹壁整形,脐孔重建。
(3)显微吻合、皮瓣血运重建、乳房重建:解剖分离预留受区动脉和静脉,远端结扎,近端血管夹阻断,修剪断端。将皮瓣移至乳房缺损处临时固定,修剪腹壁下动静脉。以9-0或10-0 prolene线行血管吻合,检查吻合口通畅(见图3B)。皮瓣建立血运后,塑形乳房。
四、IMAP的解剖学观察
通过术前CTA读片、术中观察,分析IMAP的分布、优势穿支的肋间位置及管径。

图3 IMAP血管术中所见
五、统计学方法
计量数据以平均数±标准差表示。两组计量资料比较采用t检验,两组计数资料比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、IMAP的解剖特点
本研究98例病人均为中国人,左乳54例,右乳44例。结合术前超声和CTA检查评估及术中探查,发现优势IMAP位于第二肋间67.3%,第三肋间24.5%,第四肋间8.2%。第二、三、四肋间IMAP的平均直径分别为(1.33±0.66) mm、(0.86±0.28) mm、(0.65±0.15) mm(见表 2)。
二、IMAP作为DIEP皮瓣乳房重建的优选受区血管
98例中32例(32.7%)最终以IMAP作为受区血管吻合。其中,第二肋间穿支28例(87.5%),第三肋间穿支4例(12.5%)(见表3)。IMAP组皮瓣缺血时间、皮瓣并发症与IMA组差异无统计学意义(见表1)。经6个月~3年随访,所有病例术后外形满意,重建乳房质地柔软,色泽与正常相近(见图4)。腹部活动自如,均可完成仰卧起坐运动,未见腹壁疝、腹壁膨隆等并发症。

表2 优势IMAP解剖分布
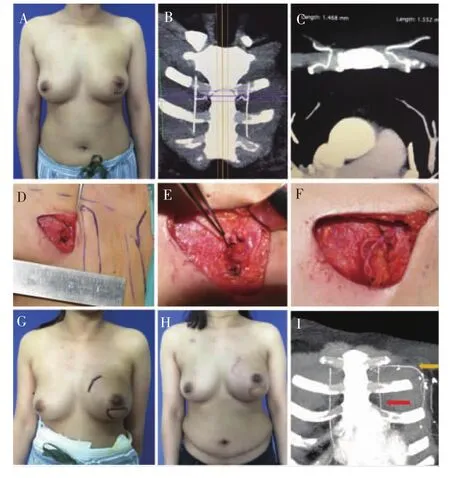
图4 1例完整的随访病例
由此建立笔者团队选择IMAP作为DIEP皮瓣乳房重建优选受区血管的标准:①CTA提示直径≥1 mm IMAP,术中保留;②保留后显微镜下观察:IMAP搏动佳,直径≥1 mm,尤以≥1.5 mm更优;③术者经验判断,若IMAP条件不佳,则再暴露IMA。

表3 IMAP作为受区血管的分布特征[n(%)]
三、术前CTA检查提高IMAP作为受区血管的成功率
2017年行术前CTA评估血管条件后,73例手术中29例(39.7%)IMAP成为受区血管。在2016年仅行多普勒超声评估的25例手术中仅3例 (12.0%)IMAP吻合成功(见表4),经卡方检验,差异有统计学意义(P=0.01)。

表4 术前CTA评估与IMAP作为受区血管的关系
CTA三维重建血管评估结果可明确提示优势IMAP的肋间位置及管径,有助于术前判断:①有无直径≥1 mm的IMAP可供应用;②优势IMAP定位,提示术者术中操作至相应部位时,多做探查寻找,并保护血管。
讨 论
乳房重建一直是乳腺外科及整形外科领域研究的难点及热点之一。重建的方法多种多样,包括自体组织及假体材料。但无论从组织相容性、放疗对术后效果的影响、重建乳房的形态手感等方面,假体材料都是与自身组织无法比拟的。1994年,Allen等[4]最早将DIEP皮瓣用于乳房重建。随着显微技术的逐步成熟,DIEP皮瓣乳房重建术目前已成为笔者单位乳房重建的首选标准术式。原因不仅是该皮瓣的外形、质地最接近乳房,而且该术式保留前鞘、腹直肌和肋间运动神经,从而最大程度保护了腹部供区。
在受区血管的选择应用上,现在的标准受区血管是IMA。因其平均管径约2.5 mm,与腹壁下动脉管径(平均2 mm)匹配,易行血管吻合,血流灌注好,对供区血管蒂长度的要求较宽松,方便皮瓣的旋转塑形,且远离腋窝、不易受负压吸引或放疗等影响[8-9]。但其最大的缺点是增加受区损伤。使用IMA,通常需咬除部分肋软骨,加大创伤的同时又增加手术步骤,可能发生气胸、肺组织损伤、胸廓畸形、呼吸运动限制等并发症。尽管目前有实施保留肋软骨的吻合术[10],但IMA的使用仍受到质疑,原因是如需进行冠状动脉搭桥手术,IMA是最好的血管,且冠心病的发病率在逐年升高。因此,如何减少DIEP皮瓣乳房重建手术步骤、减少受区损伤、保留IMA主干,值得思考。

表5 IMAP作为受区血管的研究比较
其他常见受区血管有胸背动脉、旋肩胛动脉和胸外侧动脉,各有优缺点。胸背动脉和旋肩胛动脉在一期重建根治术时大多已常规暴露,可避免再次解剖,且血管吻合口径匹配。但缺点也很明显:①吻合操作空间局限;②血管蒂长度受限,为避免吻合口张力大,塑形可能偏外侧;③腋窝负压吸引有风险;④如二期重建,或经腋窝放疗,则腋窝黏连、解剖困难;⑤如DIEP皮瓣丢失,失去可作为补救的背阔肌皮瓣血管蒂。胸外侧动脉的缺点是血管不恒定,管径较细,因此其应用受到限制[11-15]。
关于受区血管的更佳选择,笔者想到在全乳切除时通常会于胸骨旁遇到粗大的IMAP。在切除乳腺时,将合适的IMAP保护及解剖,作为受区血管吻合,可最大程度减少受区损伤,简化手术步骤,缩短手术时间。即使IMAP不适合吻合,再应用IMA主干也完全可行。
IMA解剖学研究提示IMAP恒定存在,分布于第一至第四肋间,第二肋间最常见且最粗,在距胸骨平均2 cm的胸大肌表面可找到,左侧偏细,平均直径约1.5 mm,也有报道女性第三、四肋间穿支常最粗[16]。人种、体重、身高、BMI等不同,常导致IMAP直径存在差异。文献报道主要集中于欧美人群,优势IMAP主要分布在第二、三肋间[17-22]。本研究结果类似,所有98例皆为中国人,近92%分布于第二、三肋间,以第二肋间最常见。IMAP平均直径方面,欧美人群1.0~1.9 mm[17-22]。本研究结果为1.16 mm,中国人群可能因体形关系,穿支偏细。但本研究的总体吻合成功率仍有33%,国际上为数不多的报道中吻合成功率在9%~83%不等,与本研究结论接近(见表5)[17-25]。Fansa团队的报道是应用IMAP吻合数最多的,总成功率37%(112/302),其中一期重建成功率73%(82/178)[26],提示IMAP作为受区血管可能在DIEP皮瓣一期乳房重建中更有优势。
由于IMAP位置和管径存在很大个体差异,每个手术都进行盲目探查IMAP也无意义,还有增加切除乳房手术时间或误伤粗大穿支血管等问题。本研究发现完善的术前影像学检查评估是探查IMAP的必备条件,尤其是CTA检查,无论对术前供受区血管的评估还是手术方案的决策都具有重要临床意义[27-28]。结果显示术前CTA三维重建胸廓内血管及其穿支,可预判IMA有无粗大的肋间穿支、穿支直径及位置,提高IMAP作为受区血管的成功率。术前经CTA评估的病例IMAP吻合成功率39.7%,明显高于术前未经CTA评估的病例(仅12.0%)。另外,术中对穿支血管的解剖需小心、仔细。笔者建议靠近胸骨旁分离内侧乳腺组织时,根据术前影像学检查定位,在目标位置使用剪刀及双极电凝,将穿支从胸大肌表面与乳腺内仔细解剖出,避免热传导损伤,并尽可能游离血管蒂长度达2 cm,留作吻合用。虽有一定的操作难度及较长的学习曲线,但有经验的乳腺外科或整形外科医师完全可做到。
IMAP作为受区血管的DIEP皮瓣乳房重建,除保留DIEP的固有优势外,最大的优点是缩短手术时间,减少受区胸壁损伤,为将来可能的冠脉搭桥手术保留胸廓内血管主干完整性,不增加皮瓣坏死风险。缺点是受区血管直径相对较细,血管蒂长度有限,对显微吻合技术要求更高。在行乳腺切除术时,如非主动保护IMAP,往往会无意切断或直接结扎。因此二期乳房重建通常不适用此方法。
总之,IMAP可作为DIEP皮瓣一期乳房重建的优选受区血管,为自体组织游离移植乳房重建提供新的受区吻合血管选择方案。术前CTA评估有助于提高IMAP作为受区血管吻合的成功率。

