猪支原体肺炎活疫苗(168株)气溶胶免疫后呼吸道sIgA分泌及抗原存留规律
华利忠,白 昀,武昱孜,王 佳,杨 浩,吴 猛,袁 厅,邵国青,冯志新
(江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室,南京 210014)
猪支原体肺炎(mycoplasmal pneumonia of swine,Mps)是由猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)引起的一种慢性呼吸道疾病,阳性感染率一般为70%~90%,发病率40%以上,严重影响养猪业发展。目前疫苗免疫是防控该病的主要措施[1]。市场上猪肺炎支原体相关疫苗主要包括经肌肉注射免疫的灭活苗以及经肺内或滴鼻免疫的活疫苗两种类型[2]。其中灭活苗不能阻止野毒的感染[3],活疫苗经肺内注射免疫效果较好。我们近几年在研究活疫苗的气溶胶免疫技术,以期在活疫苗良好免疫保护的基础上,节省免疫工作的人力成本,降低免疫动物的应激。气溶胶免疫等无针化免疫技术将有更好的市场前景[4]。冯志新等[5]建立了猪支原体肺炎活疫苗(168株)经气溶胶免疫的方法,免疫后疫苗株可定植在猪气管上皮细胞上,并诱导感染猪的黏膜免疫。这一发现证明猪支原体肺炎活疫苗(168株)气溶胶免疫的可行性,气溶胶免疫和肺内免疫一样,都可将活疫苗菌株输送到靶组织,产生占位效应,并激活宿主局部的黏膜免疫应答,这也是支原体活疫苗的主要免疫机理之一[6]。然而经气溶胶免疫后呼吸道中疫苗株含量与经肺内免疫途径的差异还未见报道,为探讨猪肺炎支原体活疫苗168株经气溶胶免疫后疫苗株在体内的增殖规律,本研究在前期开发猪支原体肺炎活疫苗(168株)气溶胶免疫技术的基础上,进一步研究该疫苗株经气溶胶免疫后在免疫猪肺内的占位存留规律与免疫应答水平的相关性,探求该疫苗株气溶胶免疫剂量的优化方式,为猪肺炎支原体活疫苗(168株)气溶胶免疫技术的进一步研发提供依据。
1 材料与方法
1.1 试验动物试验用3周龄不吃初乳猪(snatchfarrowed porcine-colostrum-deprived pig,SF-pCD pig)27头,由江苏省农业科学院兽医研究所根据Huang等[7]的方法培育,经ELISA检测Mhp、猪圆环病毒2型(Porcine circovirus type 2,PCV2)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪瘟病毒(Swine fever virus,CSFV)和猪伪狂犬病毒(Pseudorabies virus,PRV)均为阴性。
1.2 疫苗及稀释液猪支原体肺炎活疫苗(168株)F328:由本实验室自制冻干苗,2 mL/瓶,CCU为2×108CCU/瓶,批号 20160713。猪支原体肺炎活疫苗稀释液由南京天邦生物科技有限公司提供,批号169017。猪支原体肺炎雾化活疫苗稀释液由本实验室自制。
1.3 主要试剂及仪器猪肺炎支原体sIgA检测试剂盒由本实验室自制保存;猪肺炎支原体血清抗体检测试剂盒购自美国爱德士生物科技有限公司;Premix ExTaqTM(Perfect real-time)120次量购自TaKaRa公司;real-time PCR 7500仪购自ABI公司;real-time PCR 8联管购自BIO plastics公司。
1.4 实验设计将上述27头试验猪随机分为3组,G1气溶胶免疫组12头,根据Feng等[5]的方法和剂量进行猪肺炎支原体(168株)的气溶胶免疫,剂量为108CCU/头(10头份);G2肺内免疫组12头,肺内注射免疫猪肺炎支原体活疫苗(168株),剂量为107CCU/头(1头份),同时设立G0阴性对照组3头。所有猪分别于免疫前和免疫后第2 h、7 d、14 d以及28 d时采集全血分离血清,同时按照冯志新等[8]方法采集和预处理鼻拭子,收集鼻拭子浸泡液,-20℃保存备用。另外在上述时间点分别宰杀G1和G2组各3头,对照组在免疫组免疫后28 d宰杀,采集肺泡灌洗液(bronchoalveolar lavage fluid,BALF)(当天需要宰杀的猪在宰杀前先采集血清和鼻拭子)。肺泡灌洗液采集方法:剖检试验猪时,连同气管完整取出肺脏,灌注50 mL灭菌PBS(PH7.2),反复揉捏2 min,倒入已经准备好的灭菌离心管中即为肺泡灌洗液。每个灌洗液样本均取10 mL,18 512×g、4℃离心30 min,分离上清和沉淀,其中上清于-20℃以下保存备用;沉淀用1 mL无菌去离子水重悬,转移到1.5 mL离心管中,-20℃以下冻存备用。
1.5 猪肺炎支原体血清抗体检测试验猪在免疫前和免疫后第2 h、7 d、14 d以及28 d 采集血清,猪肺炎支原体检测试剂盒(IDEXX)按说明书检测血清中猪肺炎支原体特异性IgG抗体。
1.6 鼻拭子和肺泡灌洗液Mhp特异性sIgA检测动物实验结束后,统一取出-20℃以下保存的免疫前和免疫后第2 h、7 d、14 d以及28 d的鼻拭子浸泡液和肺泡灌洗液上清,参照Feng等[9]建立的猪肺炎支原体sIgA检测方法,利用实验室自行组装的猪肺炎支原体特异性sIgA检测试剂盒,进行猪鼻拭子和肺泡灌洗液中Mhp特异性sIgA检测,酶标仪上读取OD450值,根据S/P值=(样品OD450值-阴性对照OD450平均值)/(阳性对照OD450平均值-阴性对照OD450平均值)计算S/P值。
1.7 猪肺泡灌洗液中猪肺炎支原体疫苗株含量检测取出-20℃以下保存的肺泡灌洗液沉淀悬液,混匀,取其中200 uL,100℃水浴10 min后,12 857×g离心10 min,收集上清,即为real-time qPCR模板。利用实验室已建立的猪肺炎支原体real-time qPCR方法[9]进行猪肺泡灌洗液中Mhp 疫苗株含量的测定。
1.8 统计方法采用方差分析的新复极差法(即Duncan法)对各试验组之间的数据进行差异显著性分析。
2 结果
2.1 血清中Mhp特异性IgG抗体检测采集免疫前和免疫后第2 h、7 d、14 d及28 d的血清,猪肺炎支原体血清抗体检测试剂盒(IDEXX)检测血清中Mhp特异性 IgG抗体,结果见表1。由表1可知直至实验结束,G0、G1和G2组所有猪血清抗体均为阴性,未发现转阳现象。
2.2 鼻拭子和肺泡灌洗液中猪肺炎支原体特异性sIgA含量测定动物实验全部结束后,取出-20℃以下保存的鼻拭子浸泡液以及肺泡灌洗液上清,利用实验室研制的猪肺炎支原体sIgA检测试剂盒进行猪肺炎支原体sIgA检测,结果见图1A。由图1A可知对照组实验猪的鼻拭子Mhp sIgA在整个实验过程中保持阴性,没有转阳;气溶胶免疫组和肺内免疫组的鼻拭子Mhp sIgA阳性率呈现先上升后下降的趋势,其中气溶胶免疫组在免疫后第7 d和14 d时阳性率最高,为33.3%,肺内免疫组在免疫后第7 d时最高,为44.4%。在免疫后第7 d和14 d时,气溶胶免疫组平均S/P值相比对照组显著升高(p<0.05),但28 d有所下降,相比对照组差异不显著(p>0.05)。肺内免疫组的鼻拭子Mhp sIgA在免疫后7 d和14 d平均S/P值相比对照组显著升高(p<0.05),但28 d有所下降,相比对照组差异不具备统计学意义(p>0.05)。两实验组之间比较,鼻拭子Mhp sIgA在免疫后的几个监测时间点差异均不具备统计学意义(p>0.05)。
肺泡灌洗液sIgA检测结果见图1B。由图1B发现气溶胶免疫组肺泡灌洗液中的Mhp sIgA在免疫后第14 d开始部分转阳(阳性率为33.33%),到第28 d已全部转阳(阳性率为100%),sIgA浓度相比对照组差异具备极显著统计学意义(p<0.01)。而肺内免疫组在免疫14 d时已全部转阳(阳性率为100%),28 d时阳性率也为100%,相比对照组差异具有极显著统计学意义(p<0.01)。但免疫后14 d和28 d,两实验组肺泡灌洗液中的平均Mhp sIgA浓度差异不具备统计学意义(p>0.05)。
2.3 肺泡灌洗液中疫苗株含量测定由图2可知,在免疫后第2 h、7 d、14 d和28 d,气溶胶免疫组肺泡灌洗液内平均Mhp疫苗株含量分别为0.848×104、1.986×104、2.038×104和1.266×104拷贝数/mL,分别是相应肺内免疫组的0.37倍、1.01倍、0.88倍以及0.52倍。而空白对照组全为阴性,未检测出疫苗株。同一时间点两免疫组之间比较,仅2 h时气溶胶免疫组肺泡灌洗液内Mhp疫苗株含量显著低于肺内免疫组,具有统计学意义(p<0.05),其余时间点差异不显著,不具有统计学意义(p>0.05)。
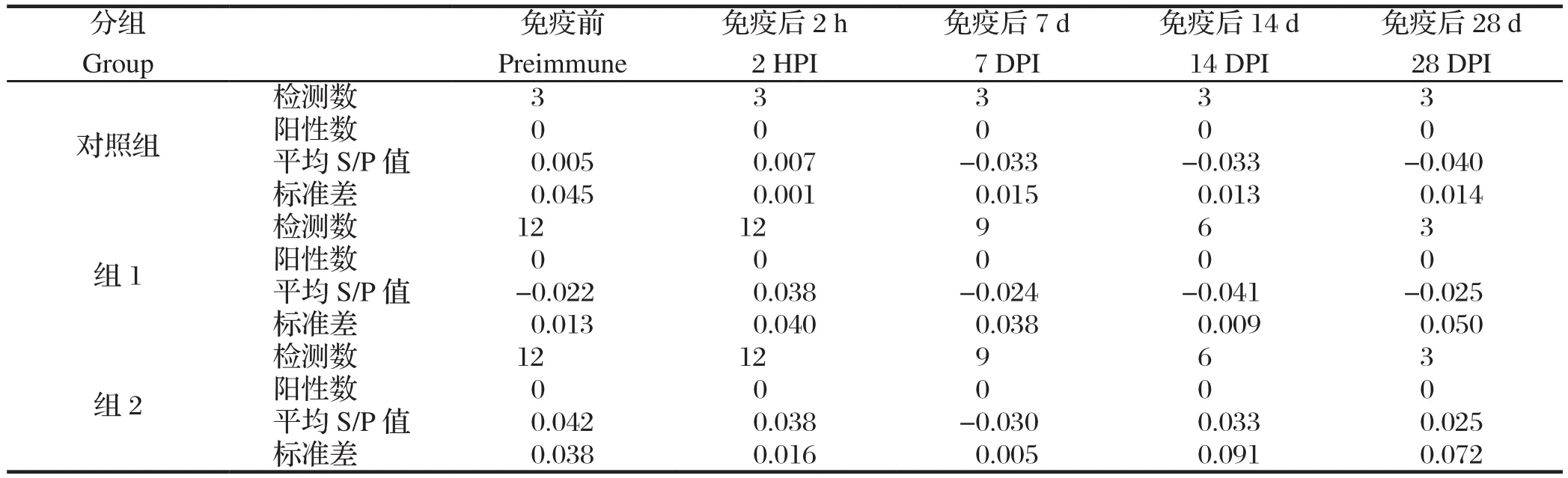
表1 免疫前后各试验组猪肺炎支原体血清IgG检测结果Table 1 Mhp speci fic IgG antibody response in sera of vaccinated and Non-vaccinated piglets, respectively

图1 免疫前后各试验组鼻拭子和肺泡灌洗液Mhp sIgA检测结果Fig. 1 Mhp speci fic sIgA antibody response in nasal cavities and BALF of vaccinated and non-vaccinated piglets,respectively
3 讨论
雾化免疫是通过雾化发生器,使疫苗形成一定大小的雾滴,均匀地悬浮于空气中,随呼吸进入体内。这种免疫方式对呼吸道有亲嗜性的疫苗尤为有效,如鸡新城疫疫苗和传染性支气管炎弱毒疫苗等[11]。疫苗通过喷雾免疫进入体内后,一方面在呼吸道粘膜局部刺激吞噬细胞分化浆细胞,产生局部抗体或干扰素的作用,另一方面被吞噬细胞吞噬后产生体液免疫。其免疫效果较好,如丁美娟等[12]对比了鸡毒支原体气雾免疫的免疫效果,发现气雾免疫与点眼免疫同样能产生良好的免疫效果。因雾化免疫省工省力,近年来在大型规模禽场、哺化场鸡群越来越普及,但由于猪的呼吸道结构特殊,普通的雾化免疫难以用于猪群免疫,而设计特殊粒径要求的气溶胶免疫在猪用疫苗研发上具有很好的前景。猪肺炎支原体主要定植在猪气管上皮细胞上,对猪呼吸道具有很好的亲嗜性,且猪肺炎支原体本身可通过空气传播[13],这是猪支原体肺炎活疫苗在肺内免疫的基础上能够开发气溶胶免疫途径的前提条件。冯志新等[5]报道的猪支原体肺炎活疫苗气溶胶免疫技术,解决了活疫苗如何通过气溶胶进入猪呼吸道的问题。本研究在此基础上,进一步探讨猪支原体肺炎活疫苗(168株)经气溶胶免疫途径进入免疫猪呼吸道和肺内后的增殖情况,一方面通过血清抗体以及上呼吸道和下呼吸道sIgA的检测验证该疫苗株诱导的免疫应答情况,更重要的是探讨疫苗株经气溶胶免疫后在免疫猪体内的增殖规律及其和sIgA抗体分泌规律的相关性。
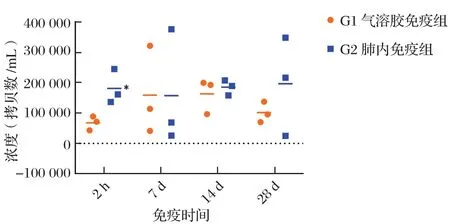
图2 肺泡灌洗液中猪肺炎支原体活疫苗(168株)荧光定量PCR检测结果Fig.2 Results of fluorescent qPCR detection of Mhp live vaccine (168 strains) in bronchoalveolar lavage fluid
本研究结果显示无论是肺内免疫还是气溶胶免疫,在整个动物实验过程中,始终没有产生血清特异性IgG抗体,说明猪支原体肺炎活疫苗(168株)经气溶胶免疫和肺内注射免疫均不能有效诱导全身体液免疫,这一结果和冯志新等[4]研究结果一致。在黏膜免疫方面,姚景霆等[14]研究发现,猪肺炎支原体感染仔猪后第6 d,呼吸道中抗Mhp P36、P46、P97R1的3种特异性sIgA抗体分泌量均开始上升,于感染后第12 d达到高峰,并可持续到第21 d。本研究发现两试验组鼻拭子sIgA水平在免疫后第7~14 d均有所升高,相比对照组差异显著,但到第28 d时又有所下降,结果与姚景霆等[14]研究结果一致,说明气溶胶免疫和肺内免疫均能在一定时间内短暂诱导免疫猪上呼吸道的黏膜免疫,为免疫猪提供早期保护。虽然在免疫后第28 d上呼吸道sIgA水平有所下降,但此时免疫猪已诱导了足够的下呼吸道黏膜免疫,以此对免疫猪进行保护。本研究发现,气溶胶免疫组在免疫后第14 d部分样品肺泡灌洗液中已检测到Mhp sIgA抗体,28 d时所有免疫猪均有较高浓度的Mhp sIgA抗体水平,而肺内免疫组在免疫后14 d已全部转阳,并持续到实验结束。本研究还发现肺泡灌洗液sIgA浓度在免疫后第14 d后比同时间点鼻拭子sIgA浓度高许多,说明猪支原体肺炎活疫苗(168株)具有更强烈的诱导下呼吸道黏膜免疫的功能,这一结果与冯志新等[15]早期研究结果一致。另一方面,在免疫后第28 d时两试验组sIgA水平相互比较差异不显著,说明猪支原体肺炎活疫苗(168株)经气溶胶免疫诱导下呼吸道产生的黏膜免疫比经肺内免疫途径相对较慢,但最终诱导的sIgA水平没有差异,均能很好的诱导黏膜免疫。
黏膜免疫仅仅是猪支原体肺炎活疫苗的免疫机制之一,占位效应是支原体活疫苗肺内免疫和气溶胶免疫的特殊免疫机制[6],能够阻止Mhp野毒的入侵,是猪肺炎支原体活疫苗的优势之一。活疫苗占位效果与支气管上皮细胞上疫苗株的黏附量直接相关。气溶胶免疫组中雾化的疫苗株在免疫过程中就能接触气管上皮细胞表面,车巧林等[16]发现支原体仅需要1 h就能大量黏附宿主细胞,本实验在免疫后第2 h即可在肺泡灌洗液中检出疫苗株。由于黏附力的作用,可能呼吸道中实际感染剂量要高于肺泡灌洗液中的检出量,但在免疫后2 h,气溶胶免疫组的疫苗载量要显著低于肺内免疫组,气溶胶免疫组大量气溶胶的散失导致较低的有效吸入量是造成组间差异的主要原因之一。肺内免疫组呼吸道中大量残存未感染黏附的疫苗株也可能是影响真实载量检测的原因之一。尽管试验猪数量限制以及个体差异等因素影响了疫苗株定植规律的表现,感染7 d以后的数据或许更能反映疫苗株在呼吸道的定植情况。另外,冯志新等[17]前期研究发现,在雾化过程中产生的切割力,以及外环境等因素会造成疫苗活力的损失。在气溶胶免疫时加大疫苗的免疫剂量或者在疫苗中添加保护剂和免疫增强剂是气溶胶疫苗研发需要考虑的策略。在本实验中,在免疫后第7 d直至实验结束,气溶胶免疫组和肺内免疫组肺泡灌洗液中疫苗株的含量没有显著差异,说明两种免疫途径均能起到很好的占位作用。
Hua等[18]研究发现,猪肺炎支原体在呼吸道内的含量与其诱导的黏膜免疫有关,鼻拭子Mhp sIgA水平越高,其病原含量越低。本实验同样发现,随着免疫组下呼吸道特异性sIgA抗体的升高,免疫组呼吸道中疫苗株的增殖在免疫后第7 d后趋向平缓。活疫苗诱导的黏膜免疫水平可能调节疫苗株在体内的定植及复制,这一动态的变化或许是影响疫苗免疫效力的主要因素之一,所以不能仅仅靠黏膜免疫或疫苗株定植情况的某一项指标评判疫苗的免疫效力,需要综合考虑所有因素,并进一步做攻毒实验来进行疫苗保护率的确定。
猪支原体肺炎活疫苗(168株)经气溶胶免疫后,和肺内免疫一样可以诱导免疫猪的局部黏膜免疫,具有同等的占位效应,经气溶胶免疫的疫苗株在免疫仔猪体内的定植情况与其诱导的黏膜免疫水平有关。

