温和条件下柱前标记-高效液相色谱-质谱法测定枸杞多糖中单糖组成
赵孟欣, 王泽岚, 孟 哲, 李吉光, 李和平, 刘万毅
(宁夏大学,省部共建煤炭高效利用与绿色化工国家重点实验室,化学化工学院, 宁夏 银川 750021)
植物多糖(plant polysaccharide)是从植物中提取得到的一种富含醛单糖(鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖等)和酮单糖(果糖)、通过糖苷键连接在一起形成的多聚物。大量研究证明,许多植物多糖均具有多种生物活性和生理功能,如免疫调节[1]、抗肿瘤[2,3]、抗氧化[4,5]、抗疲劳[6]、控制血糖[7]以及保护肝功能等[8],而且对机体无毒副作用。近几十年,已有近10种植物多糖(如枸杞多糖、香菇多糖、人参多糖以及猪苓多糖等)用于抗肿瘤、抗艾滋病及糖尿病治疗,并已进入临床实验阶段[9]。在植物多糖的结构特征、理化性质及其构效关系的研究中,单糖组成是最基本的和最关键性的研究对象。目前,植物多糖类药品、食品和保健品纷涌上市,这些产品的质量控制引起了人们的极大关注。因此,为确保植物多糖质量可控,统一规范植物多糖中典型单糖分布将成为一个非常重要的质量控制环节。
植物多糖中单糖组成分析包括多糖水解为单糖、单糖间的相互分离及对逐个分离的单糖进行检测。其中植物多糖大分子的降解方法有多种,包括超声波[10,11]、酶催化[12,13]、碱催化[14]、酸催化[15-17]等,其中采用易挥发的三氟乙酸在120 ℃下进行多糖水解是目前的主流技术。围绕单糖组成的检测分析领域也取得了较大的研究进展,但仍存在一些问题。由于单糖分子结构中缺少发色基团,一定程度上限制了对单糖组成的分析检测。为在单糖组成分析过程中获得较高的检测灵敏度,单糖分子的化学衍生化成为认识单糖组成研究的热点。1-苯基-3-甲基-5-吡唑啉酮(PMP)是一种可以在强碱性的NaOH条件下与醛单糖反应的通用化学修饰试剂,其衍生化条件及其衍生化机理均有报道[18-20]。但不足的是,同样在强碱性NaOH条件下,PMP无法修饰酮单糖(果糖)没有引起人们的关注。果糖是一种大量存在的重要天然酮单糖,其同分异构体为吡喃型果糖和呋喃型果糖(如图1)。研究表明,呋喃型果糖能破坏细菌的细胞壁,并在细菌细胞的繁殖期起杀菌作用[9,21]。因此,了解果糖在枸杞多糖中的分布尤为重要。目前,采用PMP衍生化植物多糖水解产物而鉴定果糖分布的研究很少有报道[21]。预测果糖的构型和同时鉴定枸杞多糖中多种醛单糖和酮单糖的研究尚未见报道。
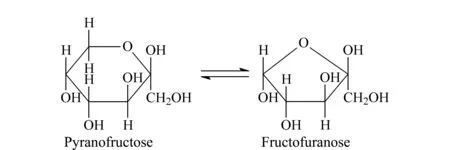
图 1 果糖的同分异构体Fig. 1 Isomers of fructose
本文建立了一种在温和NH3·H2O条件下,PMP衍生化多糖水解产物中醛单糖和酮单糖(果糖)的测定方法。该法用于4个地区枸杞多糖中单糖组成的测定,获得了不同地区种植的枸杞多糖中果糖和多种醛单糖含量的分布,为确保植物多糖质量可控及了解多糖中典型单糖的分布具有重要意义。
1 实验部分
1.1 仪器与试剂
高效液相色谱-串联质谱(LC/MS-2010EV,日本Shimadzu公司);色谱柱:Kromasil-C18(100 mm×4.6 mm, 3.5 μm); KQ-500DE型超声波清洗仪(昆山市超声仪器有限公司); LGJ-10C真空冷冻干燥机(北京四环科学仪器厂有限公司); JC-ZF型旋转蒸发仪(上海丹鼎国际贸易有限公司)。
单糖标准品:果糖(fructose, Fruc)、葡萄糖(glucose, Glu)、鼠李糖(rhamnose, Rha)、木糖(xylose, Xyl)、阿拉伯糖(arabinose, Ara)、甘露糖(mannose, Man)、半乳糖(galactose, Gal)、脱氧核糖(ribose, Rib)(纯度>99%,上海中秦化学试剂有限公司);双糖标准品:蔗糖(sucrose)、麦芽糖(maltose)(纯度>99%,上海中秦化学试剂有限公司);衍生化试剂:PMP(上海晶纯试剂有限公司);透析袋(截留相对分子质量8 000,上海新睿生物科技有限公司); SZ-97自动三重水蒸馏器(上海亚荣生化仪器厂);氨水、盐酸、氢氧化钠及三氟乙酸(TFA)等其余试剂为分析纯(天津市大茂化学试剂厂)。
1.2 标准溶液的制备
准确称取0.018 0 g单糖标准品,用氨水定容至5 mL,各单糖标准溶液的质量浓度均为3 600 mg/L,储存在4 ℃冰箱中备用。
分别准确称取8种单糖标准品各0.036 g,用浓氨水(28%)定容至10 mL,混合单糖标准溶液中各单糖的质量浓度均为3 600 mg/L,储存在4 ℃冰箱中备用。
准确移取不同体积的上述混合单糖标准溶液(3 600 mg/L),用氨水稀释成系列质量浓度(0.18~38.8 mg/L)的标准工作溶液。
从市场购买4个地区种植的枸杞干果。1#样品为宁夏中宁枸杞,2#样品为新疆精河枸杞,3#样品为河北苦枸杞,4#样品为云南黑枸杞。
1.3 样品处理
1.3.1枸杞多糖的提取及纯化
枸杞中多糖的提取采用80%(v/v)的乙醇提取法[22-23]。将枸杞干果置于真空干燥烘箱内,于50 ℃下烘干后粉碎,称取干燥枸杞干果粉末置于烧杯中,加体积分数为80%的乙醇,在80 ℃水浴中提取0.5 h,过滤滤渣,加蒸馏水在100 ℃水浴中再提取4 h,重复2次,合并滤液。
滤液采用Sevag法[24]脱去蛋白质后,加入活性炭,70 ℃水浴1 h,过滤除去活性炭。滤液用旋转蒸发仪浓缩至黏稠,得到去除蛋白质和色素的粗多糖。取适量枸杞粗多糖置于透析袋中(截留相对分子质量8 000),吊于装有蒸馏水的大烧杯内,使其充分与水接触,多次换水,透析24 h以除去小分子化合物和游离的单糖。将透析过的多糖置于蒸发皿中,冷冻干燥,得到相对纯净的枸杞多糖。将4个不同产地10个批次的枸杞干果按上述方法提取,制得枸杞多糖。
流行病学统计表明,脑梗死的发生率在400/10万-700/10万之间[4],我国老龄化社会问题突出,该疾病的发生率也在增加,因此临床中关注度高,该疾病的死亡率和残疾率居高不下[5]。急性脑梗死是导致人类死亡的一个因素,急性脑梗死有四分之三的患者会出现肢体功能障碍,因此患者的生活受到了威胁,增加了患者的负担。在研究中,脑梗死患者的抢救几率比较高,但是由于脑组织缺氧缺血,导致了脑组织的损伤,治疗后,患者存在不同程度的肢体功能障碍情况。因此,临床中为了让患者的残疾率和死亡率下降,让患者能够自理生活,临床中都是往这方面去研究和探讨。
1.3.2枸杞多糖总糖含量的测定
枸杞中多糖总糖含量的测定采用硫酸苯酚法[25]。准确称取1.0 mg无水葡萄糖标准品于10 mL容量瓶,加水至刻度,其质量浓度为100 mg/L,准确移取0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL于10 mL离心管中,加水至1.0 mL,再加入5%(v/v)苯酚溶液0.5 mL,摇匀,迅速加入2.5 mL浓硫酸(98%),摇匀后置于70 ℃恒温水浴中30 min,取出后冷却至室温。以水作为空白,在490 nm波长处测吸光度,以吸光度为纵坐标,质量浓度为横坐标,绘制标准曲线。
准确称取10 mg枸杞多糖样品,用水定容至100 mL,准确移取0.2、0.6、0.8 mL置于10 mL离心管中,加水至1.0 mL,再加入5%(v/v)苯酚溶液0.5 mL,摇匀,迅速加入2.5 mL浓硫酸,摇匀后置于70 ℃恒温水浴中30 min,取出后冷却至室温。以水作为空白,在490 nm波长处测定吸光度,平行测定3次。将测得的吸光度代入标准曲线,计算枸杞多糖的质量浓度。
1.3.3枸杞多糖的水解
准确称取枸杞多糖30 mg于30 mL的反应釜中,加入2 mol/L的TFA溶液20 mL,密封反应釜,置于干燥箱中,70 ℃下水解反应50 min。
1.3.4PMP衍生化
分别移取各种单糖(Fruc、Glu、Rha、Xyl、Ara、Man、Gal、Rib)的氨水溶液300 μL于离心管中,加入0.3 mol/L PMP-甲醇溶液300 μL,涡旋混合,于70 ℃下水浴反应2 h,冷却后加300 μL 0.3 mol/L HCl溶液中和,氮气吹干。在干燥后的残留物中加入500 μL的水和500 μL CHCl3,涡旋1 min,除去CHCl3有机相(萃取过量的PMP),续3次加入500 μL的CHCl3,涡旋,除去CHCl3有机相,最后移取上清液于离心管中,高速离心10 min,移取上清液待HPLC-MS分析。
1.4 仪器条件
Kromasil-C18色谱柱(100 mm×4.6 mm, 3.5 μm);流动相A为100 mmol/L醋酸铵溶液,B为乙腈。线性梯度洗脱:0.1~5.0 min, 10%B~20%B; 5.0~30.0 min, 20%B~30%B; 30.0~45.0 min, 30%B~70%B; 45.0~47.0 min, 70%B; 47.0~50.0 min, 10%B。流速:0.35 mL/min;柱温:35 ℃;进样量:20 μL。
1.4.2质谱条件
采用电喷雾离子(electron spray ionization, ESI)源正离子扫描模式,m/z80~800;选择离子扫描(selective ion monitoring, SIM)模式进行定量分析。表1为PMP标记的8种单糖离子和对应的保留时间。毛细管电压:3.5 kV;毛细管温度:320 ℃;干燥器流速:1.5 L/min,吹扫气流速:0.1 MPa。采用SIM采集数据时PMP衍生化多种单糖产物的加和离子见表1。
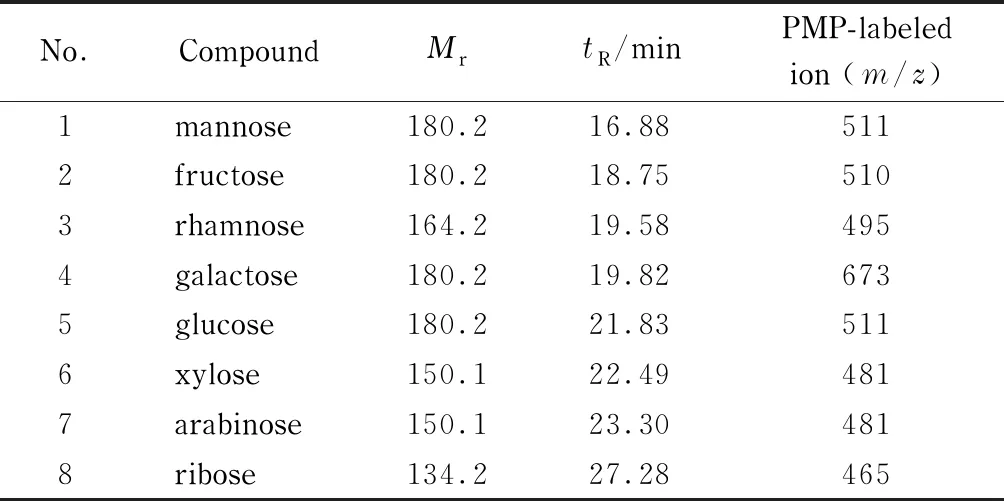
表 1 PMP标记的8种单糖离子及其保留时间(tR)Table 1 1-Phenyl-3-methyl-5-pyrazolone (PMP)-labeled eight monosaccharide ions and their retention times (tR)

图 2 NaOH环境下PMP衍生化葡萄糖和果糖产物的总离子流色谱图及其对应的质谱图Fig. 2 Total ion chromatograms and the corresponding mass spectra of glucose and fructose derivatized by PMP under sodium hydroxide condition
2 结果与讨论
2.1 PMP衍生化环境的优化
在强碱NaOH条件下,采用PMP衍生化单糖是当前最为普遍的单糖修饰技术[16-20],但是很难检测到PMP衍生化果糖产物的信号[9,16-20]。因此,考察PMP衍生化单糖环境对衍生化产物的影响尤为必要。
2.1.1氢氧化钠环境下PMP衍生化单糖的效果
分别移取Fruc和Glu水溶液300 μL于离心管中,加入300 μL 0.3 mol/L PMP-甲醇溶液和300 μL 0.3 mol/L的氢氧化钠溶液,涡旋混合,按1.3.4节方法进行衍生化实验。在NaOH环境下,PMP衍生化Glu和Fruc产物的总离子流色谱图及其对应的质谱图如图2,可观察到PMP衍生化Glu产物的离子化信号很弱,其衍生化产物的加和离子m/z为511,和文献[18-20]一致。PMP修饰果糖的衍生化产物无信号,也和文献[9,16-20]一致。实验结果再次证明,在NaOH的强碱性环境下,PMP难以修饰果糖。以氨水代替NaOH,进一步考察在温和的NH3·H2O环境下,PMP能否衍生化果糖。
2.1.2氨水环境下PMP衍生化单糖的效果和机理
准确移取Glu和Fruc氨水溶液各300 μL于离心管中,按1.3.4节方法进行衍生化实验。在NH3·H2O环境下,PMP衍生化Glu和Fruc的产物均有很强的离子化信号。图3为Glu和Fruc在氨水环境下衍生化产物的总离子流色谱图及其对应的质谱图。实验证明,在温和的氨水环境下,Glu和Fruc经PMP衍生化后生成了稳定的衍生化产物,其加和离子分别为m/z511和510。

图 3 NH3·H2O环境下PMP衍生化葡萄糖和果糖产物的总离子流色谱图及其对应的质谱图Fig. 3 Total ion chromatograms and the corresponding mass spectra of glucose and fructose derivatized by PMP under ammonia condition
在NaOH和NH3·H2O条件下,PMP衍生化Glu的反应产物经质谱检测,其加和离子m/z均为511,与文献[18-20,26-28]一致,其衍生化机理见图4。PMP分子结构中的2-位氮原子和羰基氧原子有较强的电负性,而碱性条件下缺少带正电荷的H+,因此,这两个基团的电负性诱导吡唑环上的电子转移。最终造成4-位碳原子上的电子云密度减小,碳氢键断裂,氢以正离子的形式离开吡唑环,与OH-结合形成一个水分子,而PMP则形成一个以4-位碳为活性中心的亲核试剂。
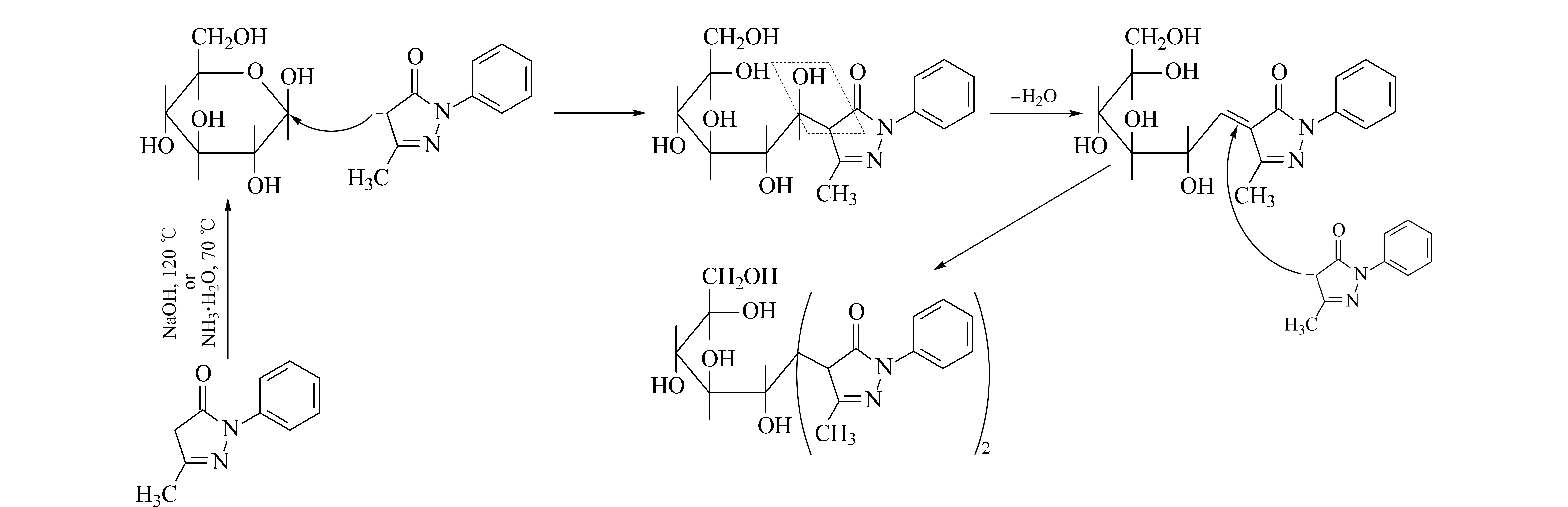
图 4 PMP衍生化葡萄糖的机理Fig. 4 Mechanism of glucose derivatized by PMP
在溶液中,单糖主要以环状形式存在,尤其在碱性介质中更稳定,而在酸性介质中不稳定[29]。研究表明,单糖以环状结构在碱性溶液中与亲核试剂发生反应[27-29]。亲核试剂PMP的活性中心4-位碳负离子首先进攻醛单糖的1-位醛基碳,导致环状单糖的碳氧键断裂,醛糖1-位碳上的质子转移给氧原子形成OH,随着一个水分子的失去,在醛糖1-位碳原子和PMP的4-位碳原子之间形成双键,产生了单分子PMP标记的单糖。此后,另一个处于亲核状态的PMP分子的4-位碳原子进攻上一个PMP吡唑环与单糖1-位碳之间新形成的双键。最终,2个PMP分子标记1个醛糖Glu分子(Mr180),形成双PMP(m/z174)的衍生化产物,其加和离子的m/z为511(即180+174×2-17)。
在NaOH条件下,PMP不修饰果糖,与文献[9,16-20]报道相符。而在氨水条件下,PMP修饰果糖后,经质谱检测获得较强的质谱信号,其标记物的加和离子m/z为510。显然,衍生化环境的pH不影响衍生化产物,因此PMP标记Fruc的衍生化机理如图5所示。在NH3·H2O环境下,NH3作为亲核试剂与果糖的羰基碳发生亲核加成反应,生成式(2);式(2)中2-位碳上的OH与1-位碳上的H脱水生成式(3);式(3)发生烯醇式互变得到式(4),即得到含有NH2的醛糖(Mr179),其醛糖进一步在NH3·H2O环境下与PMP发生衍生化。亲核试剂PMP的4-位碳负离子首先进攻醛基1-位碳原子,并和PMP的4-位碳原子之间形成双键,产生了单分子PMP标记的单糖。此后,另一个处于亲核状态的PMP分子的4-位碳原子进攻上一个PMP吡唑环与单糖1-位碳之间新形成的双键。最终,2个PMP分子标记1个胺基醛糖分子(Mr179),形成双PMP衍生化的产物,其加和离子的m/z为510(即179+174×2-17)。
从PMP亲核试剂标记果糖的机理分析,由于环状呋喃型果糖的酮羰基与亲核试剂NH3发生亲核加成反应的概率大,形成胺基醛糖的产率较高,经PMP标记后的质谱信号也较强,因此可在温和的氨水环境下实现PMP对果糖的标记,并且获得灵敏度较高的MS检测信号。然而,能否通过衍生化产物确定果糖的构型还需进一步的确认。
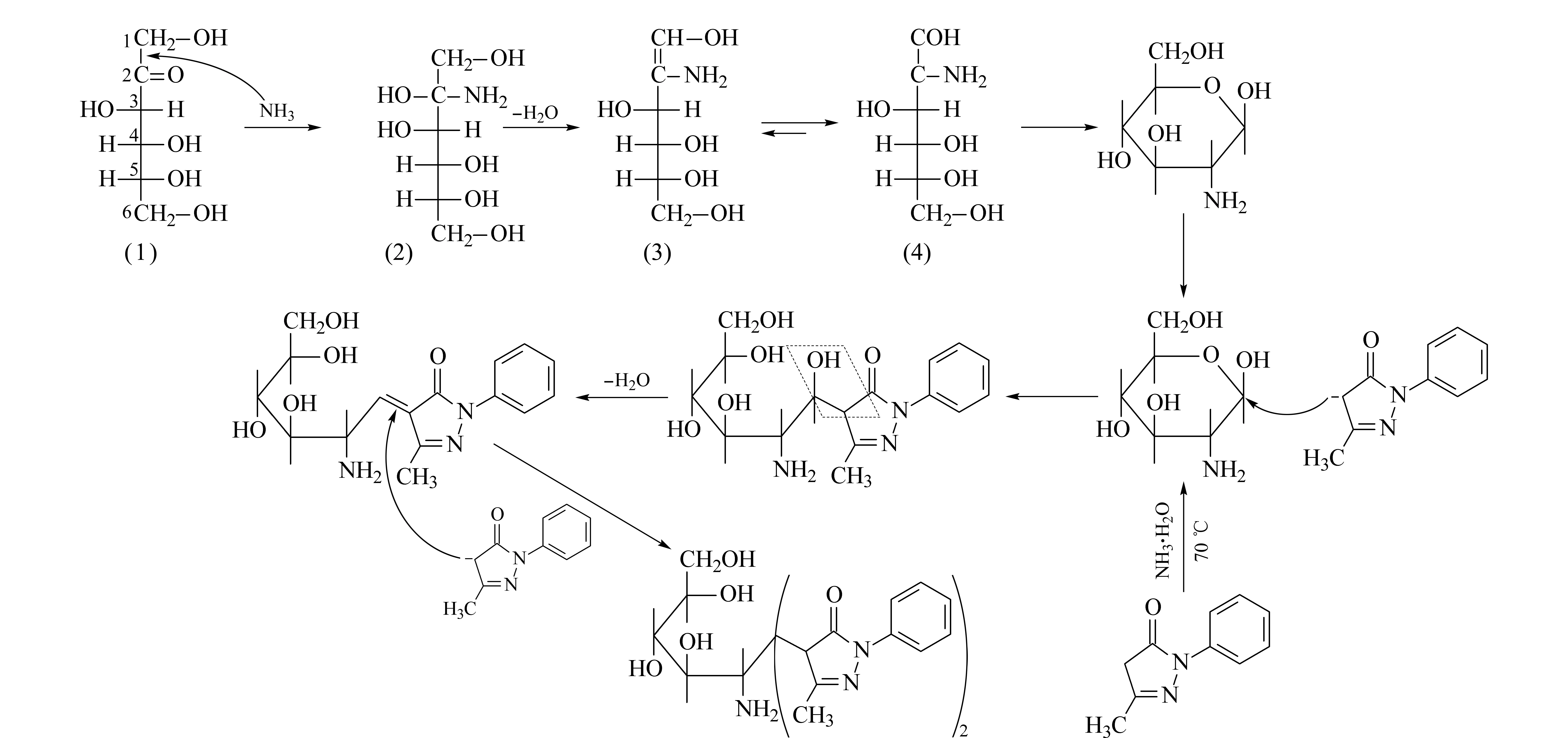
图 5 PMP衍生化果糖的机理Fig. 5 Mechanism of PMP-derivatized fructose
在温和的NH3·H2O环境下,PMP成功的衍生化标记了果糖和葡萄糖。我们提出了NH3·H2O环境下,PMP衍生化果糖的机理。实验进一步对衍生化试剂PMP的用量、衍生化时间及对多种醛单糖衍生化产物的确认做了大量的工作。6种醛单糖(Man、Rha、Gal、Xyl、Ara、Rib)的衍生化产物的总离子流色谱图及其对应的质谱图见图6。

图 6 NH3·H2O环境下PMP衍生化6种醛单糖产物的总离子流色谱图及其对应的质谱图Fig. 6 Total ion chromatograms and the corresponding mass spectra of six monosaccharides derivatized by PMP under ammonia condition
2.2 水热法酸催化水解双糖条件的优化
文献[15-20, 26-28]报道,多糖水解的方法多采用高温(120 ℃)、酸催化水解4 h的条件。较高的温度和较长的水解时间对部分多糖造成一定程度的碳化破毁,使得部分单糖的回收率降低,从而影响水解样品检测的准确性。由于糖苷键对水解的敏感性不同,以及水解成单糖的难易程度不同,到目前还无一种低温快速的通用技术使植物多糖完全水解而不使其出现降解。
本文采用水热法,TFA催化水解蔗糖和麦芽糖来优化水热法酸催化水解的最佳条件。称取蔗糖、麦芽糖各0.01 g,置于30 mL的反应釜中,加入2 mol/L的TFA溶液20 mL,分别在50、60、70、80、90、100 ℃进行酸水解反应120 min后,按照1.3.4节进行衍生化实验。采用HPLC-MS检测双糖水解产物中各单糖的回收率,以评价水热法水解多糖的效率。图7为不同温度下,水热法水解双糖产物中单糖的回收率。先选定水解反应时间为120 min,考察不同温度下衍生化反应的产率(以产物的色谱峰面积为纵坐标,水解温度为横坐标)。结果表明,在60~80 ℃范围内,蔗糖和麦芽糖水解的单糖衍生物的峰面积达到最大值;温度高于70 ℃时,水解单糖的衍生化产物的峰面积趋于减小,尤其是在100 ℃时,已经检测不到水解单糖的信号。因此本文选定水热法水解反应温度为70 ℃。又考察了水解温度在70 ℃时,水解不同反应时间(30~140 min)对衍生化反应产率的影响(见图8),其结果表明:水解50 min时蔗糖和麦芽糖水解产物的峰面积均达到最大值。根据上述实验结果,低温水热法水解多糖的最佳条件为:酸催化水解的温度为70 ℃和水解时间50 min。
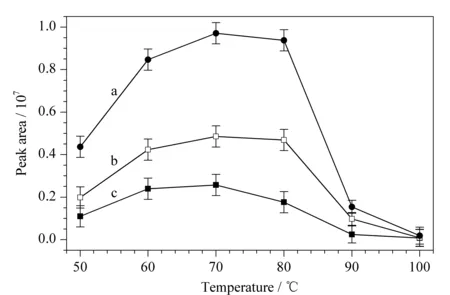
图 7 温度对双糖水解产物的产率的影响(n=3)Fig. 7 Effect of temperature on the yield of disaccharide hydrolysate (n=3) a. Glu, maltose hydrolyzed product; b. Glu, sucrose hydrolyzed product; c. Fruc, sucrose hydrolyzed product.
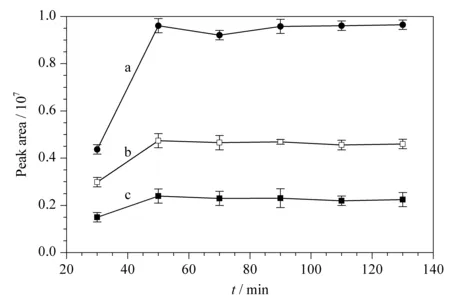
图 8 70 ℃时水解时间对双糖水解后产物的产率的影响(n=3)Fig. 8 Effect of hydrolysis time on the yield of disaccharide hydrolysate at 70 ℃ (n=3) a. Glu, maltose hydrolyzed product; b. Glu, sucrose hydrolyzed product; c. Fruc, sucrose hydrolyzed product.
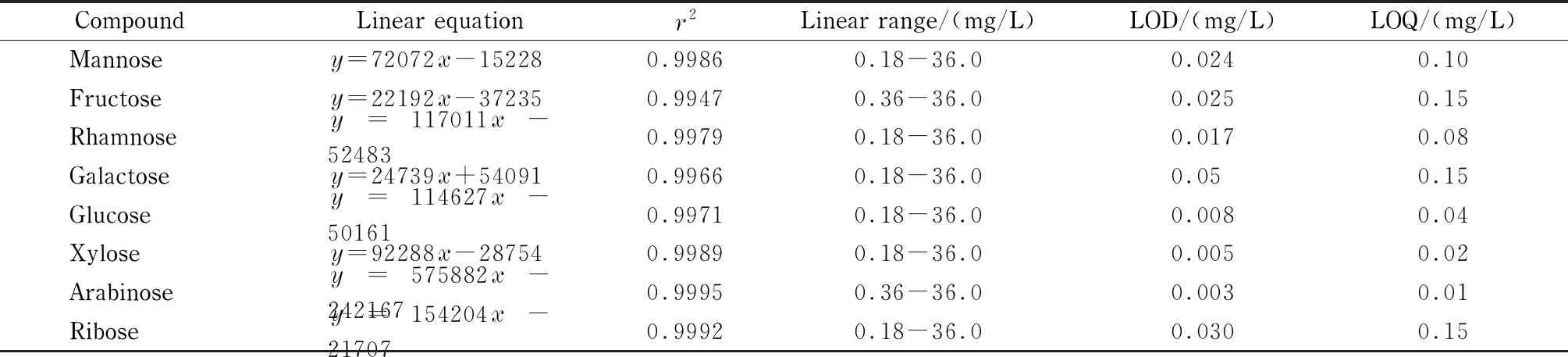
表 2 PMP标记的8种单糖的线性方程、回归系数、检出限和定量限Table 2 Linear equations, correlation coefficients (r2), LODs and LOQs of the eight PMP-labeled monosaccharides
y: peak area;x: mass concentration, mg/L.
2.3 色谱条件的优化
液相色谱-质谱法分析单糖标记产物,使用Kromasil-C18色谱柱(100 mm×4.6 mm, 3.5 μm)。流动相添加剂的选择有利于提高分析的灵敏度,改善峰形,提高分离度。结合文献[18-20],考察了0.1%(v/v)乙酸-乙腈和不同浓度乙酸铵-乙腈作为流动相的效果。乙酸铵-乙腈作为流动相有利于8种单糖标记物的分离,提高检测的灵敏度。同时又考察了10、50、100和120 mmoL/L乙酸铵-乙腈作为流动相的效果。实验结果表明,100 mmol/L乙酸铵-乙腈作为流动相,基本实现6种单糖标记物的分离,并且提高了每个单糖检测的灵敏度。然而,考虑到Gal(19.82 min)和Rha(19.58 min)标记物没有达到基线分离,同时Glu和Man标记物的加和离子m/z均为511, Xyl和Ara标记物的加和离子m/z均为481,因此采用多通道SIM模式采集数据。图9为多通道采集时PMP标记的8种单糖标记物的总离子流色谱图。
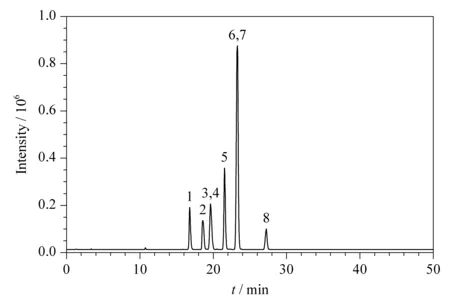
图 9 SIM模式下单糖PMP衍生化产物的总离子流色谱图Fig. 9 Total ion chromatogram of PMP-labeled monosaccharides in SIM mode Peaks: 1. Man; 2. Fruc; 3. Rha; 4. Gal; 5. Glu; 6. Xyl; 7. Ara; 8. Rib.
2.4 方法验证
2.4.1线性关系、检出限、定量限
在最佳的色谱条件下,对8种单糖化合物在0.18~38.8 mg/L范围内进行了方法验证。分别以信噪比(S/N)为3和10的质量浓度为检出限和定量限。线性方程、回归系数(r2)、检出限和定量限见表2。
2.4.2回收率和精密度
准确称取枸杞多糖30 mg于30 mL的水热反应釜中,加入2 mol/L的TFA溶液20 mL,密封反应釜并置于干燥箱中,70 ℃下酸催化水解反应50 min,转移至100 mL容量瓶中(多糖水解液的质量浓度为300 mg/L),用蒸馏水定容。分别移取300 μL枸杞多糖水解液,置于10 mL的容量瓶中,加标水平为8种单糖定量限的10倍(1.8 mg/L)和100倍(18.0 mg/L),用氨水定容。按照1.3.4节操作方法制备样品,进行HPLC-MS测定。加标处理后的样品溶液在一天内重复测定5次并计算日内精密度(RSD);重复测定5天并计算日间精密度(RSD)。平均加标回收率为65.1%~116.2%,日内精密度和日间精密度分别为3.8%~10.2%和6.6%~15.0%(见表3),说明PMP柱前标记方法适用于枸杞多糖水解液中单糖的测定。
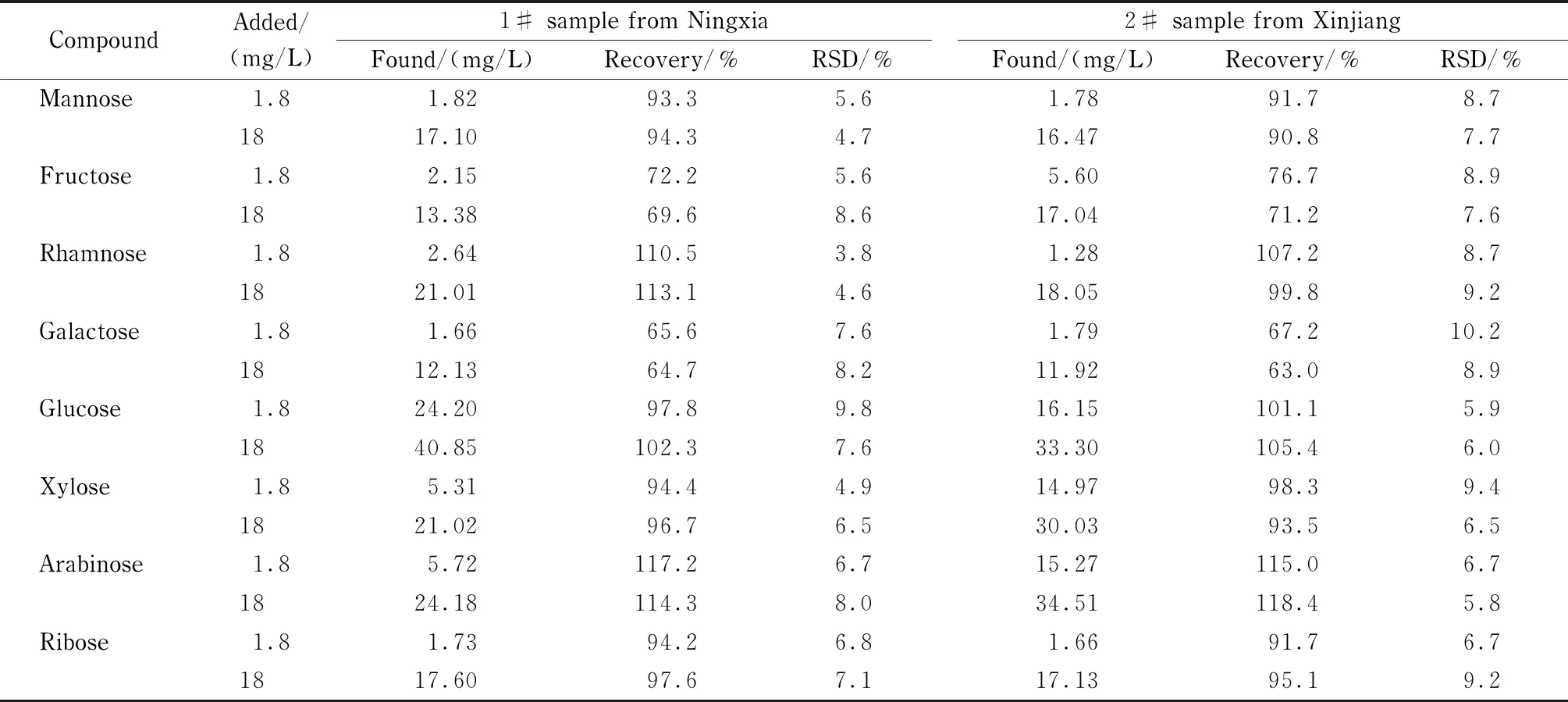
表 3 枸杞多糖样品中8种单糖的加标回收率及精密度(n=5)Table 3 Spiked recoveries and precisions of the eight monosaccharides in polysaccharide samples of Lycium barbarum L. (n=5)
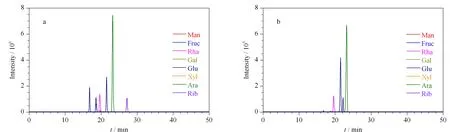
图 10 枸杞多糖水解溶液加标(a)前、(b)后的PMP单糖标记物的总离子流色谱图Fig. 10 Total ion chromatograms of PMP-labeled monosaccharides from polysaccharides hydrolyzed samples of Lycium barbarum L. (a) before and (b) after spike
2.5 枸杞多糖水解产物衍生化单糖的测定
不同地区枸杞干果中提取的多糖及含量顺序为:新疆精河枸杞(40.30 mg/g)>宁夏中宁枸杞(39.51 mg/g)>云南黑枸杞(31.02 mg/g)>河北苦枸杞(27.11 mg/g)。将4种市售枸杞多糖按照1.3.3节操作方法进行枸杞多糖样品的水热法酸催化水解,再按照1.3.4节操作方法衍生化标记水解产物中的单糖,然后进行HPLC-MS测定(见图10)。
通过比较发现,4种市售枸杞多糖水解产物中PMP单糖标记物组分与8种标准单糖标记物的出峰顺序、保留时间、PMP标记离子的m/z完全一致,从而确认4个地区10批自制枸杞多糖水解产物中均含甘露糖、果糖、鼠李糖、半乳糖、葡萄糖、木糖、阿拉伯糖和脱氧核糖,并对各种单糖组分的含量进行了测定。以1#枸杞多糖样品中含有的各种单糖含量为单位(中国药典2 010版注明宁夏枸杞为药食两用枸杞品种),计算不同地区枸杞多糖中各种单糖的分布比值(见图11)。产自不同地区枸杞多糖中单糖的组成基本一致,但所含各种单糖含量的分布有较大差异,说明药材的产地对枸杞多糖的单糖组成有一定影响。

图 11 4个地区10批枸杞多糖中单糖组分分布比值图(n=3)Fig. 11 Distribution ratio chart of monosaccharide composition from polysaccharide samples of Lycium barbarum L. of ten batches from four regions (n=3)
3 结论
在温和的NH3·H2O环境下,采用PMP衍生化标记单糖,基于HPLC-MS联用技术,在正离子SIM模式下,成功确认和测定了果糖和多种醛单糖(Man、Rha、Gal、Glu、Xyl、Ara、Rib)。首次提出在温和的NH3·H2O条件下,PMP标记果糖的衍生化机理。以双糖为目标物,优化水热法酸催化水解多糖的最佳水解温度(70 ℃)和水解时间(50 min),建立了水热法水解多糖和温和氨水环境下PMP柱前标记多糖水解产物中的果糖和多种醛单糖的确认方法及含量测定方法,成功用于枸杞多糖水解产物中单糖组分的确认及含量测定。

