胸廓畸形相关肺动脉高压的临床与血流动力学特点分析
杨 飞 王 岚 宫素岗 罗祠君 邱宏玲 姜 蓉 何 晶 刘锦铭 赵勤华
肺动脉高压(PH)是由多种已知或未知原因引起的肺动脉压异常升高的病理生理状态。呼吸系统疾病或缺氧相关的PH是临床常见的PH类型。近期研究[1]显示,慢性肺部疾病住院患者的PH发生率高达28%。慢性阻塞性肺疾病(COPD) 是慢性肺源性心脏病的主要病因。胸廓畸形相关PH属于第三类肺部疾病和(或)缺氧相关PH,由气道病变存在限制和阻塞混合因素所致。胸廓畸形患者常伴有心肺功能障碍,本研究旨在初步探讨胸廓畸形相关PH的临床特点。
1 对象与方法
1.1 研究对象 回顾性分析2010年11月—2018年6月在同济大学附属上海市肺科医院肺循环科住院的18例胸廓畸形相关PH患者。采用随机数字法抽取同期住院的24例COPD相关PH患者作为对照。入选标准:① 通过病史、体格检查和胸部CT检查明确诊断为胸廓畸形;② 通过病史、体格检查、肺功能检查和肺部CT检查明确诊断为COPD;③ 右心导管检查测得静息状态下肺动脉平均压(mPAP)≥25 mmHg(1 mmHg=0.133 kPa),肺小动脉压(PAWP)≤15 mmHg。排除标准:① 先天性心脏病相关PH胸廓畸形;② 由陈旧性肺结核、支气管扩张、阻塞性睡眠呼吸暂停综合征等其他相关慢性肺疾病导致的PH;③ 近1个月内有COPD急性发作病史或者3个月内COPD治疗药物有变动;④ 有左心功能不全征象或者肺毛细血管楔压>15 mmHg。
1.2 研究方法
1.2.1 一般情况 详细收集患者的基本信息、发病年龄、病程,并对患者进行电话或门诊随访,随访时间截至2018年7月31日。
1.2.2 超声心动图检查 行超声心动图检查测量患者的右心结构和功能相关参数。
1.2.3 肺功能检查 患者入院后1周内应用Master Screen Diffusion肺功能仪(德国Erich Jaeger公司)行肺功能检查,主要测定参数包括第1秒用力呼气容积(FEV1)、用力肺活量(FVC)、1 s率(FEV1/FVC)、最大呼气流量(PEF)、最大呼气中期流量25%~75%(MMEF75/25)、最大通气量(MVV)、残气量(RV)、肺总量(TLC)、残气量总量比(RV/TLC)、肺活量(VC)、深吸气量(IC)、肺一氧化碳弥散量(DLCO)、气道阻力(Rtot),以及各指标的实测值占预测值百分比等指标。
1.2.4 心肺运动试验 应用负荷连续递增的心肺运动试验(CPET),在运动中检测受试者最大公斤摄氧量(PeakVO2/kg)、最大氧脉搏(O2/HR)、每分钟通气量(VE)、每分钟二氧化碳排出量(VCO2),计算二氧化碳当量(EqCO2)。
1.2.5 PH诊断 按照我国PH诊断治疗专家共识完成患者的WHO PH功能评级和6 min步行距离测试。
1.2.6 右心导管检查 所有患者均通过右心导管检查获得肺循环血流动力学指标。右心导管检查常规经左前臂静脉或右颈内静脉入路,置入Swan-Ganz漂浮导管(131HF7或774HF75,美国Edwards Lifescience公司)分别测量上腔静脉、右心房、右心室、肺动脉、肺小动脉和肺毛细血管楔压,采用热稀释法测量患者的心输出量。
1.2.7 血气分析 应用血气分析仪(丹麦,ABL800 )检测动脉血二氧化碳分压(paCO2)、氧分压(paO2)和氧饱和度(SaO2)。
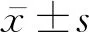
2 结 果
2.1 一般资料 18例胸廓畸形相关PH患者的年龄范围在38~87岁。患者胸部畸形的病程最长为73年。胸廓畸形病因包括脊柱结核和结核性胸膜炎4例、先天性脊柱畸形5例、小儿麻痹致脊柱侧凸2例、佝偻病致脊柱畸形1例、发育异常1例,不能明确病因5例。12例胸廓畸形体格检查可见脊柱后凸,Cobb角>90°;6例向内侧凹陷,其中1例伴胸骨前凸。13例行右心导管检查明确为PH,5例为超声心动图检查诊断为PH[定义为肺动脉收缩压(PASP)≥50 mmHg]。两组间患者的性别构成,年龄和身高差异均无统计学意义(P值均<0.05),但胸廓畸形相关PH组的体重显著低于COPD相关PH组(P<0.01)。见表1。

表1胸廓畸形相关PH组和COPD相关PH组患者的一般资料比较
与COPD相关PH组比较:①P<0.05
2.2 实验室检查 18例胸廓畸形相关PH患者和20例COPD相关PH患者进行了血生物化学和血气分析检查。与COPD相关PH组相比,胸廓畸形相关PH组的脑钠肽(BNP)、paCO2显著升高,paO2、SaO2显著降低,差异均有统计学意义(P值分别<0.05、0.01),提示胸廓畸形相关PH患者肺部气体交换受累,组织缺氧、CO2排出障碍较COPD相关PH组严重。两组患者的血红蛋白(Hb)水平均升高,提示两组患者均长期缺氧。两组实验室检查结果见表2。


组别NHb(x-±s,g/L)尿酸(x-±s,mmol/L)BNP[M(P25,P75),ng/L]pH值(x-±s)paO2(x-±s,mmHg)paCO2(x-±s,mmHg)SpO2(x-±s,%)胸廓畸形相关PH18141.94±24.62355.06±184.57570.5(144.5,1 116.0)①7.38±0.0553.65±12.40①60.04±8.74②83.00±8.12①COPD相关PH20148.71±29.39333.12±160.95163.3(52.7,333.0)7.41±0.0562.75±13.1243.72±14.0089.39±6.32
与COPD相关PH组比较:①P<0.05,②P<0.01
2.3 肺功能检查 12例胸廓畸形相关PH患者和19例COPD相关PH患者完成肺功能检查。与COPD相关PH组相比,胸廓畸形相关PH组的VC、RV、TLC、PEF均显著降低(P值均<0.05),FEV1/FVC显著增高(P<0.01),提示该组患者存在限制性和阻塞性通气功能障碍,这与胸廓畸形限制通气功能有关。两组肺功能指标比较见表3。


组别N各指标实测值占预测值百分比VCRVTLCRV/TLCICFVC胸廓畸形相关PH1242.70±16.24①115.23±52.39①67.99±26.63①169.39±40.5045.80±26.8242.32±17.09COPD相关PH1959.99±25.27175.53±67.73104.24±23.61140.71±62.0461.82±24.4959.18±26.01组别FEV1FEV1/FVCPEFMMEF75/25MVVDLCORtot胸廓畸形相关PH32.98±12.4178.57±21.23②33.40±9.18①12.03±8.7029.28±9.1338.13±13.14344.34±181.80COPD相关PH38.10±21.0853.05±13.2448.64±29.5619.04±15.5538.67±24.6953.10±18.74349.84±305.46
与COPD相关PH组比较:①P<0.05,②P<0.01
2.4 超声心动图检查 14例胸廓畸形相关PH患者和17例COPD相关PH患者完成超声心动图检查,见表4。两组患者均表现为右心增大,右心收缩功能下降。胸廓畸形相关PH组的右心室横径和PASP均显著小于COPD相关性PH组(P值均<0.05),说明胸廓畸形相关PH组的心脏结构性病变、右心收缩功能降低和肺血管病变程度较轻。


组别N右心房横径(mm)右心房纵径(mm)右心室横径(mm)右心室纵径(mm)三尖瓣瓣环收缩期位移(mm)PASP(mmHg)胸廓畸形相关PH1441.64±9.6549.79±5.8738.57±4.86①62.14±9.1617.91±5.5062.76±21.69①COPD相关PH1748.76±11.3552.59±11.4948.12±13.8262.71±12.1216.64±4.6775.83±18.92
与COPD相关PH组比较:①P<0.05
2.5 心肺运动试验和6 min步行距离 两组患者心肺运动试验发现,胸廓畸形相关PH组和COPD相关PH组的PeakVO2/kg占预计值百分比均低于正常值(>80%),分别为(51.71±10.97)%和(53.80±21.01)%;EqCO2均高于正常值(<30),分别为31.84±16.08和39.90±11.21; O2/HR占预计值百分比均低于正常值(>80%),分别为(73.71±11.04)%和(70.40±23.46)%。6 min步行距离均小于450 m,两组间的差异无统计学意义(P>0.05)。
2.6 血流动力学检查 13例胸廓畸形相关PH患者和全部COPD相关PH患者完成右心导管检查。胸廓畸形相关PH组肺血管阻力(PVR)显著低于COPD相关PH组(P<0.05),提示该组患者的肺血管病变较轻。两组血流动力学指标见表5。


组别NmPAP(mmHg)肺毛细血管楔压(mmHg)PVR(Wood U)心脏指数[L/(min·m2)]胸廓畸形相关PH1339.46±12.6710.22±3.235.34±2.41①3.46±1.14COPD相关PH2445.33±11.539.50±3.538.16±3.692.96±0.74
与COPD相关PH组比较:①P<0.05
3 讨 论
本研究通过比较胸廓畸形相关PH与COPD相关 PH 患者的临床资料表明:①两组患者均长期缺氧,BNP水平升高,反映心功能不佳;②胸廓畸形相关PH患者存在更明显的低氧血症和CO2潴留;③胸廓畸形相关PH较COPD相关PH患者的心脏结构病变轻,肺血管阻力低,循环系统受累更轻。
PH的病因与肺部基础疾病相关,既往研究[2]已经明确提出缺氧导致人体细胞外基质沉积,进而引起血管重构。胸廓畸形患者一般病程较长,肺血管床在青少年时期发育不佳,肺循环阻力加大,其呼吸功能受损主要表现为肺容积的限制[3]。胸廓畸形患者的肺泡总数减少且大小不规则,常伴有肺实质萎缩和肺动脉血管减少[4]。胸廓畸形严重者,FEV1和FVC下降更明显,且严重程度与FVC下降成正比[5],肺功能检查结果呈现大气道梗阻的特点。胸廓畸形使肺实质受压,肺容量和顺应性下降,这些变化导致肺泡通气不足、高碳酸血症和低氧血症发生。
胸廓畸形引起PH的机制主要是低氧和血管床发育不良[6-7]。其原因可能是大气道受压[8]、胸壁运动受限制[9-10],以及局部肺泡通气不足造成的通气-血流比失衡[11]。目前认识到睡眠呼吸障碍与PH有关。研究发现,胸廓畸形患者的呼吸暂停和呼吸不足指数、呼吸障碍指数均较高,且最低血氧饱和度较低,睡眠呼吸障碍可能参与了PH的形成。另外,心脏的舒张功能和Cobb角间存在负相关,这提示左心舒张功能不全可能也是导致胸廓畸形和PH相关的原因[12]。本研究结果显示,胸廓畸形相关PH组的paO2显著降低,COPD相关PH组的PVR显著升高,提示胸廓畸形患者PH形成的机制更为复杂。
胸廓畸形患者肺顺应性下降,呼吸与循环阻力增大;病情进一步加重后会出现肺-血液交换功能障碍,肺泡有效通气量不断减少,无效腔不断增大,导致弥散功能下降,发生低氧血症和CO2潴留;因胸廓畸形患者气道生理结构异常,呼吸道分泌物不易排出,反复感染致气道阻力进一步升高,肺功能检查不但表现为限制性通气功能障碍,而且还存在阻塞性通气功能障碍[13-14]。胸廓畸形使骨性结构和肌性结构改变,导致肺顺应性降低,呼吸和循环功能进一步受损,胸廓活动受到限制[15-16],paO2降低和CO2潴留更明显。国外的研究[17-20]结果表明,气流受限明显的气道疾病患者的血流动力学变化并不一定更重,进一步支持胸廓畸形相关PH患者虽然肺功能受损更为明显,但是PH程度与气道病变严重程度并不呈正相关。呼吸功能受损与肺血管重构是两个平行发展的病理变化[21],其具体机制有待进一步阐明。
综上所述,胸廓畸形这一因素在呼吸相关性PH患者中,对气道的影响明显大于循环系统,提示在疾病早期进行气道管理具有重要意义。了解胸廓畸形相关PH的临床特点,可以提高对此类特殊患者的诊疗水平。

