带蒂胃浆肌瓣管修复猪胆总管缺损的实验研究
高苏平,马大喜,韩 江,蔡 端
(1.上海市健康医学院附属周浦医院普通外科,上海 201318;2.复旦大学附属华山医院普外科,上海 200040)
肝外胆管损伤(extrahepatic bile duct injury,EBDI)是胆囊切除术严重的并发症之一,包括开腹胆囊切除术(open cholecystectomy,OC)和腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)。EBDI在OC术中的发生率为0.1%~0.3%,在LC术中的发生率为0.4%~0.6%[1-3]。胆总管损伤修复最经典的方法是胆总管空肠Roux-en-Y吻合术,但术后可出现消化性溃疡、肠液反流、胆道反复感染等问题,甚至可诱发胆管癌。众多学者研究认为,保留Oddi括约肌功能的胆总管损伤修复手术是理想的术式,其中利用自体组织修复胆总管损伤是比较符合生理状况的治疗手段。本实验建立猪胆总管缺损模型,采用带蒂胃浆肌瓣管修补胆总管缺损,保留其Oddi括约肌功能,探讨带蒂胃浆肌瓣管修复胆总管缺损的可行性。
1 材料与方法
1.1 实验动物健康雄性成年实验猪(湖北白猪)18头,体质量14.5~15.5 kg,由上海交通大学农学院动物实验中心提供。
1.2 主要药物、试剂与仪器注射用青霉素钠购自四川制药制剂有限公司(批准文号:H51021742),诺氟沙星胶囊购自安徽三精万森制药有限公司(批准文号:H34022906);苏木精-伊红(hematoxylin-eosin,HE)染色剂购自上海联硕生物科技有限公司,细胞角蛋白7(cell keratin 7,CK7)一抗和Calretinin一抗及二抗购自北京中山金桥生物有限公司;日立 7600全自动生物化学分析仪购自日本日立公司,CX41型光学显微镜购自日本奥林巴斯公司。
1.3 实验方法
1.3.1 实验分组及模型制作所有猪分栏饲养,并随机分为带蒂胃浆肌瓣管组、胆总管断端吻合组和胆肠内引流组,每组6头。猪麻醉后,剖腹、切除十二指肠上段0.5~0.8 cm长的胆总管,建立胆总管缺损模型。
1.3.2 手术方法带蒂胃浆肌瓣管组猪采用带蒂胃浆肌瓣管修复胆总管:先在临近胆总管处切取2 cm×3 cm带蒂胃浆肌瓣,以浆膜面为内壁,环绕直径为0.5 cm 支撑管,再用可吸收缝线缝合成浆肌瓣管,然后翻转浆肌瓣管,依序于胆总管上、下断端分别吻合,浆肌瓣管外包带蒂大网膜。胆总管断端吻合组猪采用胆总管断端吻合修复胆总管:先将胆总管游离切断,然后胆总管内置支撑管,再用可吸收缝线行断端吻合。胆肠内引流组猪采用胆肠内引流术,先将猪切断的胆总管远端关闭,然后胆总管近端与近段空肠行Rox-en-Y胆总管空肠吻合术,所有操作均在眼镜式手术放大镜下进行,采用显微血管吻合技术。3组猪术中给予静脉滴注青霉素钠10万U预防感染,术后第1、2、3天饮水中给予诺氟沙星0.1 g,每日1次。
1.4 观察指标
1.4.1 存活情况术后观察各组猪的一般情况及存活情况。
1.4.2 肝功能指标3组猪术前及术后4、12周经耳静脉抽血,测定丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)和总胆红素(total bilirubin,TBIL)水平。
1.4.3 肝组织和胆总管大体检查和显微检查各组猪于术后12周进行安乐死,迅速开腹,取出肝脏进行大体检查。切除修复区胆总管及附近肝脏,Zamboni固定液固定,甲醇梯度脱水后,二甲苯透明,石蜡包埋,切片、展片、烤片,行HE染色,梯度脱水后二甲苯透明,中性树胶封片,光镜下观察肝脏和胆总管内壁显微结构。
1.4.4 胆总管CK7和Calretinin 表达的测定各组猪胆总管石蜡切片脱蜡、水化,抗原修复,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗3次,加入封闭剂进行封闭。分别加入CK7、Calretinin 一抗室温下孵育2 h,PBS清洗3次;滴加试剂盒增强剂室温孵育20 min,加入二抗孵育30 min;PBS清洗3次;加入二氨基联苯胺显色10~15 min;自来水冲洗,复染,PBS清洗3次;甲醇脱水,二甲苯透明,中性树胶封片,镜检。细胞呈现黄色或棕色染色即为阳性表达细胞。

2 结果
2.1 各组动物存活情况各组猪手术均顺利完成,均未出现术中死亡情况,术后均未出现胆漏。
2.2 各组猪胆总管及肝脏标本大体观带蒂胃浆肌瓣管组有5头猪肝脏呈紫红色,表面光滑,质地柔软;胆总管修复段质地较柔软,管壁平整,管腔光滑通畅。有1头猪术后支撑管脱入肠管导致梗阻性黄疸,其肝脏呈土黄色,表面光滑,质地韧硬,且胆总管修复段管壁增厚,内有黏冻状、泥沙状胆泥阻塞胆总管;修复段近端胆总管和肝内胆管扩张明显,胆囊增大,胆汁淤积。胆总管断端吻合组猪吻合口未见明显狭窄,胆总管质地柔软,管壁平整,管腔光滑,肝脏呈紫红色,表面光滑,质地柔软。胆肠内引流组5头猪吻合口未见明显狭窄,胆总管质地柔软,管壁平整,管腔光滑,肝脏呈紫红色,表面光滑,质地柔软;1头猪术后胆管炎发作,其肝脏组织充血肿胀。
2.3 各组猪肝脏显微结构结果见图1。术后12周,带蒂胃浆肌瓣管组猪肝脏间质内少量散在粒细胞,呈轻度炎症反应;胆总管断端吻合组猪肝脏间质内大量粒细胞聚集,呈明显炎症反应;胆肠内引流组猪肝脏间质可见散在粒细胞,亦呈轻度炎症反应。

A:带蒂胃浆肌瓣管组,光标处示少量散在炎症细胞;B:胆总管断端吻合组,光标处示大量炎症细胞聚集;C:胆肠内引流组,光标处示散在炎症细胞。
图1 各组猪术后12周肝脏组织的显微结构(HE染色,×100)
Fig.1 Microstructure of liver tissue of pigs in each group ( HE staining,×100 )
2.4 各组猪胆总管的显微结构结果见图2。术后12周带蒂胃浆肌瓣管组猪胃浆肌瓣管腔面完整覆盖着单层柱状上皮,中外层为增生肌纤维、纤维组织,可见散在淋巴细胞、浆细胞、成纤维细胞和巨噬细胞,并见较完整的毛细血管。胆总管断端吻合组猪胆总管黏膜下可见大量成纤维细胞,并部分纤维化;胆肠内引流组猪术后吻合口亦可见上皮增生,局部纤维化。

A:带蒂胃浆肌瓣管组;B:胆总管断端吻合组;C:胆肠内引流组。
图2 带蒂胃浆肌瓣管组猪胃浆肌瓣管内壁的显微结构(HE染色,×100)
Fig.2 Microstructure of inner wall of gastric seromuscular flap tube of pigs in pedicled gastric pulp muscle flap tube group(HE staining,×100)
2.5 各组猪胆总管免疫组织化学结果结果见图3和图4。3组实验猪术后12周胆总管内壁黏膜上皮细胞中CK7呈阳性表达,表明为胆道来源上皮;Calretinin呈阴性表达,表明为非间皮组织。

A:带蒂胃浆肌瓣管组;B:胆总管断端吻合组;C:胆肠内引流组。
图3 术后12周各组猪胆总管内衬黏膜上皮细胞中CK7的表达(免疫组织化学染色,×100)
Fig.3 Expression of CK7 in lining mucosa of common bile duct of pigs at 12 weeks after operation in each group (immunohistochemistry staining,×100)

A:带蒂胃浆肌瓣管组;B:胆总管断端吻合组;C:胆肠内引流组。
图4 术后12周各组猪胆总管内衬黏膜上皮细胞中Calretinin的表达(免疫组织化学染色,×100)
Fig.4 Expression of Calretinin in lining mucosa of common bile duct of pigs of pigs at 12 weeks after operation in each group( immunohistochemistry staining,×100)
2.6 各组猪手术前后肝功能比较结果见表1。3组猪术前TBIL、ALT、AST水平比较差异无统计学意义(P>0.05);3组猪术后4、12周TBIL、ALT、AST水平与术前比较差异无统计学意义(P>0.05)。3组猪术后4、12周TBIL、ALT、AST水平比较差异均无统计学意义(P>0.05)。
表1 各组猪手术前后肝功能比较
Tab.1 Comparison of liver function indexes of pigs before and after operation in each group
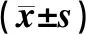

组别nTBIL/(μmol·L-1)术前术后4周术后12周ALT/(U·L-1)术前术后4周术后12周AST/(U·L-1)术前术后4周术后12周带蒂胃浆肌瓣管组647.6±5.156.2±7.153.1±5.024.3±8.369.3±12.155.3±8.835.4±7.3458.4±89.3124.3±37.4胆总管断端吻合组643.4±5.358.3±9.450.4±8.032.8±7.472.4±13.450.6±11.237.7±5.4511.7±101.8133.2±48.6胆肠内引流组640.3±7.148.6±10.646.7±9.027.4±3.880.6±8.358.9±10.741.2±8.6631.4±143.8166.7±72.1
3 讨论
EBDI多是医源性损伤。目前LC已成为胆囊切除术的金标准,其明显减少了术后疼痛和住院时间,但相应的并发症也随之增高,据报道,EBDI在LC术中的发生率为0.1%~0.3%,而在OC术中的发生率上升至0.4%~0.6%[1-3]。外伤性胆管损伤较少见,发生率约为0.1%[4]。胆肠吻合内引流术是治疗肝外胆总管损伤狭窄的经典术式[5]。但胆总管下端Oddis括约肌存在并有功能时,应用胆肠吻合内引流术修复胆总管损伤狭窄不尽合理。有学者认为,尽管胆肠吻合术是胆道损伤及狭窄的可选治疗方式,但绝不是最佳治疗方案[6]。无论胆道还是肠道,胆肠吻合均可造成其结构和功能的极大损伤。黄志强[7]院士指出,将胆道系统作为一个整体器官来对待和更多地保存其生理功能的完整性,可能是治疗损伤性胆管狭窄的发展方向。因此,保存胆总管下端括约肌已成为损伤性胆总管狭窄修复的最终目的。任何模式的胆肠吻合术均破坏了括约肌的自然防护作用,导致胆道感染、炎症、胆管黏膜上皮细胞增生。
保留Oddis括约肌的EBDI修复手术主要有阑尾间置胆管重建术[6]、带蒂脐静脉瓣移植术[8-9]、带蒂空肠瓣修补术[10]、带蒂肝圆韧带修复术[11]等。但是在行阑尾间置胆管重建术时阑尾周围淋巴组织丰富且管腔较狭窄,一旦发生胆管炎时易导致胆汁排出不畅,难以在临床推广。上述胆管重建手术仅被少数学者所试用,缺乏进一步实验研究及确切的临床数据支持。
有学者报道了采用静脉、腹膜瓣等自体组织替代修复EBDI的动物研究,证实以聚全氟乙丙烯共聚物导管作为支撑管,通过自体静脉补片修复胆管损伤是可行的[12-14]。BELZER等[15]采用静脉补片修补长约1.5~4.0 cm的部分胆管壁缺损,取得良好效果。AYDIN等[16]成功地进行了自体游离腹直肌鞘移植物修复胆管缺损的动物实验。国内学者刘会春等[17]用大隐静脉段结合内衬支架修复山羊胆道缺损亦取得良好效果。韩江等[18]用自体腹膜管修复缺损胆总管后,使用带蒂大网膜包裹,腹膜管的成活率高。但是,动物实验亦发现,采用自体静脉和自体腹膜等组织修复肝外胆管缺损时,由于缺乏肌层,远期难以保持足够的胆道张力,因此难以维持肝外胆道的通畅[12-14]。
本研究设计了带蒂胃浆肌瓣管内衬支撑管、外包裹大网膜修复胆管整段缺损的动物实验,采取内支撑管技术,防止胆道狭窄的发生和发展。带蒂胃浆肌瓣管组在临近胆总管的胃壁大弯侧切取2 cm×3 cm带网膜右血管蒂的浆肌瓣,然后以所取胃壁浆肌瓣浆膜面为内壁,围绕直径约0.5 cm的支撑管,再用可吸收缝线缝合成浆肌瓣管,依序于胆管上、下断端分别吻合,浆肌瓣管外包带蒂大网膜,从大体标本的观察发现,带蒂胃浆肌瓣管组猪胆管修复段质地较柔软,管壁平整,管腔光滑通畅。病理学结果证实,带蒂胃浆肌瓣管腔面覆盖着单层柱状上皮,且免疫组织化学检测结果证实为胆道来源,说明本组实验是成功的,使用带蒂胃浆肌瓣管修复胆总管缺损,胆管上皮可逐渐由两端向中央移行覆盖浆肌瓣管腔面,完成缺损胆管的修复。胃壁面积大,切除部分胃壁浆肌层不影响胃的修复;保留胃大弯网膜右血管的胃浆肌瓣,移动范围大,便于手术操作,且所取胃浆肌瓣血供好,张力小,修复段容易成活。带蒂胃浆肌瓣管修复的胆管通畅性与“经典”的胆管断端对端吻合术及胆肠内引流术相仿。本研究结果显示,术前及术后4、12周,3组猪肝功能各指标组内、组间比较差异均无统计学意义。带蒂胃浆肌瓣管组猪术后肝脏组织切片HE染色显示,其肝脏间质内仅少量散在粒细胞,呈轻度炎症反应,说明保留Oddis括约肌的胆管修复术不会因胆肠反流导致肝脏严重炎症。带蒂胃浆肌瓣管组中1头猪出现梗阻性黄疸,可能是由于支撑管脱入肠管使修复段胆总管缺乏有效的支撑造成胆总管狭窄,进一步发展,胆汁淤积形成胆泥,出现胆总管结石而导致梗阻性黄疸。因此,选择合适的支撑管及预防远期修复段胆管的狭窄仍需继续研究。
在本实验获得初步结果的基础上,对1例胆总管损伤修复后狭窄3 a伴肝损伤、梗阻性黄疸患者,采用带网膜右血管蒂胃浆肌瓣片修复狭窄段胆管,随访7个月效果良好(另撰文报道)。
综上所述,带蒂胃浆肌瓣管修复胆总管缺损,组织瓣血供好,无张力,胆管上皮可逐渐由两端向中央移行覆盖修复段管腔面,具有一定临床应用前景。

