废旧锂离子电池正极有价金属的回收研究
邱江华,张泽辉,余 敏,金朝正,杨 彬,郭光辉
(武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北 武汉,430081 )
锂离子电池具有工作电压高、能量密度高、循环寿命长、自放电率低、环境污染小和无记忆效应等众多优点,已经在消费电子、电动工具、医疗电子等领域获得广泛应用[1-2]。如今我国已是锂离子电池的最大生产、消费和出口国,据专家预测,到2020年我国将产生25亿只约52万吨的废旧锂离子电池[3]。废旧锂离子电池中含有六氟磷酸锂、有机溶剂碳酸酯、铝、铜、钴、镍、锰、锂等化学物质,如果处置不当,将会造成严重的环境污染[4]。同时,锂和钴又都属于稀缺资源,锂离子电池生产企业金属原材料供需矛盾在我国日显突出,因此,高效回收废旧锂离子电池中的有价金属具有重要的环保价值和经济效益。
湿法冶金是当前回收废旧锂离子电池中有价金属的常用方法,该法主要操作步骤为:先将废旧锂离子电池放电、拆解并破碎,得到由含锂、钴、镍、锰等的活性材料和铝箔构成的正极片,再对正极片进行煅烧[5]或利用极性溶剂[6]将活性物质从铝箔上分离出来,最后,活性物质经无机酸或有机酸浸提后借助萃取[7]、沉淀[8]或离子交换[9]等方法分离、回收浸出的各种金属离子。由此可见,现有的湿法冶金回收工艺虽然回收金属纯度高、回收率高且能耗较低,但同时也存在工艺流程复杂、回收成本高、废液不易处理等不足。有鉴于此,本文以柠檬酸为浸提剂、葡萄糖为还原剂,在不分离铝箔、黏合剂和导电剂的情况下,直接从正极片中回收有价金属,同时探讨了酸浸条件对有价金属浸出率的影响并揭示了相应的酸浸机理,以期为废旧锂离子电池正极有价金属回收的工业应用提供参考。
1 实验
1.1 材料、试剂与仪器
实验用钴酸锂电池取自废旧电动车,柠檬酸、葡萄糖、氢氧化钠、碳酸钠和草酸等均为分析纯。
使用IRIS Advantage ER/S型电感耦合等离子体发射光谱仪测试正极片及浸出液中锂、钴等元素的含量;借助Philips X’Pert Pro MPD型X射线衍射仪对相关样品的物相组成进行表征;采用UV-1800PC型紫外分光光度计测试浸出液的紫外-可见吸收光谱。
1.2 实验方法
首先对废旧锂离子电池进行放电,然后在通风柜内经拆卸将正极、负极、隔膜、金属外壳和塑料分开。正极经蒸馏水洗涤后,在110 ℃条件下干燥24 h,并切割成长、宽均为1 cm的薄片待用。按一定质量比称取正极片与葡萄糖置于平底烧瓶中,再按设定的固液比(m(正极片)∶V(柠檬酸))向其中加入一定浓度的柠檬酸溶液,在恒温水浴条件下进行酸浸反应,烧瓶上方装配回流水冷凝管装置以防止水分蒸发。反应一段时间后,将溶液过滤分离出滤渣,滤渣经110 ℃干燥后称重。往滤液中加入和钴离子相同物质的量的草酸,将钴离子沉淀后经过滤回收草酸钴,再用饱和碳酸钠溶液沉淀剩余溶液中的锂离子。钴、锂整体浸出率计算公式为
(1)
式中:α为浸出率,m1为正极片的初始质量,m2为滤渣质量,m3为正极片中氧化钴和氧化锂的质量总和。
2 结果与讨论
2.1 反应条件对浸出率的影响
2.1.1 柠檬酸浓度对浸出率的影响
柠檬酸浓度是影响酸浸反应过程中氢离子数量的重要因素。在葡萄糖与正极片质量比为1∶1、反应温度为80 ℃、浸出时间为3 h、固液比为40 g/L的条件下,柠檬酸初始浓度对钴、锂整体浸出率的影响如图1所示。由图1可见,当柠檬酸浓度为0.5 mol/L时,钴、锂整体浸出率仅为49.9%,当柠檬酸浓度增加到1.5 mol/L时,钴、锂整体浸出率提高至72.0%。但当柠檬酸浓度进一步提高时,相应浸出率不升反降。这是由于酸浸反应中的氢离子量随着柠檬酸浓度的增加而增大,所以浸出率随之提高。而柠檬酸初始浓度过高则会导致酸浸反应后大量氢离子剩余,这将严重抑制柠檬酸阴离子的生成,进而影响金属离子与柠檬酸阴离子之间的配位结合,对酸浸产生不利的影响。上述实验结果表明,柠檬酸的浓度为1.5 mol/L时,钴、锂整体浸出效果最佳。
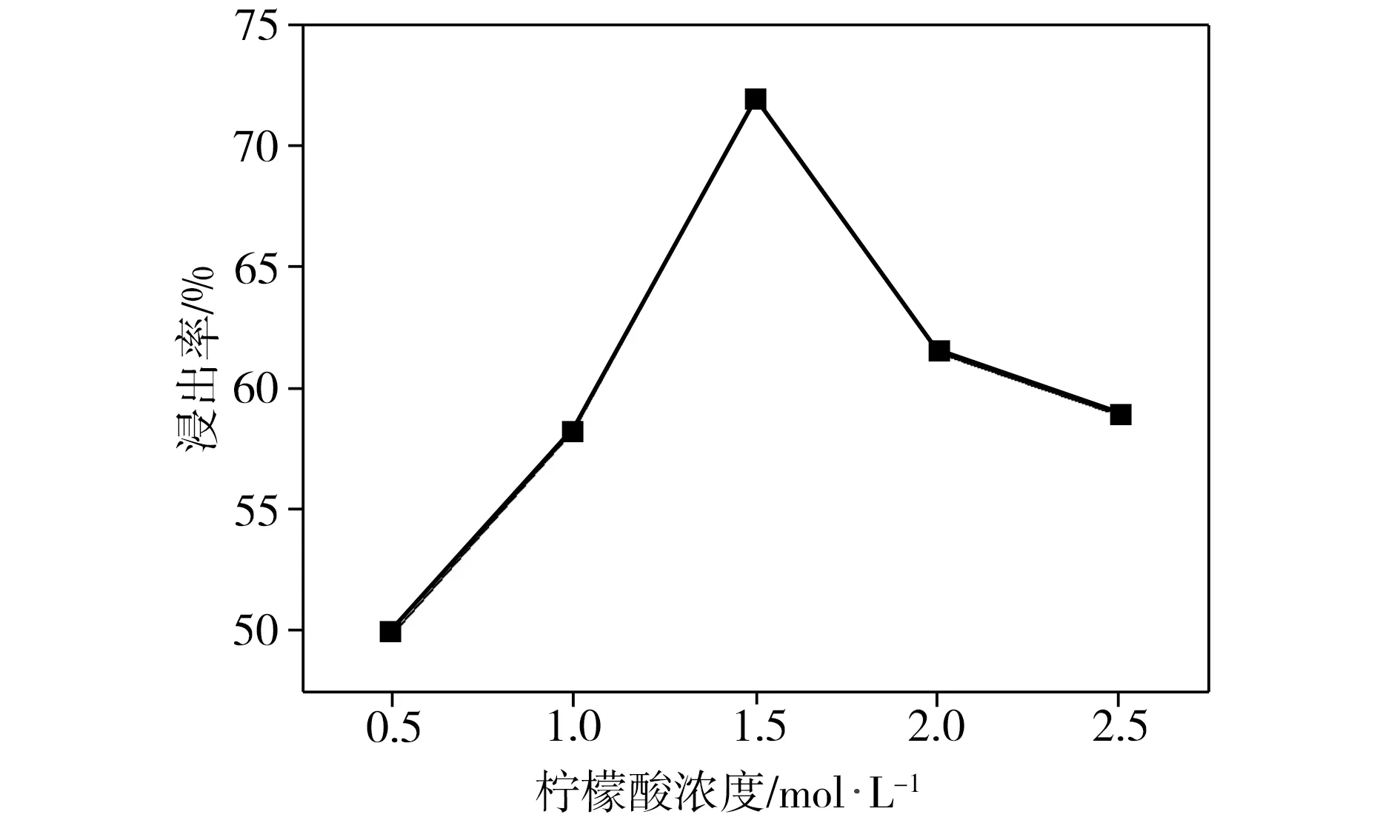
图1 柠檬酸浓度对浸出率的影响
2.1.2 葡萄糖用量对浸出率的影响
在柠檬酸浓度为1.5 mol/L、反应温度为80 ℃、浸出时间为3 h、固液比为40 g/L的条件下,葡萄糖用量对钴、锂整体浸出率的影响如图2所示。从图2中可以看出,随着葡萄糖用量的增加,钴、锂整体浸出率先升高后降低。当葡萄糖与正极片质量比为0.2∶1时,钴、锂整体浸出率从未添加葡萄糖时的62.5%提高至62.7%,增幅极小;当葡萄糖与正极片质量比增加到1∶1时,钴、锂整体浸出率达到极大值72.0%,继续增加葡萄糖用量,相应浸出率开始下降。这是因为葡萄糖作为还原剂,可以将三价钴离子还原成二价钴离子,使钴离子脱离结构,实现浸出[10],但葡萄糖分子也存在还原性较弱和空间位阻较大的缺点,过多的葡萄糖反而不利于浸出率的提高。
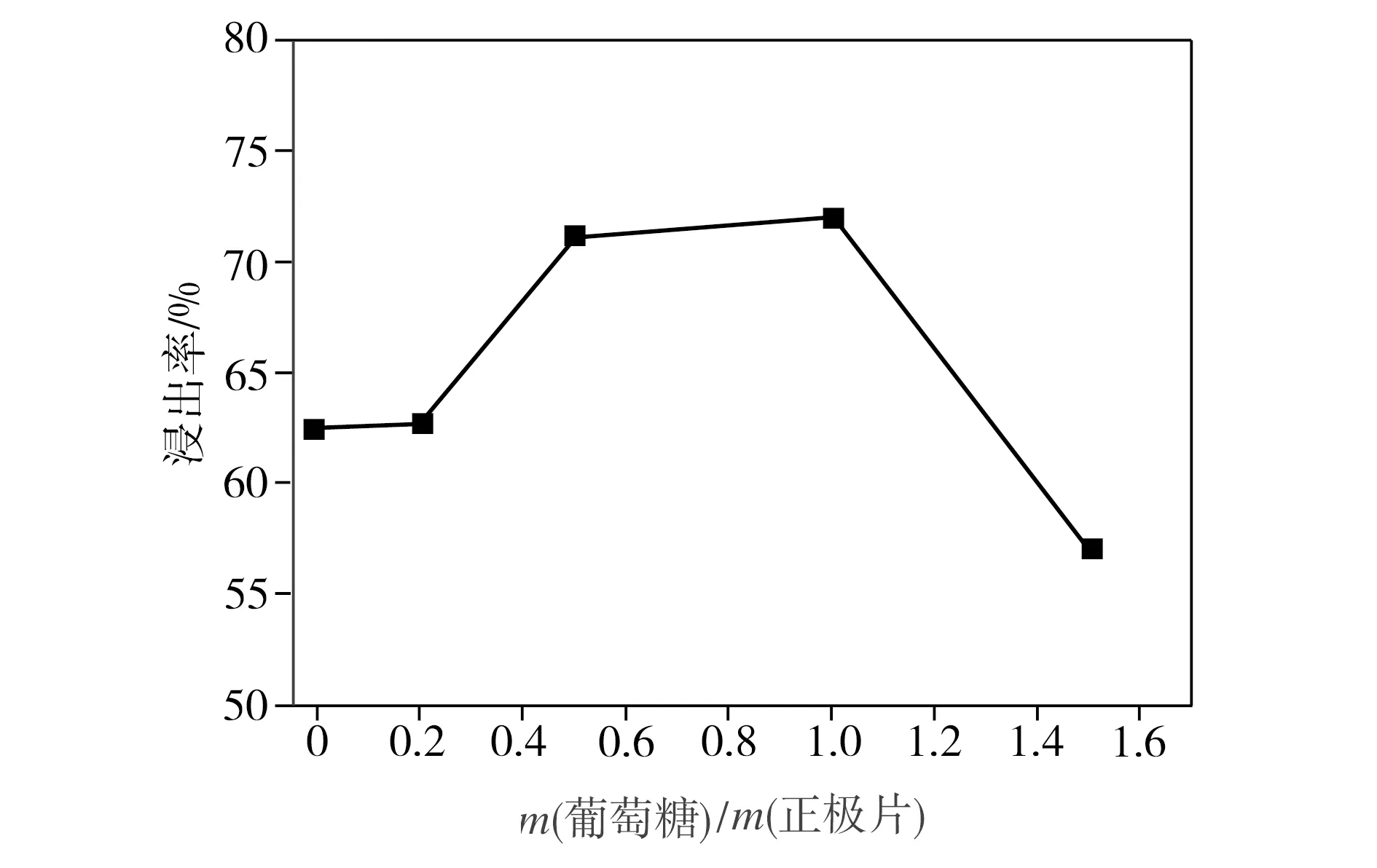
图2 葡萄糖用量对浸出率的影响
2.1.3 反应温度对浸出率的影响
在柠檬酸浓度为1.5 mol/L、葡萄糖与正极片质量比为1∶1、浸出时间为3 h、固液比为40 g/L的条件下,反应温度对钴、锂整体浸出率的影响如图3所示。由图3可见,当反应温度从30 ℃提高到100 ℃时,钴、锂整体浸出率从10.3%迅速提高到95.3%。众所周知,升高化学反应的温度可以提高活性分子的百分比,从而提高化学反应的速率,因此,钴、锂整体浸出率随反应温度的升高而增大。
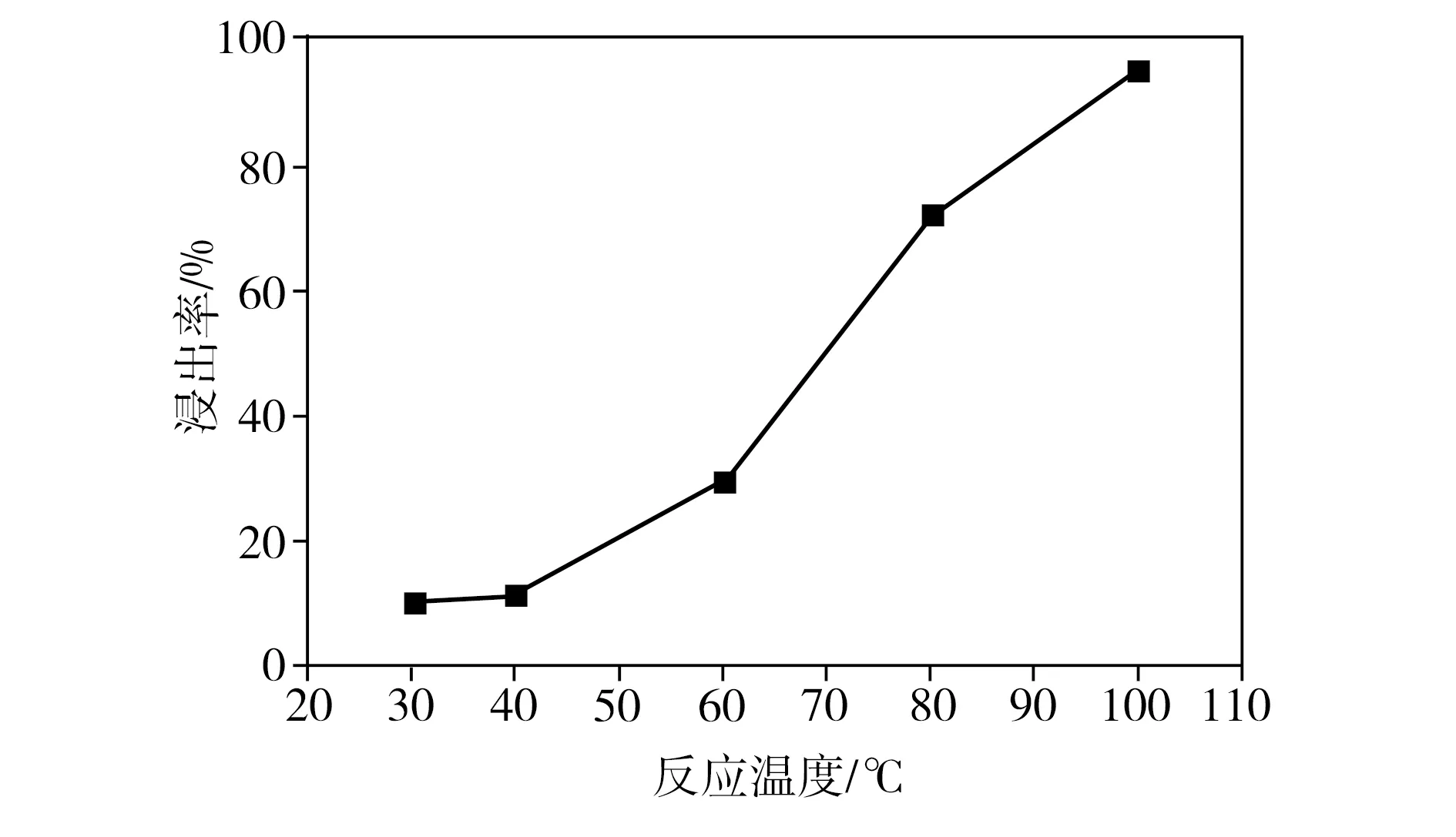
图3 反应温度对浸出率的影响
2.1.4 反应时间对浸出率的影响
在柠檬酸浓度为1.5 mol/L、葡萄糖与正极片质量比为1∶1、反应温度为100 ℃、固液比为40 g/L的条件下,反应时间对钴、锂整体浸出率的影响如图4所示。从图4中可以看出,随着反应时间的延长,钴、锂整体浸出率逐步提高,反应2.0 h时相应的浸出率已接近90%。但LiCoO2的酸浸速率主要受离子迁移速率和表面化学反应的控制[11],葡萄糖分子的空间位阻大,还原性差,导致正极活性物质实现几乎全部浸出所需的反应时间较长。此外,本研究还发现,当不添加还原剂葡萄糖时,在柠檬酸浓度为1.5 mol/L、反应温度为80 ℃、固液比为40 g/L的条件下,即使反应时间长达6.0 h,钴、锂整体浸出率也仅为68.0%,这表明添加还原剂是提高浸出率的必要措施。当表面的LiCoO2被浸出后,暴露的集流体铝箔就可能被腐蚀。不过,当反应时间为3.0 h时,本研究中铝箔的浸出率为7.4%,仅占LiCoO2浸出质量的0.6%,不会对浸出液回收制备新电极材料产生较大影响。
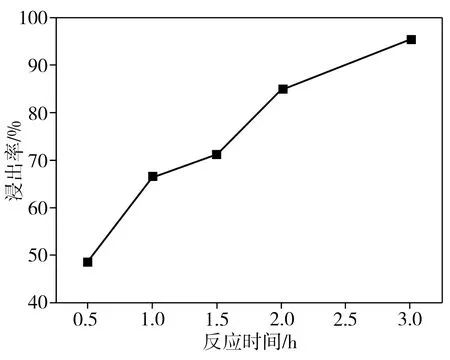
图4 反应时间对浸出率的影响
2.1.5 固液比对浸出率的影响
在柠檬酸浓度为1.5 mol/L、葡萄糖与正极片质量比为1∶1、反应温度为100 ℃、浸出时间为3 h的条件下,固液比对钴、锂整体浸出率的影响如图5所示。由图5可见,当固液比为10 g/L时,钴、锂整体浸出率为99.7%;当固液比由10 g/L提高到40 g/L时,钴、锂整体浸出率呈现缓慢下降的趋势;当固液比超过40 g/L后,相应浸出率急剧下降。尽管高浸出率有利于回收更多的有价金属,但固液比越小意味着浸出试剂消耗量越大,操作成本越高。测试结果表明,当固液比为20 g/L时,钴、锂整体浸出率仍高达98.0%,因此,综合考虑浸出率和运行成本,设定固液比为20 g/L是较理想的选择。
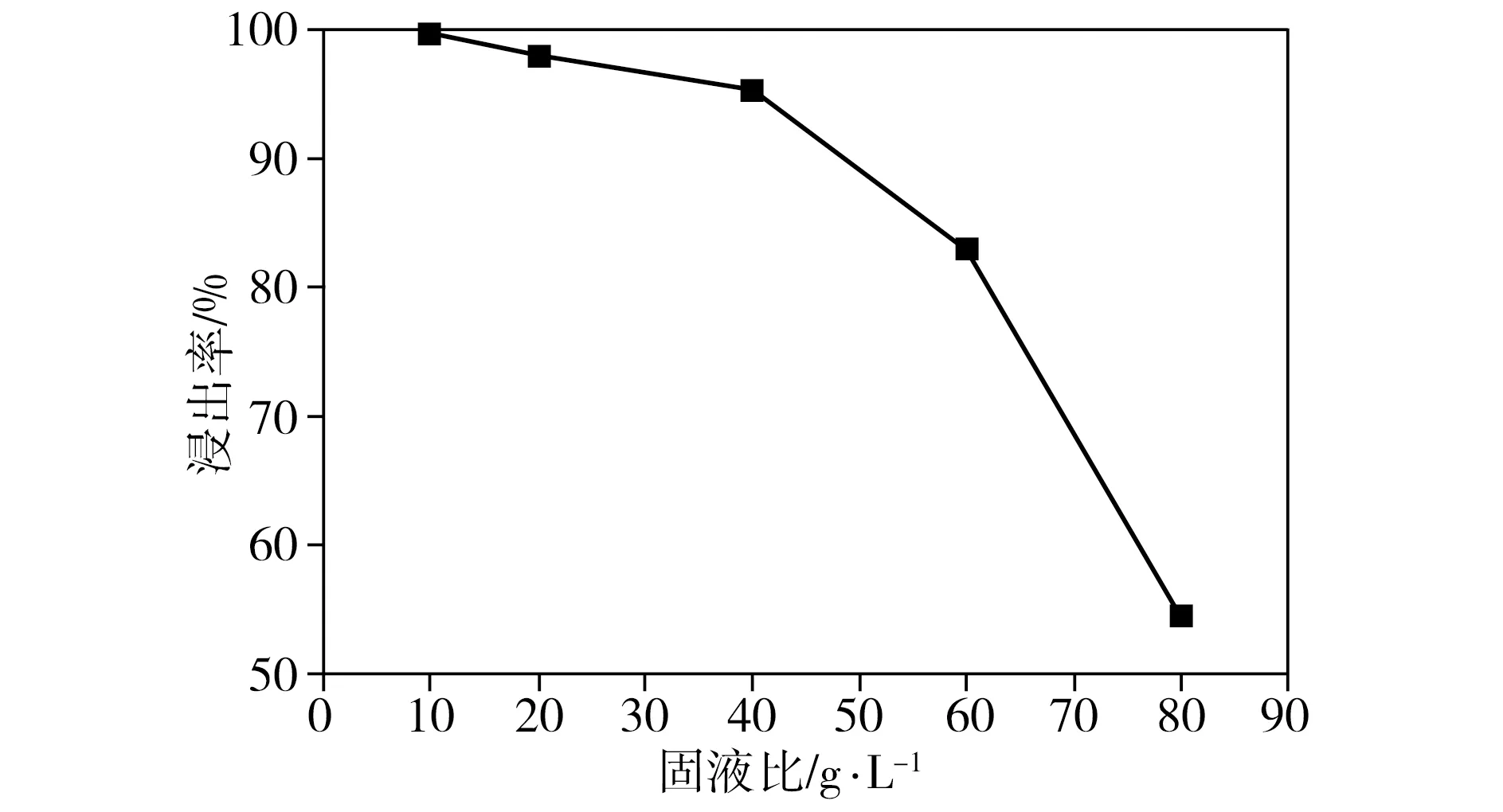
图5 固液比对浸出率的影响
2.2 酸浸机理分析
图6所示为正极片在酸浸前后的XRD测试结果。由图6可见,在未经酸浸的正极片XRD图谱中出现的对应(003)、(101)、(104)晶面的强峰及对应(006)、(105)、(107)、(110)、(113)晶面的弱峰均归属于LiCoO2(JCPDS No.44-0145)[12],而经酸浸后的正极片XRD图谱中,LiCoO2的特征峰强度明显降低,同时出现铝的衍射峰,表明正极片中的LiCoO2已发生溶解。
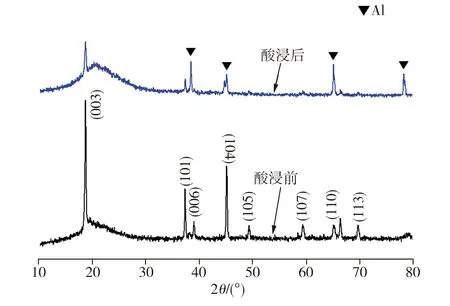
图6 正极片酸浸前后的XRD图谱
Fig.6 XRD patterns of the cathode plates before and after leaching
图7所示为不同酸浸时间时浸出液的紫外-可见吸收光谱。从图7中可以看出,在浸出液的紫外-可见吸收光谱中,513 nm处的吸收峰归属于钴离子与柠檬酸阴离子(L)所形成的Co2+—L配离子发生的d—d跃迁,这表明在酸浸过程中有配合物形成。根据配合物显色的原理,在513 nm处会吸收绿色光,因此溶液呈现其互补色,即红色。随着反应时间的增加,513 nm处的吸收值逐渐增大,表明溶液中Co2+—L配离子的浓度不断增加。柠檬酸是一种常见的含有三个羧基的弱有机酸,其离解反应可形成H2Cit-、HCit2-和Cit3-。酸浸发生后,溶液中存在锂离子、钴离子和柠檬酸阴离子,将进一步反应形成配离子,作为还原剂的葡萄糖也将被降解氧化成不同的羧基化合物,最终生成CO2和H2O[12]。金属离子与配体的配位反应可以表示为[13]

(2)

(3)

(4)

(5)
由式(2)~式(5)可以看出,一方面,充足的柠檬酸可以提供足够多的氢离子使钴离子和锂离子被完全浸出,而另一方面,过量的柠檬酸又会抑制柠檬酸阴离子的生成,从而影响Co2+—L配离子的形成,对钴酸锂的酸浸反应产生不利的影响。
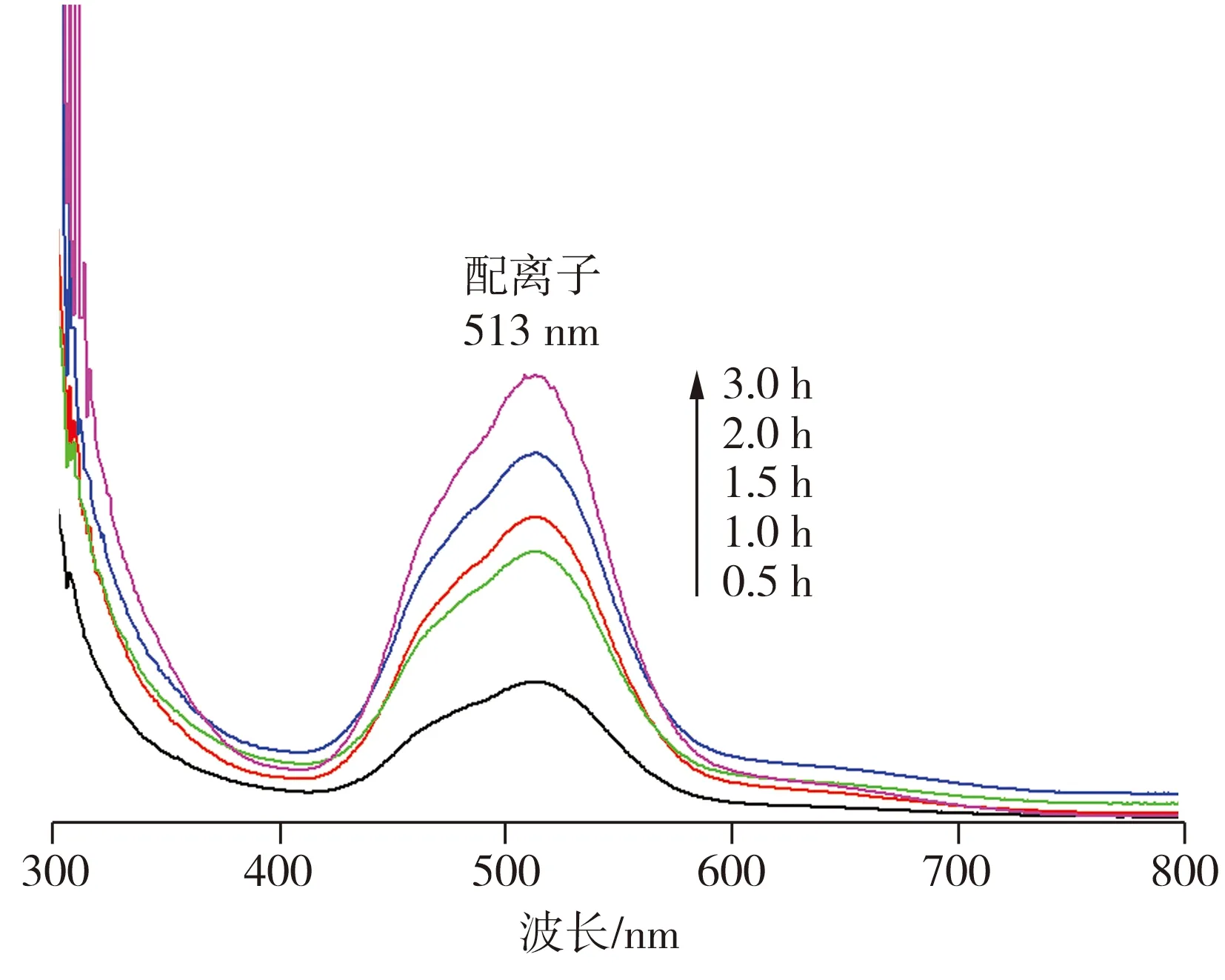
图7 浸出液的紫外-可见吸收光谱
2.3 有价金属的回收
酸浸反应结束后,往滤液中加入和钴离子等物质的量的草酸沉淀钴离子,然后进行过滤,用蒸馏水洗涤沉淀物并在80 ℃干燥24 h。沉淀物的照片及XRD图谱如图8所示。从图8可以看出,对应(202)、(004)、(400)、(022)、(511)、(224)、(602)和(132)晶面的峰归属于CoC2O4·2H2O(JCPDS No.25-0250)[14],表明Co2+—L配离子能与草酸反应生成CoC2O4沉淀。元素分析结果显示,二水草酸钴的含量为89.9%,杂质草酸锂和草酸铝的含量分别为0.037%、0.029%,其它的杂质可能是残留的葡萄糖。利用3 mol/L的氢氧化钠溶液,将经过滤分离出草酸钴后的滤液pH值调节至中性,然后加入饱和碳酸钠溶液以期获得碳酸锂沉淀。然而后续实验结果表明,即使溶液pH值达到11,仍不能得到碳酸锂的沉淀,并且对溶液进行浓缩也无碳酸锂沉淀析出,这与文献[14]报道的现象一致。由于碳酸锂在25 ℃时的溶度积常数(ksp)为2.5×10-2,饱和碳酸钠溶液中的碳酸根浓度为3.0 mol/L,按沉淀溶解平衡条件,为了实现碳酸锂的沉淀,溶液中锂离子的浓度必须大于0.091 mol/L,但正极片中锂的质量分数只有5.64%,即使完全浸出,溶液中锂离子的浓度也不超过0.16 mol/L,加之锂离子在有机酸体系中主要以配离子的形式存在,溶液中游离锂离子的浓度就会低于0.091 mol/L,不满足碳酸锂沉淀形成的条件。由此可见,在有机酸体系中,锂离子主要以配离子的形式存在,同时由于Li2CO3的溶度积常数较大,导致锂的配离子不能被碳酸根沉淀,只能通过焙烧剩余溶液来回收。
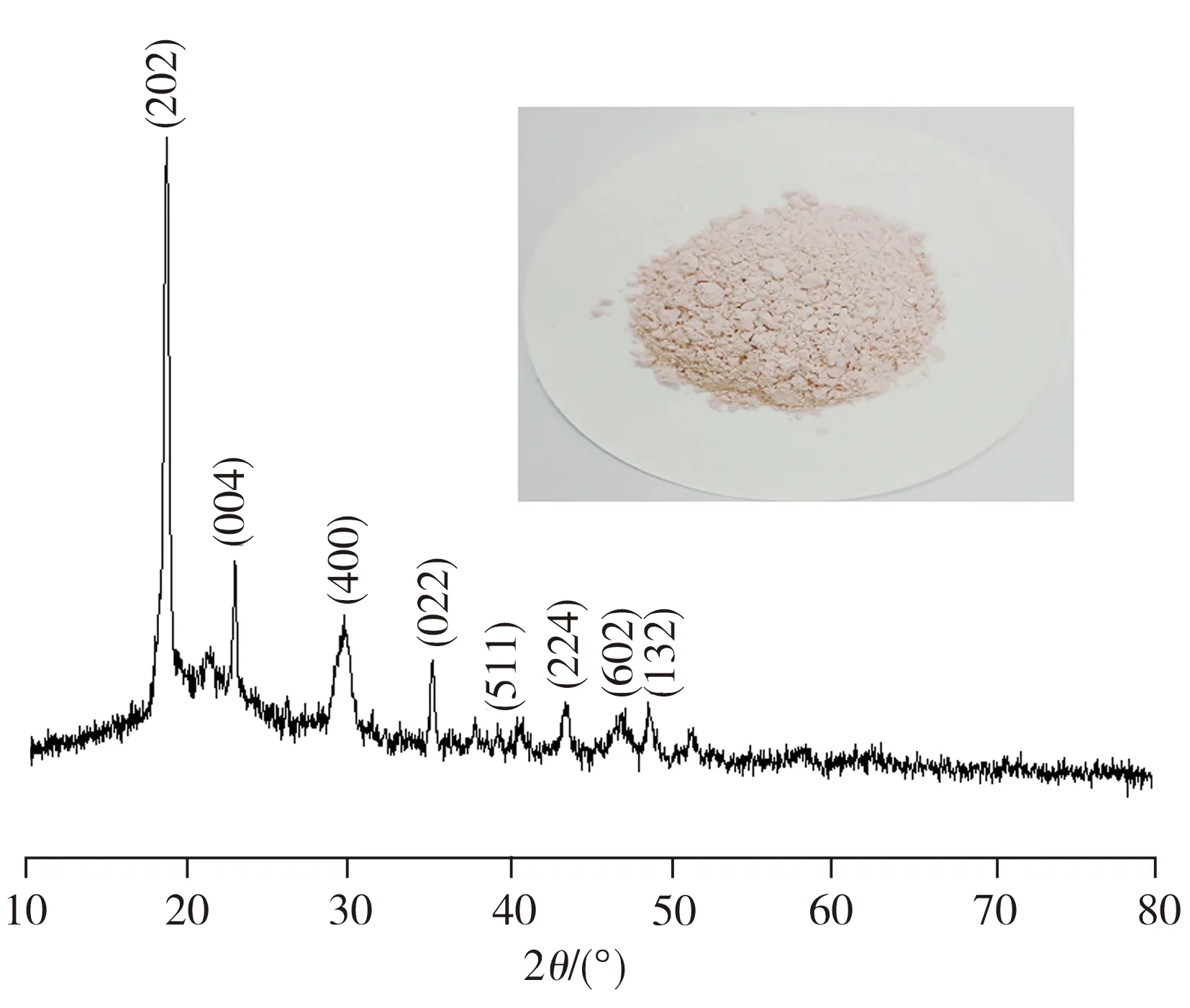
图8 二水草酸钴的照片及其XRD图谱
3 结论
(1) 提出了利用柠檬酸-葡萄糖体系从废锂离子电池中回收正极有价金属的简单方法,该方法直接将正极片进行酸浸,无需煅烧或有机溶剂浸泡等预处理,即可同时实现有价金属的浸出及铝箔、黏合剂、导电剂的分离。在最佳的反应条件下,钴、锂的整体浸出率达到98.0%。
(2) 充足的柠檬酸可以提供足够的氢离子供钴酸锂发生完全酸浸反应,但是过量的柠檬酸又会抑制柠檬酸阴离子的生成,从而影响Co2+—L配离子的形成,对钴酸锂的酸浸反应产生不利的影响。Co2+—L配离子能与草酸反应生成CoC2O4沉淀,而锂离子在有机酸体系中主要以配离子的形式存在而不能被碳酸根所沉淀。

