一株发酵木糖产氢细菌的分离和产氢特性
安 丹, 徐瑞娜, 谢林花, 陆 遥
(陕西科技大学 环境科学与工程学院, 陕西 西安 710021)
0 引言
随着人类社会的快速发展,化石燃料的日益枯竭及化石燃料使用带来的污染问题,人们迫切希望开发一种新的清洁能源取代化石燃料[1].在新的清洁能源中,氢气具有燃烧热值高,燃烧产物只有水等优点被越来越多的学者所关注[2].目前,制氢方法主要有水煤气法、电解水制氢法、热化学循环制氢、光分解水制氢法和生物质制氢等[3,4].水煤气法对设备要求高,电解水制氢需要消耗大量电能,热化学循环制氢步骤过多,光分解水制氢中催化剂制备成本高昂等问题目前限制了这些制氢技术的发展.与之相比,生物质制氢中的微生物制氢技术具有条件温和、对反应器要求低及耗电量低等优点,现在成为越来越多学者关注的制氢方法[5,6].
我国农业每年产生大量秸秆,以2015年我国秸秆产量为例,2015年中国主要农作物秸秆总产量8.09亿吨,蕴含的低位热值折算成4.02亿吨标准煤.依据2009年我国农业部开展的中国农作物秸秆专项调查,废弃及燃烧的秸秆占总量比例约为50%[7].调查结果显示废弃及燃烧秸秆占比很大,废弃及燃烧秸秆不仅污染环境同时浪费资源,如何将废弃秸秆中蕴含的巨大生物质能转化为可供我国社会发展急需的能源,将废弃秸秆变废为宝实现环境和能源的双赢,具有十分重大的意义.目前,各国学者将农作物秸秆作为微生物制氢的底物生产氢气,将微生物制氢与农作物秸秆的能源化结合起来,既解决了国家对清洁可再生能源的需求又实现变废为宝,这是一个非常有潜力值得我们深入探索的领域[8].
农作物秸秆为底物的微生物制氢技术包含暗发酵制氢和光合发酵制氢.光合发酵制氢中光合细菌可利用小分子有机酸及部分糖类物质产氢,其优点为底物转化率高,但产氢速率低成为制约其工业化的瓶颈问题.目前,学者们在高效光合细菌分离、光合细菌产氢条件优化、光合细菌基因改造等方面进行了大量研究,以期提高光合细菌的产氢速率.张安龙等[9]从造纸厂活性污泥中分离选出一株高效产氢光合细菌QW02,并对碳源、氮源浓度及磷酸盐缓冲液添加量进行优化,结果表明,在最优产氢条件下,该菌以葡萄糖为碳源的最大产氢量为3 944.2 mL H2/L,最大产氢速率为153.5 mL H2/(L·h).Yang H 等[10]从土壤中分离获得一株高效产氢光合细菌RhodobactersphaeroidesHY01,并对初始pH、氮源和碳源进行优化,结果表明,在最优产氢条件下,该菌的最大产氢量为7 012.5±150 mL H2/L,最大产氢速率为148.7±4.6 mL H2/(L·h).Wang X等[11]对影响光合细菌二氧化碳固定的cbbP和呼吸链的cyt-cbb3进行敲除,获得突变株Wb301(敲除ccoNOQP)和W3p03(敲除cbbP和ccoNOQP),并发现它们比野生型的最大产氢速率分别提高了15.8%和41.7%.Wang X等[12]对影响光合细菌叶绿素合成的spbA和氧化还原平衡的hupSL进行敲除,获得突变株WH04(敲除hupSL)和WSH10(敲除hupSL和spbA),并发现它们比野生型的最大产氢速率分别提高了29.9%和55.0%.Yang H等[13]对影响光合细菌固氮酶表达水平的mopAB进行敲除,获得突变株YMP1(敲除mopAB),并发现在光照强度为2 500、5 000及8 500 lux条件下,它比野生型的最大产氢速率分别提高了14.5%、15.1%和24.1%.
但目前的研究结果显示,光合细菌的产氢速率仍与暗细菌产氢速率存在一定差距,仍需要继续深入研究提高.
与之相比,暗发酵细菌制氢具有产氢速率高等优点,暗发酵制氢具有更大的发展潜力[6].暗发酵制氢中暗细菌可利用糖类等物质产氢,其优点为产氢速率高,暗发酵制氢目前在很多地方已实现中试及生产示范[14].制氢菌种产氢性能低下成为制约其进一步推广应用的瓶颈问题.目前,学者们在高效暗细菌分离、暗细菌基因改造、暗细菌产氢条件优化等方面进行了大量研究,以期提高制氢菌种的产氢性能.张丹丹等[15]对中温(35 ℃)和高温(55 ℃)下混合菌群利用不同浓度木糖(10~50 g/L)进行优化研究,结果表明,35 ℃下木糖浓度为30 g/L时获得最大产氢量,为1.24 mol H2/mol-木糖.Xu J F等[16]从牛粪堆肥中分离一株暗细菌Clostridiumsp.HR-1并对产氢条件进行优化,获得最大产氢量为1.63 mol H2/mol-木糖.刘洪艳等[17]以厌氧发酵产氢细菌PantoeaagglomeransBH18为出发菌株,利用转座子Tn7构建突变体文库,获得突变株TB34,产氢量为1.34±0.09 mol H2/mol-木糖.此外,许多学者对暗细菌制氢的过程条件,如底物种类、底物浓度、接种量、硝酸盐浓度、氮源种类、C/N、磷酸盐浓度、发酵液初始pH及温度等均对暗发酵制氢的产氢性能的影响进行了研究[18-21],结果表明这些过程参数均对制氢过程产生影响,但影响有限.
通过目前的研究发现,暗发酵细菌的种类对暗发酵制氢的产氢量影响较大,获得高效的暗发酵细菌菌种,可以大幅提高暗发酵的产氢性能.基于此,本研究的研究重点在于获得高效的暗发酵细菌菌种并对该菌种的产氢条件进行优化,获得较高的产氢量,本研究为暗发酵制氢奠定一定的暗发酵细菌菌种资源和工艺条件基础.
本文主要是针对目前国内外对高效降解木糖制氢的高效暗细菌菌种不足的问题,开展高效降解木糖的暗细菌的分离及产氢条件优化工作,为大规模制氢提供优良菌种及工艺条件.
1 实验部分
1.1 实验样品
牛粪、马粪采集于西安市未央区西栅村等几家村民家中,牛粪为实验室储存.
1.2 主要药品及仪器
(1)主要药品
葡萄糖、木糖、L-谷氨酸、酵母膏、氯化钠、L-天冬氨酸、硫酸铵等,所用药品均为分析纯.
(2)主要仪器
紫外分光光度计(SP-UV1100)、电热恒温培养箱(DH3600BII)、立式压力蒸汽灭菌锅(BOXUNM-30R)、雷磁pH计(PHSJ-3F)、高温烘箱(WGL-125B)、光照培养箱(GXZ-380B)等.
1.3 实验方法
(1)暗细菌分离源样品采集及保存实验
西安市未央区西栅村等几家村民家中采集的家禽粪便(羊粪200克,马粪200克),取样后放于4 ℃冰箱保存.
(2)样品处理及液体富集实验
将采集好的家禽粪便在报纸上铺开,于95 ℃,2小时的条件下烘干至无水分状态.之后称取每种烘干粪便各5克于250毫升锥形瓶中,加入100毫升水,充分浸泡粪便样品2小时,并每隔30分钟充分摇匀.
取10 mL过滤菌液加入100 mL产氢液[22]中进行液体富集,35 ℃培养48 h.
(3)暗细菌分离纯化、鉴定实验
采用固体暗细菌分离平板对暗细菌进行分离纯化实验,纯化操作至少三次,以保证获得细菌为纯菌.三次纯化后获得单菌落进行液体富集培养,取少量液体在显微镜下观察,判断细菌纯度.
暗细菌菌种鉴定试验:采用基因组提取试剂盒,提取待测菌株基因组,后采用27F (5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R (5′-TAC GGT TAC CTT GTT ACG ACT T-3′)通用引物进行PCR扩增试验,扩增后的片段送往擎科生物公司进行测序.测序后的结果在NCBI网站进行BLAST比对,获得新分离暗细菌的种属信息[23].
(4)暗细菌产氢实验
暗细菌培养物制备:在固体暗细菌分离平板划线复苏保存于-80 ℃超低温冰箱的暗细菌冻存液,后置于35 ℃厌氧培养48 h.
产氢液配制:按实验设计配制产氢液[22],灭菌后过滤加入磷酸盐缓冲液(1 M)20 mL/L、Solution C 20 mL/L、维生素1 mL/L,混匀后备用.
产氢实验:暗细菌液体培养物以5%的接种量接入含有100 mL产氢液的反应器,后置于温度为35 ℃、震荡频率为120 次/分的恒温水浴锅中,固定时间记录产氢量数据并测定氢气浓度,实验周期为41 h.
1.4 分析测试方法
(1)木糖浓度测试
木糖浓度测定采用间苯三酚法,采用D-木糖测试盒(南京建成生物工程研究所)测定.在试管中加入3 mL间苯三酚试剂,后加入0.03 mL样品、双蒸水(空白)、D-木糖标准品(1.33 mmol/L木糖)后在100 ℃沸腾水浴锅中煮沸4 min,后放入冷水中迅速冷却.混匀后,在分光光度计(554 nm)测定吸光度值,所得数据代入公式(1),即可求出木糖浓度值.

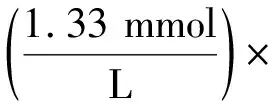
150
(1)
(2)氢气浓度测定
气相色谱仪主要由气液系统、色谱分离系统、温度控制系统、检测系统,数据处理及其他辅助部件等组成.样品气体经进样口被色谱分离后,各组分分别进入检测器,检测器产生相应的输出信号,得到曲线图.
用进样针抽取3 mL氢气,一边抽气一边推针管活塞,然后迅速进样,待测定结束抄取出峰时间和峰面积.
测试条件:后检测器温度:250 ℃;柱箱温度:90 ℃;载气:Ar.
氢气浓度=样品氢气峰面积/纯氢气峰面积
(3)产氢量测定
氢气体积依据公式(2)计算[22]:
V=Vori+∑Viri
(2)
式(2)中:V是累计产氢量;Vo是反应器上部空间;Vi是反应器实时排出的液体体积;ri是实时氢气浓度.
动力学模型:
批式产氢实验的累积产氢量的动力学模型依据下面公式(3)计算[22]:
(3)
式(3)中:H是累计产氢量,λ是延迟时间(h),P是最大产氢量(mL),Rm是最大产氢速率(mL/(L·h)),e是2.718 281 828.
2 结果与讨论
2.1 11号暗细菌菌种鉴定
将获得的含菌滤液采用暗细菌液体培养基富集,后采用暗细菌分离培养基平板进行划线纯化,纯化至少三次,镜检,共分离获得11株纯菌.11株暗细菌以葡萄糖和木糖为复合碳源进行产氢测试,结果发现11号暗细菌产氢性能最佳.提取11号菌的基因组进行16S rRNA序列扩增,扩增产物送至擎科生物公司进行测序,测序结果在NCBI网站采用BLAST工具进行比对,比对结果显示11号菌与Escherichiacoli相似度为99%,该暗细菌被命为EscherichiacoliXRN510.
2.2 不同碳源对Escherichia coli XRN510产氢性能的影响
不同碳源对EscherichiacoliXRN510产氢性能的影响曲线如图1所示.对农作物秸秆水解液中包含的主要还原糖如葡萄糖、木糖、D-果糖、α-乳糖为底物进行产氢测试.由图1(a)发现D-木糖产氢量最大,为1 456.53±100.86 mL/L,最大产氢速率为286.97±64.92 mL/(L·h),延迟时间为22.44±1.31 h.葡萄糖产氢量也较高,为1 156.77±64.10 mL/L,最大产氢速率为177.49±44.30 mL/(L·h),延迟时间为22.88±0.56 h.D-果糖为碳源的产氢量最小为1 044.85±47.29 mL/L,最大产氢速率为213.29±84.98 mL/(L·h),延迟时间为23.11±0.46 h.因农作物秸秆水解液主要成分为葡萄糖和木糖,经过碳源测试后,选取木糖为后续底物进行产氢性能研究.通过实验发现EscherichiacoliXRN510对农作物秸秆水解液中的主要还原糖葡萄糖和木糖降解制氢效果良好,产氢量和产氢速率均较高,且延迟时间较短,这说明EscherichiacoliXRN510可以高效利用葡萄糖和木糖制氢,对于以葡萄糖和木糖为主的农作物秸秆水解液制氢具有很大应用潜力.
由图1(b)的生物量曲线,发现D-果糖为碳源时,菌体生长量为测试的4种碳源中最大的,为8.5 g/L,这可能是由于D-果糖比较好降解利用,由D-果糖的底物降解率为69.69%,也可以看出D-果糖可以很好被暗细菌EscherichiacoliXRN510利用,D-果糖的产氢量为1 044.85±47.29 mL/L,产氢量最低,结合菌体量和产氢量可以看出D-果糖这种碳源更有利于转化为菌体.由图1(a)发现产氢量前三的碳源依次为D-木糖、α-乳糖和葡萄糖,结合图1(b)的发酵液最终pH曲线,发现产氢量高的碳源,其发酵液最终pH并不低,产氢量低的其发酵液最终pH也不高,这可能是由于暗细菌EscherichiacoliXRN510在制氢的过程中不同的碳源的产氢代谢途径不同所致,不同产氢代谢途径产生的小分子酸不同,引起发酵液pH变化程度不同.由图1(b)的底物降解率曲线,发现底物降解率从高到低的碳源依次为D-木糖、葡萄糖、α-乳糖和D-果糖,结合生物量可推测D-果糖的底物降解率高是由于其菌体生长量最大所引起,结合产氢量,D-木糖的底物降解率高是由于其产氢量最大所引起,其他两种糖类的底物降解率较高可能是其产氢量较高所致.
经上述综合分析,由于木糖是花生壳水解液的主要成分,且暗细菌EscherichiacoliXRN510以木糖为碳源制氢性能良好,选取木糖为后续碳源进行优化实验.
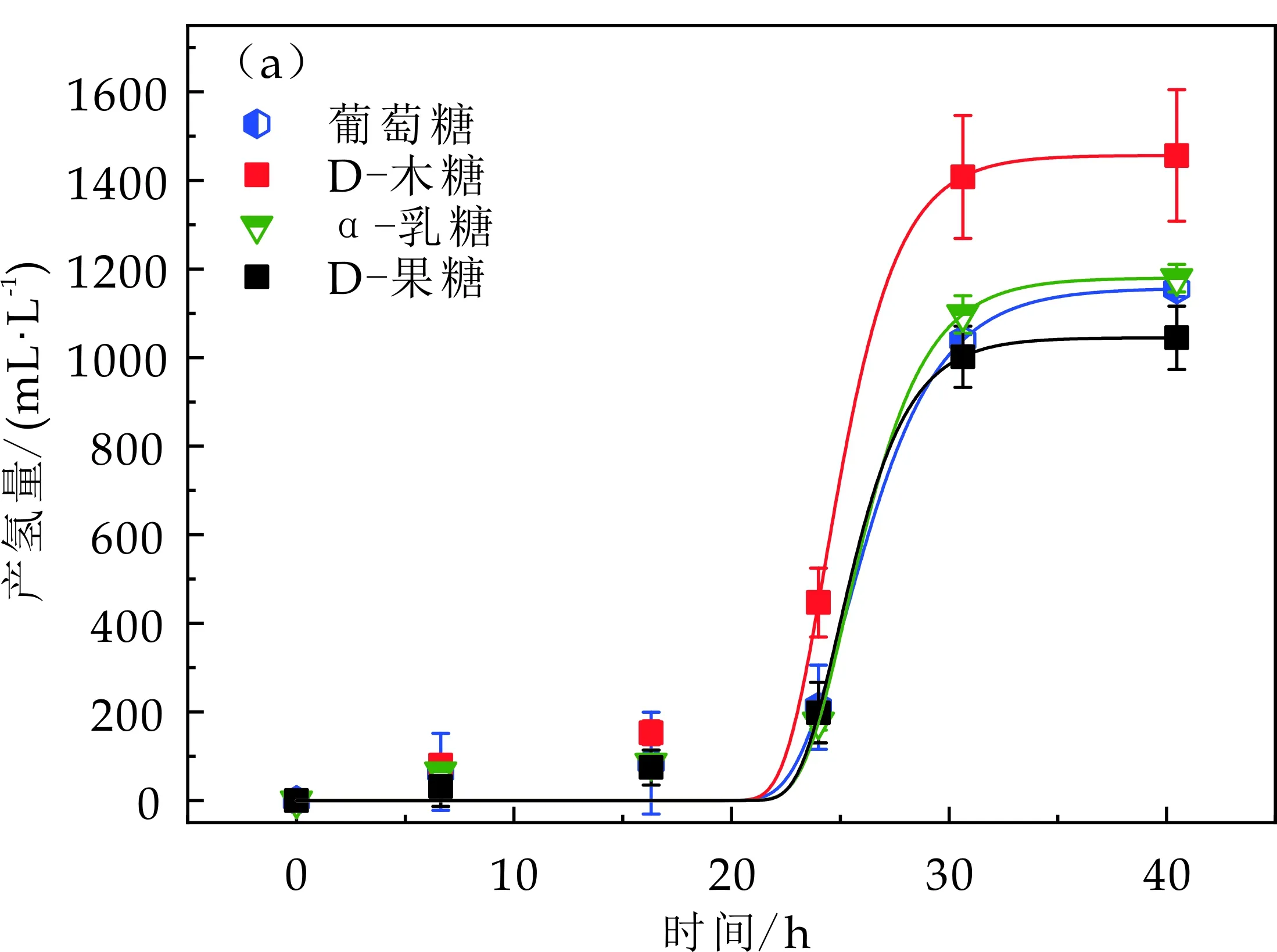
(a)Escherichia coli XRN510以不同碳源为底物的产氢曲线
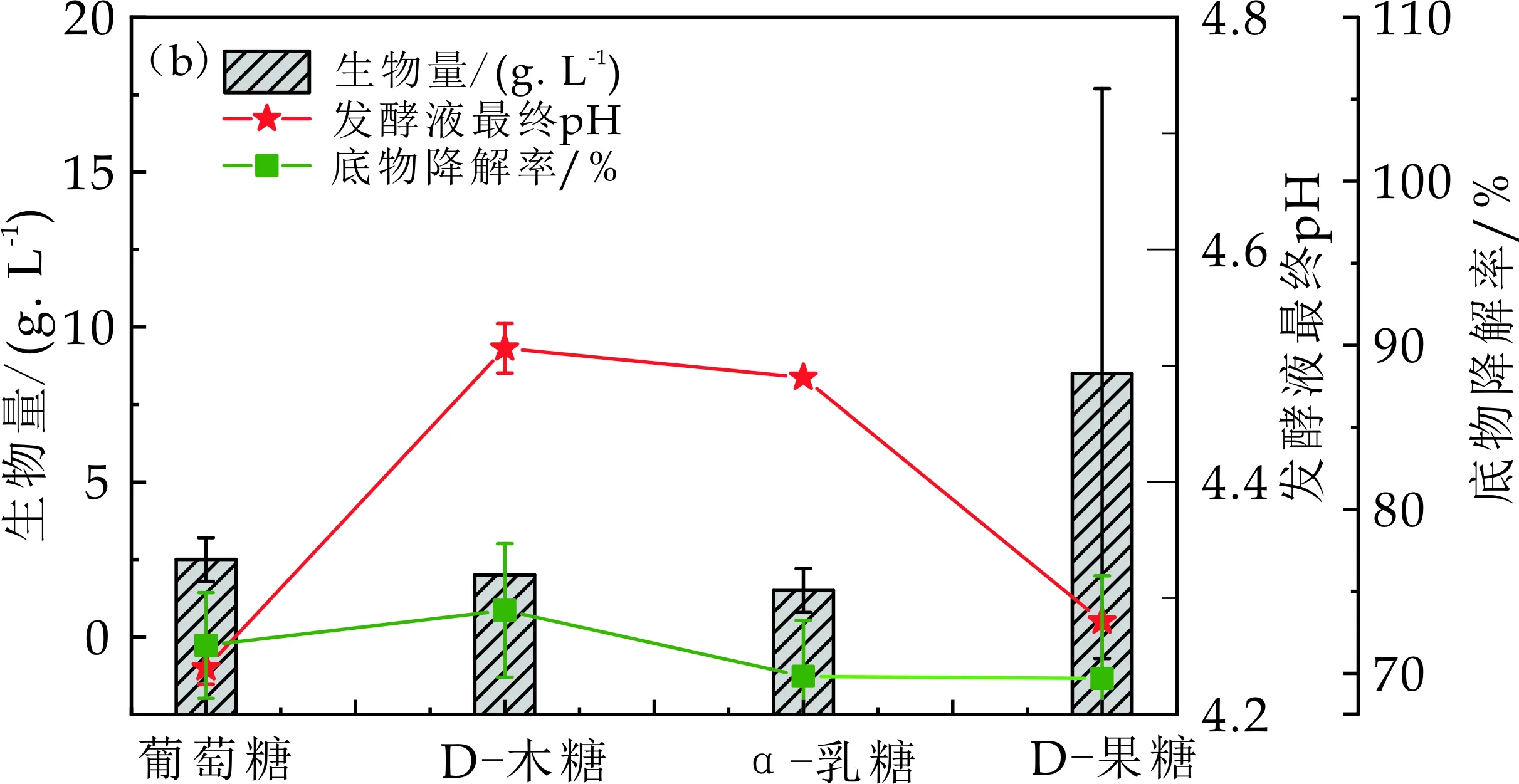
(b)Escherichia coli XRN510以不同碳源为底物制氢结束发酵液中生物量、发酵液最终pH及底物降解率变化规律图1 不同碳源对Escherichia coli XRN510产氢性能的影响
2.3 不同浓度木糖对Escherichia coli XRN510产氢性能的影响
以D-木糖为碳源,L-谷氨酸和酵母膏为氮源,制氢液初始pH为7.2,EscherichiacoliXRN510在不同浓度木糖的制氢液中进行产氢测试,产氢性能曲线如图2所示.由图2(a)发现,当制氢液的木糖浓度从5.0 g/L增加到10.0 g/L时,产氢量从1 130.73±5.68 mL/L增加到1 456.53±100.86 mL/L,当木糖浓度为10.0 g/L时,获得最大的产氢量1 456.53±100.86 mL/L.当木糖浓度继续增加时,产氢量呈现降低趋势.图2(a)数据表明,制氢液中木糖浓度会对EscherichiacoliXRN510的制氢性能产生很大影响,木糖浓度为10.0 g/L时,EscherichiacoliXRN510的产氢量最大,产氢性能最佳.过低或过高木糖浓度均对EscherichiacoliXRN510的产氢性能产生抑制作用,这可能是由于木糖浓度会影响EscherichiacoliXRN510的渗透压,对于EscherichiacoliXRN510的菌体正常形态起到重要影响,过低或过高木糖浓度会可能会影响EscherichiacoliXRN510的菌体正常形态及渗透压,对EscherichiacoliXRN510的生长产生抑制作用,进而影响暗细菌的制氢性能[24].
由图2(b)的生物量曲线,可以看出木糖浓度为5.0 g/L时,暗细菌EscherichiacoliXRN510的菌体生长量最小,这可能与过低木糖会使暗细菌EscherichiacoliXRN510合成菌体的碳源不足有关,进而影响菌体生长.当木糖浓度为15.0 g/L时,菌体生长量最大,这可能是由于过低木糖浓度会导致EscherichiacoliXRN510合成菌体的碳源不足影响菌体生长.过高木糖浓度可能会影响EscherichiacoliXRN510的菌体正常形态及渗透压,对EscherichiacoliXRN510的生长产生抑制作用.由图2(b)的发酵液最终pH曲线,随着木糖浓度从5.0 g/L增加至30.0 g/L时,发酵液最终pH逐渐降低,这可能与木糖浓度越高,会诱导细菌产生更多的酸性物质有关.由图2(b)的底物降解率曲线,可以看出产氢液的底物降解率与葡木糖浓度有关,木糖浓度越大,底物降解率越低,这可能与暗细菌在一个实验周期中暗细菌生长及制氢所需的碳源质量变化不大有关,由实验数据分析发现,当葡萄糖浓度在5.0~30.0 g/L时,木糖消耗量在4.0~15.0 g/L,这也说明木糖浓度增大并不会导致暗细菌EscherichiacoliXRN510消耗木糖的量成倍数增长[22].
经上述综合分析,木糖浓度为10.0 g/L是最适合EscherichiacoliXRN510制氢的,后续以产氢液木糖浓度为10.0 g/L进行后续产氢研究.

(a)Escherichia coli XRN510以不同浓度木糖为底物的产氢曲线

(b)Escherichia coli XRN510以不同浓度木糖为底物制氢结束发酵液中生物量、发酵液最终pH及底物降解率变化规律图2 不同浓度木糖对Escherichia coli XRN510产氢性能的影响
2.4 不同氮源对Escherichia coli XRN510产氢性能的影响
以木糖为碳源,分别对酵母膏、L-谷氨酸和硫酸铵及两两组合为氮源进行产氢性能测试,EscherichiacoliXRN510在不同氮源条件下的产氢性能曲线如图3所示.由图3(a)发现,氮源为L-谷氨酸和酵母膏这一组合时,暗细菌EscherichiacoliXRN510的产氢量最大为1 328.25±43.67 mL/L,最大产氢速率为228.14±50.60 mL/(L·h),延迟时间为22.61 ±0.39 h.L-谷氨酸为氮源的产氢量为278.19±50.10 mL/L,最大产氢速率为7.78±1.50 mL/(L·h),延迟时间为2.39 h.酵母膏为氮源的产氢量为1 034.92±13.73 mL/L,最大产氢速率为191.00±15.91 mL/(L·h),延迟时间为23.16±0.12 h.通过实验发现EscherichiacoliXRN510以L-谷氨酸和酵母膏这一组合为氮源时的产氢量最高,产氢速率最大,因此,L-谷氨酸和酵母膏这一组合是最适合EscherichiacoliXRN510制氢的氮源.此外,还可以发现L-谷氨酸和酵母膏这一组合为氮源时暗细菌EscherichiacoliXRN510的产氢量要高于单独的L-谷氨酸、酵母膏的氮源,发现L-谷氨酸和酵母膏在形成组合氮源时,对暗细菌EscherichiacoliXRN510的制氢中表现为协同作用,这种协同效应,在L-谷氨酸与硫酸铵、酵母膏与硫酸铵这两个氮源组合中也被发现,这种现象可能是由于单一氮源营养物质较为匮乏,不如复合氮源含有的氮源营养物质种类丰富,复合氮源可以满足暗细菌EscherichiacoliXRN510生长及各种制氢代谢途径的需要,使暗细菌EscherichiacoliXRN510的菌体生长产氢代谢途径均保持良好状态,进而获得优良的产氢量.此外,L-谷氨酸和酵母膏均属于有机氮源,成本较高,硫酸铵这种廉价的无机氮源产氢效果也不错.说明EscherichiacoliXRN510即可利用有机氮源也可利用无机氮源产氢.后续在应用EscherichiacoliXRN510进行制氢时宜选用有机氮源和无机氮源的组合或复合氮源为制氢氮源.
由图3(b)的生物量曲线,发现硫酸铵为氮源时暗细菌EscherichiacoliXRN510的菌体生长量最小,这可能是因为硫酸铵是无机氮源,暗细菌EscherichiacoliXRN510在利用无机氮源时要消耗更多的能量,进而影响菌体生长,导致生物量不高.暗细菌EscherichiacoliXRN510以L-谷氨酸或酵母膏为氮源时菌体生长量为测试的6种氮源中较高的,这可能是由于L-谷氨酸或酵母膏为有机氮源,其与暗细菌EscherichiacoliXRN510的菌体结构成分更为近似,使得暗细菌EscherichiacoliXRN510在使用L-谷氨酸或酵母膏生长及制氢时更为容易,进而可以获得较高的生物量及产氢量[25].由图3(b)的发酵液最终pH曲线,可以发现单独的L-谷氨酸为氮源时,发酵液最终pH最高,这可能是由于L-谷氨酸为氮源时其产氢量最低有关,产氢量最低其制氢过程中产生的酸性物质越少进而发酵液pH变化最小.此外,还发现L-谷氨酸和酵母膏这一组合氮源的发酵液最终pH介于单独的L-谷氨酸、单独的酵母膏为氮源的发酵液最终pH之间,这一现象在L-谷氨酸和硫酸铵这一组合氮源中也被发现,推测这可能是由于这组合的复合氮源引发暗细菌EscherichiacoliXRN510产氢过程中不同的产氢代谢途径有关.由图3(b)的底物降解率曲线,结合图3(a)发现菌种生长量相差不多的情况下,产氢量越高,底物降解率越高,这可能是由于产氢需要消耗大量的碳源,产氢量越大消耗的碳源越多.经上述综合分析,L-谷氨酸和酵母膏这一组合氮源是最适合EscherichiacoliXRN510制氢的氮源,后续以L-谷氨酸和酵母膏这一组合为氮源进行后续产氢研究.

(a)Escherichia coli XRN510在不同氮源条件下的产氢曲线
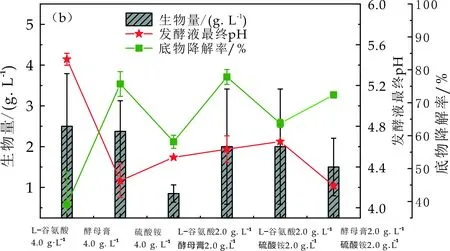
(b)Escherichia coli XRN510在不同氮源条件下制氢结束发酵液中生物量、发酵液最终pH及底物降解率变化规律图3 不同氮源对Escherichia coli XRN510产氢性能的影响
2.5 不同氮源比例对Escherichia coli XRN510产氢性能的影响
以木糖为碳源,以L-谷氨酸和酵母膏这一组合为氮源进行产氢性能测试,不同氮源比例对EscherichiacoliXRN510产氢性能影响曲线如图4所示.由图4(a)发现,氮源为L-谷氨酸∶酵母膏从0∶4增加到3∶5时,暗细菌EscherichiacoliXRN510的产氢量从1 034.92±13.70 mL/L增大到1 468.93±61.52 mL/L.在氮源为L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L时,暗细菌EscherichiacoliXRN510的产氢量最大为1 468.93±61.52 mL/L.随着氮源为L-谷氨酸∶酵母膏从3∶5增加到4∶0时,暗细菌EscherichiacoliXRN510的产氢量逐渐降低,当L-谷氨酸∶酵母膏为4∶0,即L-谷氨酸4.0 g/L为氮源,产氢量达到最低值为278.19±50.10 mL/L,与L-谷氨酸∶酵母膏为3∶5时的产氢量相比减少了80.22%.通过实验发现EscherichiacoliXRN510以L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L为氮源时的产氢量最高,因此,L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L这一氮源比例是最适合EscherichiacoliXRN510制氢的氮源比例,后续以L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L这一氮源比例为组合氮源进行后续产氢研究.
由图4(b)的生物量曲线,发现L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L为氮源时,暗细菌EscherichiacoliXRN510的菌体生长量最大,这可能是因为氮源组合中L-谷氨酸∶酵母膏为3∶5时,暗细菌EscherichiacoliXRN510菌体生长所需氮源种类和营养物质的数量刚好与产氢液提供的氮源种类及数量最为接近,从而在此时获得最大的生物量.由图4(b)的发酵液最终pH曲线,可以发现单独的L-谷氨酸为氮源时,发酵液最终pH最高,这可能是由于L-谷氨酸为氮源时其产氢量最低有关,产氢量最低其制氢过程中产生的酸性物质越少进而发酵液pH变化最小.单独的酵母膏为氮源时,发酵液最终pH最低,这可能与暗细菌EscherichiacoliXRN510使用酵母膏制氢时的产氢代谢途径产生更多的酸性物质有关系.此外,还发现L-谷氨酸∶酵母膏从0∶4增加到4∶0时,组合氮源的发酵液最终pH介于单独的L-谷氨酸、单独的酵母膏为氮源的发酵液最终pH之间,且呈现逐渐增大的趋势.推测这可能是由于酵母膏这种氮源引发暗细菌EscherichiacoliXRN510产氢过程中产生更多的酸性物质的产氢代谢途径有关.由图4(b)的底物降解率曲线,结合图4(a)发现菌种生长量相差不多的情况下,产氢量越高,底物降解率越高,这可能是由于产氢需要消耗大量的碳源,产氢量越大消耗的碳源越多[22].
经上述综合分析,L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L这一组合氮源是最适合EscherichiacoliXRN510制氢的氮源比例,后续以L-谷氨酸∶酵母膏为3∶5,即L-谷氨酸1.5 g/L和酵母膏2.5 g/L这一氮源比例的组合为氮源进行后续产氢研究.

(a)Escherichia coli XRN510在不同氮源比例条件下的产氢曲线
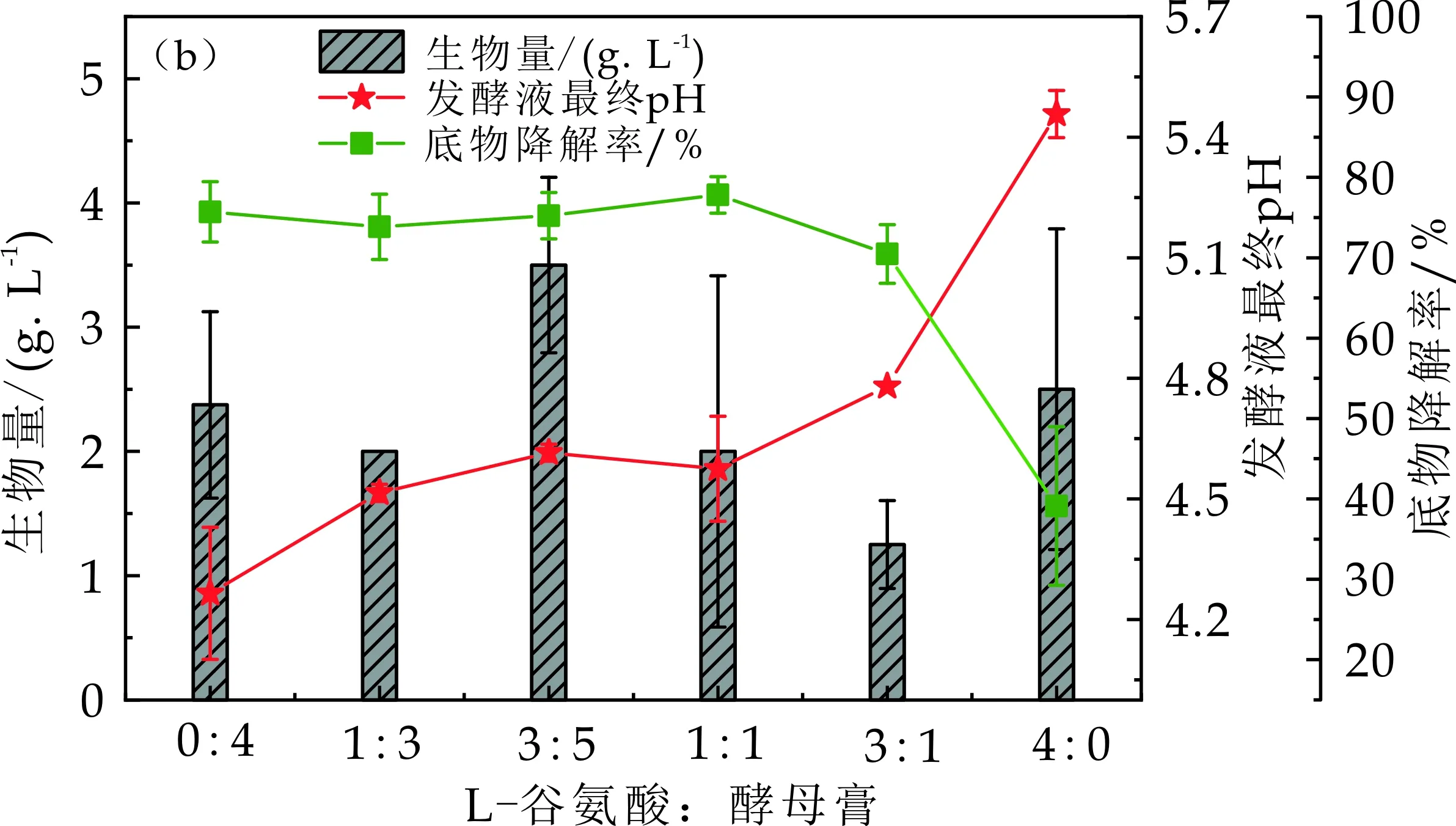
(b)Escherichia coli XRN510在不同氮源比例条件下制氢结束发酵液中生物量、发酵液最终pH及底物降解率变化规律图4 不同氮源比例对Escherichia coli XRN510产氢性能的影响
2.6 不同初始pH对Escherichia coli XRN510产氢性能的影响
以木糖为碳源,以L-谷氨酸1.5 g/L和酵母膏2.5 g/L这一组合为氮源进行产氢性能测试,不同初始pH产氢液对EscherichiacoliXRN510产氢性能影响曲线如图5所示.由图5(a)发现,当制氢液的初始pH从6.0增加到7.2时,产氢量也逐渐增加,当产氢液初始pH为7.2的产氢量为1 468.93±61.52 mL/L,当初始pH为7.2时,获得最大的产氢量.当初始pH从7.2继续增加至8.5时,产氢量呈现降低趋势,当初始pH为8.5时,产氢量为1 211.40±50.20 mL/L,与初始pH为7.2时的产氢量相比降低17.53%.图5(a)数据表明,制氢液初始pH会对EscherichiacoliXRN510的制氢性能产生很大影响,初始pH为7.2时EscherichiacoliXRN510的产氢量最大,产氢性能最佳.过低或过高pH均对EscherichiacoliXRN510的产氢性能产生抑制作用,这可能是由于EscherichiacoliXRN510内部的与制氢有关的主要酶系最适宜pH为7.2,过低过高pH会对这些酶系的酶活性产生抑制作用,进而影响光合细菌的制氢性能[26-28].
由图5(b)发现,产氢液初始pH为8.5时暗细菌EscherichiacoliXRN510的菌体生长量最小,这可能与产氢液初始pH过高会影响暗细菌EscherichiacoliXRN510菌体内酶有关,过高pH通过抑制酶活性进而影响菌体生长和产氢.产氢液初始pH为7.2时,菌体生长量为测试的6种初始pH中最大的,为3.5 g/L,这可能是由于产氢液初始pH为7.2更利于菌体内与生长相关的酶的活性处于最高有关.由图5(b)的发酵液最终pH曲线,发现随着产氢液初始pH从6.0升高到8.5时,发酵液最终pH在4.52~4.62之间,产氢液初始pH的跨度为2.5,但是发酵液最终pH的跨度为0.1,这说明产氢液初始pH对发酵液最终pH的影响较小,这也说明暗细菌EscherichiacoliXRN510在发酵液pH降为4.52~4.62时停止产氢和生长.由图5(b)的底物降解率曲线,可以看出产氢液初始pH为6.0及8.5时的底物降解率大趋势是随pH升高而逐渐升高,这可能是由于暗细菌产氢液初始pH越高,暗细菌需要维持菌体生命活动的能量越大,进而需要消耗的碳源也更多,进而对底物降解率也越高[24].
经上述综合分析,产氢液初始pH为7.2是最适合暗细菌EscherichiacoliXRN510制氢的.

(a)Escherichia coli XRN510在产氢液不同初始pH条件下的产氢曲线
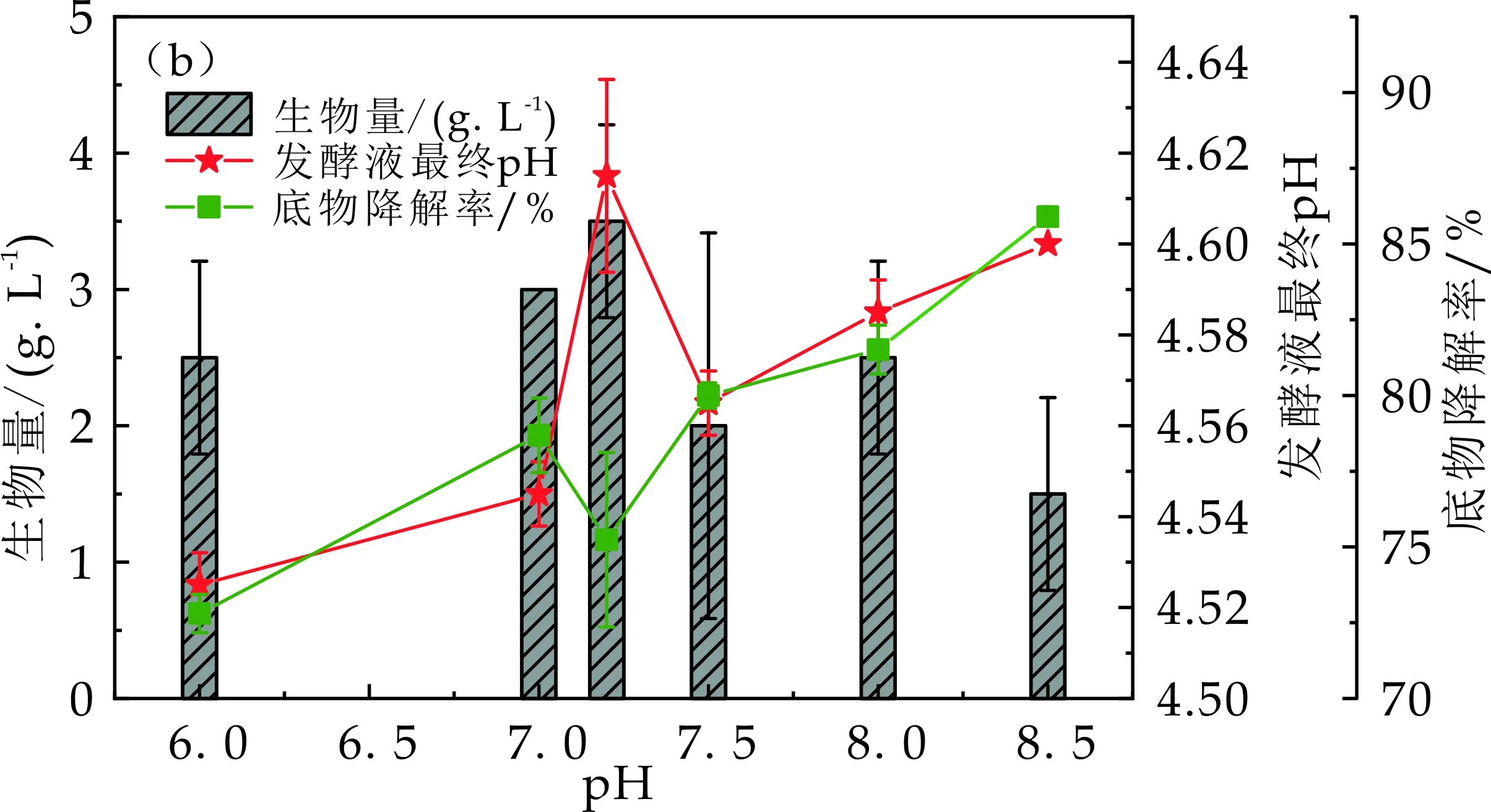
(b)Escherichia coli XRN510在产氢液不同初始pH条件下制氢结束发酵液中生物量、发酵液最终pH及底物降解率变化规律图5 产氢液不同初始pH对Escherichia coliXRN510产氢性能的影响
2.7 Escherichia coli XRN510的产氢性能与国内外主要研究结果比较
EscherichiacoliXRN510的产氢性能与国内外主要研究结果如表1所示.本文所分离获得暗细菌EscherichiacoliXRN510的产氢量为1.31 mol H2/mol-木糖,处于较高水平,说明该菌种产氢性能优良,可为以木糖和葡萄糖为主的农作物秸秆水解液制氢提供优良的菌种资源,对于农作物秸秆为底物的大规模制氢具有一定的推动作用.
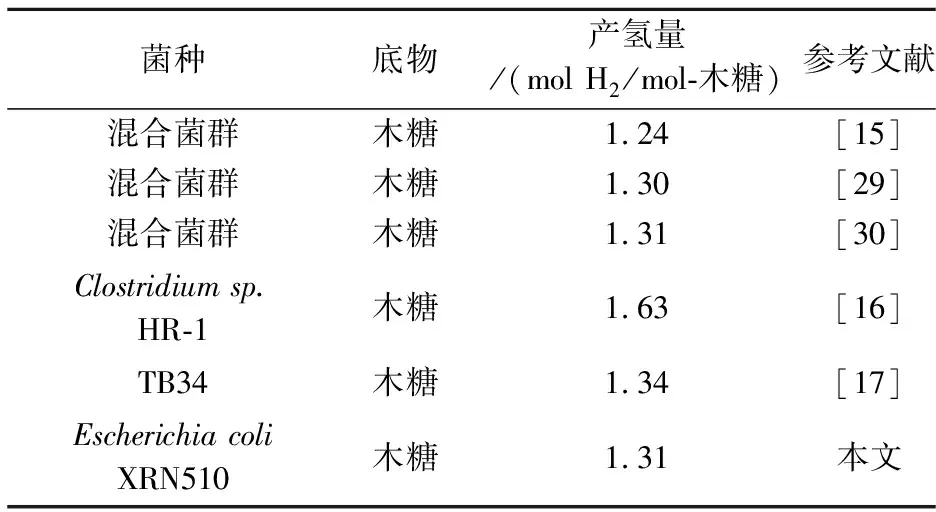
表1 Escherichia coli XRN510的产氢性能与国内外主要研究结果比较
3 结论
通过对产氢条件逐一优化,得出最佳产氢条件为碳源为木糖,木糖浓度为10.0 g/L,最优氮源为L-谷氨酸1.5 g/L和酵母膏2.5 g/L的混合氮源,产氢液初始pH为7.2,此时该菌株产氢量最大.另外,该菌可以利用多种氮源和碳源产氢,对于以葡萄糖和木糖为主的农作物秸秆水解液制氢具有很大应用潜力.

