热休克蛋白5调控内质网应激在视网膜色素上皮细胞保护中的作用△
冯竞仰 陆冰 朱鸿 孙向军 孙晓东
视网膜色素上皮(retinal pigment epithelium,RPE)位于脉络膜与视网膜神经上皮层之间,参与组成血-视网膜屏障,吞噬转运视循环产物,对维持光感受器细胞代谢和视网膜功能起着至关重要的作用。生理状态下,RPE细胞不断吞噬光感受器细胞外节脱落的膜盘以维持其日常代谢。随着年龄增长,部分不能被溶酶体消化的膜盘沉积在RPE细胞内,形成脂褐素[1]。大量脂褐素堆积并释放光化学毒性物质导致RPE细胞损伤和功能减退,是年龄相关性黄斑变性(age-related macular degeneration,AMD)发病的重要机制之一[2-3]。N-亚视黄基-N-视黄基乙醇胺(N-retinylidene-N-retinylethanolamine,A2E)作为RPE细胞内脂褐素的主要荧光基团,可在430~480 nm波段内的光照刺激下产生大量活性氧,导致RPE细胞损伤[4]。近年来,随着对细胞损伤机制研究的不断深入,人们发现除了经典的线粒体相关凋亡途径外,内质网同样可以感知和整合损伤信号,参与细胞凋亡[5]。本研究通过建立A2E联合蓝光诱导RPE细胞损伤模型,探讨内质网应激参与RPE细胞损伤的过程,以及相对分子质量70 000的热休克蛋白5(heat shock 70 kDa protein 5,HSPA5)对RPE细胞的保护作用。
1 材料与方法
1.1 主要试剂和仪器人ARPE-19细胞株(American Type Culture Collection,美国),全反式视黄醛、乙醇胺(Sigma,美国),DMEM/F12(Dulbecco’s modified Eagle’s/Ham’s F12)11培养液、胎牛血清(Gibco,美国),CCK-8细胞活性检测试剂盒、SDS-PAGE凝胶配制试剂盒(碧云天,中国),慢病毒质粒LV-HSPA5-GFP-shRNA、LV-NC-GFP-shRNA(上海吉玛制药技术有限公司),HSPA5单克隆抗体(Cat.3216-1,Epitomics,美国),CHOP单克隆抗体(Cat.sc-7351)、caspase-12多克隆抗体(Cat.sc-70227)、β-actin单克隆抗体(Cat.sc-8432;Santa Cruz,美国)。L18W/71型蓝光灯(Osram,德国),5202型数字光照度计(Kyoritsu,日本),IX70型倒置相差显微镜、激光共聚焦显微镜(Olympus,日本),680型酶联免疫检测仪(Bio-Rad,美国)等。
1.2 方法
1.2.1 RPE细胞培养人RPE细胞复苏后加入DMEM/F12培养液(含体积分数10%胎牛血清),置于37 ℃、含体积分数5%CO2的细胞培养箱培养。根据细胞生长速度,按12比例传代继续培养。使用胰蛋白酶溶液收集对数生长期RPE细胞,计数后稀释至100× 106个·L-1。将细胞悬液依据实验要求接种于培养皿,待RPE细胞贴壁生长至80%~90%融合后,换成无血清培养液,放置24 h后再接受处理。
1.2.2 A2E联合蓝光诱导RPE细胞损伤模型建立A2E由全反式视黄醛和乙醇胺依据参考文献化学合成[4,6]。(1)A2E与RPE细胞共培养:将含25 μmol·L-1A2E的培养液加入RPE细胞中,置于培养箱中孵育2 h;去除原培养液,温PBS清洗细胞,充分洗去细胞外A2E,重新加入不含胎牛血清培养液,继续培养24 h;运用光学倒置显微镜观察RPE细胞内A2E颗粒情况;激光共聚焦显微镜观察RPE细胞内A2E自发荧光情况。(2)联合蓝光诱导RPE细胞损伤:采用L18W/71型蓝光灯在(460±20)nm照射A2E共培养后的RPE细胞20 min,光照在暗室中密闭进行,无自然光干扰,电子温度计监测室温为(37.0±0.3)℃,光照度计检测细胞水平上光照强度为4000 lux。对照组为不作任何处理的RPE细胞。
1.2.3 HSPA5 shRNA慢病毒载体构建和转染干扰质粒LV-HSPA5-GFP-shRNA(干扰序列5’-GCTCGACTCGAATTCCAAAGA-3’)和阴性对照LV-NC-GFP-shRNA(干扰序列5’-TTCTCCGAACGTGTCACGT-3’)的构建由上海吉玛制药技术有限公司完成。将RPE细胞按每孔1.5 × 106个接种至24孔培养板内,培养24 h,每孔加入0.5 mL凝胶胺,使其浓度为6 mg·L-1,室温孵育30 min以提高细胞感染效率,再加入含shRNA慢病毒颗粒的培养液,每孔200 μL,培养过夜后更换为新鲜培养液,继续培养48 h。采用750 μg·L-1嘌呤霉素进行药物筛选,将筛选出的耐药细胞株扩大培养,获得稳定沉默HSPA5基因的RPE细胞。细胞随机分为3组:转染HSPA5干扰序列的RPE细胞为HSPA5干扰组;转染阴性对照序列的RPE细胞为阴性干扰组;未转染的RPE细胞为野生型组。转染72 h后做后续实验。采用荧光显微镜观察RPE细胞内GFP荧光表达,Western blot检测HSPA5蛋白表达,验证HSPA5基因干扰有效性。
1.2.4 RPE细胞活力检测采用CCK-8法检测细胞活力。收集对数生长期RPE细胞,计数后稀释至100×106个·L-1,以每孔100 μL接种于96孔培养板内。按各实验目的处理细胞:(1)按1.2.2方法诱导A2E联合蓝光损伤RPE细胞后,分别培养3 h、6 h、12 h、24 h和48 h,检测细胞活力的变化;(2)按 1.2.3 方法处理细胞后,对HSPA5干扰组、阴性干扰组、野生型组RPE细胞均给予A2E联合蓝光诱导细胞损伤后继续培养12 h,检测细胞活力的变化;(3)检测对照组细胞活力。具体检测方法为:去除培养液,温PBS冲洗细胞,每孔加入含20 μL CCK-8试剂的培养液100 μL,置于培养箱内继续孵育2 h。采用酶联免疫检测仪在450 nm波长处测定吸光度值。最终细胞活力结果表示为A2E处理组吸光度值与对照组吸光度值的比值。每组设定5个复孔,实验重复3次。
1.2.5 Western blot检测RPE细胞培养于9 cm培养皿中,按各实验目的处理细胞:(1)按1.2.2方法诱导A2E联合蓝光损伤RPE细胞后,分别培养3 h、6 h、12 h、24 h和48 h,检测HSPA5和CHOP蛋白的表达变化;(2)按1.2.3方法处理细胞后,检测HSPA5干扰组、阴性干扰组、野生型组HSPA5蛋白表达情况,之后对3组细胞均给予A2E联合蓝光诱导细胞损伤后继续培养12 h,检测HSPA5、CHOP和Caspase-12蛋白的表达变化;(3)检测对照组HSPA5、CHOP和Caspase-12蛋白的表达。具体检测方法为:去除培养液,PBS冲洗,加入细胞裂解液。收集细胞,于4 ℃ 下12 000 r·min-1离心5 min,取含蛋白的上清液。每100 μL蛋白样品加入25 μL 蛋白上样缓冲液,100 ℃水浴8 min。运用SDS-PAGE对样品中的蛋白进行分离,并转移至PVDF膜。使用含50 g·L-1脱脂牛奶和体积分数0.1%Tween-20的TBS封闭 2 h,分别加入11000稀释的HSPA5抗体、1200稀释的CHOP抗体、1200稀释的Caspase-12抗体,于4 ℃孵育过夜。TBST冲洗后加入二抗,于37 ℃孵育2 h。使用ECL显色,Bio-Rad凝胶成像仪采集图像。运用Image-J分析条带灰度值。
1.3 统计学分析使用SPSS 17.0软件进行数据分析,计量资料用均数±标准差表示,采用单因素方差分析比较组间差异性,检验水准:α=0.05。
2 结果
2.1 A2E联合蓝光诱导RPE细胞损伤倒置相差显微镜下观察发现,A2E共培养的RPE细胞内出现棕黄色颗粒,而对照组RPE细胞中未见明显颗粒状物质。激光共聚焦显微镜观察发现,A2E共培养的RPE细胞中A2E呈现绿色自发荧光,而对照组未观察到该荧光。CCK-8法检测结果显示,A2E联合蓝光处理后3 h、6 h、12 h、24 h和48 h,RPE细胞活力分别是对照组的(80.9±6.2)%、(73.3±5.8)%、(70.6±5.4)%、(62.3±6.1)%和(51.4±4.5)%,与对照组相比差异均有统计学意义(均为P<0.05)。见图1。
2.2 RPE细胞损伤时内质网应激相关蛋白HSPA5和CHOP表达Western blot检测结果显示,内质网应激标志分子HSPA5蛋白表达在RPE细胞损伤后6 h显著升高,12 h时达到高峰,之后逐渐下降。而CHOP作为内质网应激介导的凋亡相关分子,在对照组表达量低,经A2E及蓝光处理后3 h CHOP蛋白表达出现升高,12 h时有小幅回落,24-48 h时又逐步上升(图2)。提示内质网应激参与A2E联合蓝光诱导RPE细胞损伤。
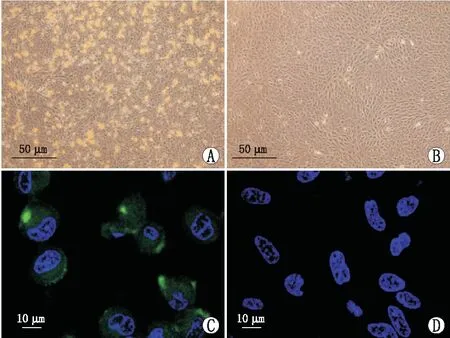
图1 A2E与RPE细胞共培养。A:倒置相差显微镜下,A2E共培养的RPE细胞内出现棕黄色颗粒;B:倒置相差显微镜下,对照组中未见明显颗粒状物质;C:激光共聚焦显微镜下,A2E共培养的RPE细胞中A2E呈绿色自发荧光;D:激光共聚焦显微镜下,对照组中未观察到该荧光

图2 Western blot检测A2E联合蓝光诱导RPE细胞损伤后HSPA5和CHOP蛋白表达。与对照组相比,*P<0.05
2.3 HSPA5基因干扰RPE细胞稳株获得为了验证HSPA5基因干扰的RPE细胞是否稳定且有效,通过荧光显微镜观察发现,慢病毒处理RPE细胞后72 h,HSPA5干扰组细胞内存在GFP荧光表达,提示RPE细胞已被LV-HSPA5-GFP-shRNA有效转染。采用Western blot检测转染RPE细胞中HSPA5蛋白表达,结果显示,慢病毒处理72 h后,HSPA5干扰组中HSPA5蛋白表达较野生型组显著下降(P<0.05),而阴性干扰组HSPA5蛋白表达与野生型组相比未受明显抑制(P>0.05)。见图3。
2.4 沉默HSPA5加重A2E联合蓝光诱导RPE细胞损伤Western blot检测结果显示,A2E联合蓝光损伤RPE细胞后12 h,HSPA5干扰组中HSPA5蛋白表达较野生型组和阴性干扰组均明显下降(均为P<0.05)。HSPA5干扰组与野生型组、阴性干扰组相比CHOP和Caspase-12蛋白表达均显著提高(均为P<0.05)。细胞活力检测结果显示,A2E联合蓝光处理RPE细胞后12 h,HSPA5干扰组RPE细胞活力降低至(56.3±5.1)%,较野生型组(72.9±7.1)%和阴性干扰组(70.3±6.6)%均显著降低(均为P<0.05)。提示HSPA5基因干扰可上调内质网应激相关凋亡蛋白CHOP、Caspase-12的表达,并加重A2E及蓝光对RPE细胞的损伤。见图4。
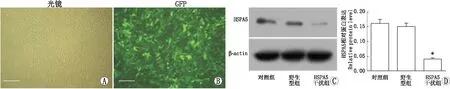
图3 HSPA5基因干扰RPE细胞稳株获得。A:光镜下LV-HSPA5-GFP-shRNA转染RPE细胞后72 h,HSPA5干扰组细胞(标尺:50 μm);B:荧光显微镜下LV-HSPA5-GFP-shRNA转染RPE细胞后72 h,HSPA5干扰组细胞内存在GFP荧光表达(标尺:50 μm);C:Western blot检测电泳结果;D:Western blot检测数据分析结果,慢病毒处理72 h后,HSPA5干扰组中HSPA5蛋白表达较野生型组显著下降(*P<0.05),而阴性干扰组HSPA5蛋白表达未受明显抑制
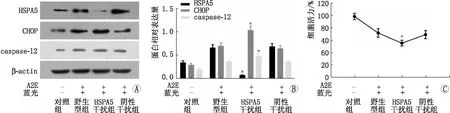
图4 沉默HSPA5加重A2E联合蓝光诱导RPE细胞损伤。A:Western blot检测电泳结果;B:Western blot检测数据分析结果,A2E联合蓝光损伤RPE细胞后12 h,HSPA5干扰组中的HSPA5蛋白表达较野生型组和阴性干扰组均明显下降(*P<0.05),CHOP和Caspase-12蛋白在HSPA5干扰组中的表达与野生型组和阴性干扰组相比均显著提高(*P<0.05);C:细胞活力检测结果显示,A2E联合蓝光损伤RPE细胞后12 h,HSPA5干扰组RPE细胞活力较野生型组和阴性干扰组均显著降低(*P<0.05)
3 讨论
RPE细胞对维持光感受器细胞代谢和视网膜功能起着至关重要的作用。随着年龄增长,脂褐素积聚于RPE细胞内,持续暴露于可见光、紫外线等,诱发光化学毒性物质释放,导致RPE细胞损伤是AMD病理改变的始动环节。正常RPE细胞可通过自噬及溶酶体相关途径逐步降解被吞噬的膜盘,以保持RPE细胞内环境稳定。然而,随着RPE细胞的衰老,其处理代谢产物的能力下降,大量有害物质无法被清除,形成脂褐素积聚。有研究证实,老年人视网膜黄斑部RPE细胞内脂褐素可占到整个细胞面积的约20%[7]。Eldred[8]从老年人视网膜组织中提取出大量脂褐素颗粒,并从中分离出其主要荧光基团A2E。A2E具有很强的光化学毒性,尤其对蓝光敏感。本研究观察到RPE细胞吞噬了A2E后,在蓝光照射下细胞活力出现显著下降,且随着时间延长细胞损伤加重。有研究表明,在蓝光激发下,A2E会发生光氧化反应产生多种活性氧,包括单态氧、过氧化物等[9]。一方面这些活性氧可以攻击细胞的线粒体、内质网、DNA双链等,直接导致RPE细胞损伤[10],另一方面又可以诱导A2E之间通过C-C双键结合,形成A2E的环氧化合物。这些环氧化合物既能进一步加速活性氧生成,又能导致RPE细胞损伤[11]。
新近研究发现,内质网可以感知和整合损伤信号,参与细胞凋亡,在AMD发病机制中起重要作用[12]。作为真核细胞中新合成蛋白质折叠与组装的加工厂,内质网对外界应激因素十分敏感。在各种应激原刺激下,大量错误折叠或未折叠蛋白会在内质网内聚集,引起内质网稳态失衡诱发内质网应激[13]。本研究结果显示,A2E联合蓝光诱导RPE细胞损伤时内质网应激相关分子HSPA5和CHOP蛋白表达较正常对照组显著升高。HSPA5又称免疫球蛋白重链结合蛋白,是热休克蛋白70家族成员之一,长期位于内质网内,是内质网应激感受器和关键分子伴侣[14]。生理状态下,HSPA5通常与内质网膜上的三种跨膜蛋白,即类RNA依赖蛋白激酶样内质网激酶(PERK)、转录激活因子6(ATF6)、肌醇依赖内质网至细胞核信号激酶1(IRE1)结合,处于休眠状态。内质网应激发生初期,HSPA5与跨膜蛋白解离,启动未折叠蛋白反应,同时自身表达上调,辅助蛋白质正确折叠,清除异常蛋白,以恢复内质网稳态,维持细胞生存[15]。本研究中HSPA5蛋白在RPE细胞损伤早期升高,提示在A2E及蓝光照射刺激下,RPE细胞出现一系列内稳态失衡,激活了内质网应激反应,早期通过上调HSPA5蛋白表达,协助异常蛋白折叠并启动降解途径,从而促进内质网恢复稳态。而RPE细胞损伤后48 h,HSPA5蛋白水平呈下降趋势,推测持续剧烈的应激导致RPE细胞不可逆损伤,从而激活内质网应激介导的凋亡途径。
CHOP作为内质网应激介导的凋亡途径中重要调控分子之一,在正常生理条件下表达量较低,当受到应激刺激时,CHOP表达水平升高,提示细胞启动内质网应激相关凋亡途径[16]。有趣的是本研究发现,RPE细胞损伤后CHOP蛋白表达趋势并不是持续增高,而是呈现2个高峰,分别在损伤后6 h和48 h。我们推测第一个高峰可能是由于A2E及蓝光急性损伤RPE细胞所致,而后RPE细胞启动一系列防御机制,包括上调HSPA5激活内质网应激相关降解途径等,在一定程度上清除有害物质,修复细胞功能,维持RPE细胞稳态。然而随着时间延长,损伤超过RPE细胞代偿能力,最终走向内质网应激介导的凋亡途径。
本研究结果还表明,当基因干扰HSPA5表达时,内质网应激介导的凋亡相关分子CHOP和Caspase-12蛋白表达增高,并且加重了A2E及蓝光对RPE细胞的损伤。这一结果表明内质网应激发生时,HSPA5具有部分抵抗凋亡蛋白CHOP和Caspase-12的作用,减轻A2E及蓝光对RPE细胞的损伤。有研究认为,HSPA5激活是细胞在面对应激时一种重要的防御机制,该机制对细胞有保护作用[17]。在肿瘤研究中发现,癌细胞的HSPA5水平普遍较正常细胞高,它可能参与降低细胞毒性T细胞对肿瘤细胞的杀伤作用,抵抗癌细胞凋亡[18]。在年龄相关性神经退行性疾病研究中也发现,抑制HSPA5可以增加神经元对β淀粉样蛋白诱导的细胞凋亡的敏感性,而提高HSPA5表达则可以保护海马部位神经元,减轻β淀粉样蛋白沉积对其造成的损伤[19-20]。
综上所述,内质网应激参与A2E联合蓝光诱导的RPE细胞损伤。HSPA5具有调控内质网应激反应,减轻A2E及蓝光诱导的细胞损伤,促进RPE细胞存活的作用。本研究初步揭示了AMD中RPE细胞损伤机制,为今后早期干预,增强细胞内源性保护和代偿机制提供了理论依据,也为AMD潜在治疗靶点研究提供了新思路。
——疾病防治的新靶标

