绝经后骨质疏松症与醛固酮/肾素比率相关性研究
闵竞 黎洋
1.重庆医科大学附属永川医院创伤骨科,重庆 永川 402160 2.重庆医科大学附属永川医院肾病风湿科,重庆 永川 402160
原发性醛固酮增多症(primary hyperaldo-steronism,PA)是继发性高血压的常见原因,占高血压患者的5%~10%[1]。通过血浆醛固酮浓度(plasma aldosterone concentration,PAC)和血浆肾素浓度(plasma renin concentration,PRC)或肾素活性来计算醛固酮/肾素比(aldosterone/renin ratio,ARR)是PA筛选的常用方法。然而,一些因素影响醛固酮和(或)肾素的分泌,这可能使ARR的解释复杂化并导致假阳性或假阴性结果[2]。因此,确定ARR对PA筛查的潜在混杂因素至关重要。之前的研究[3]报道,高血压女性的ARR水平升高比男性更为显著,这表明到目前为止可能还有其他因素被忽视。骨质疏松症是一种以低骨量,微结构破坏和骨骼脆性为特征的疾病,导致骨折风险增加。它在高龄人群中非常普遍,特别是在绝经后妇女中[4]。在中国大约44%的绝经后妇女患有绝经后骨质疏松症(postmenopausal osteoporosis,PMO)[5]。另一方面,已有研究表明,38%的绝经后妇女患有高血压,64%的高血压妇女患有血压不受控制[6]。根据临床实践指南,应开始对持续血压高于150/100 mmHg的患者进行PA检测[7],因此大量绝经后妇女可能成为PA筛查的候选者。此外,与PMO有关的25-羟基维生素D[25-(OH)D]、甲状旁腺激素(parathyroid hormone,PTH)和骨碱性磷酸酶(bone alkaline phosphatase,BALP)也与肾素-血管紧张素-醛固酮系统(RAAS)密切相关[8]。因此,需要确定PMO是否影响ARR筛查。本研究旨在确定PMO对ARR的影响。利用双能X线吸收测定法(dual-energy X-ray-absorptiometry,DXA)在血压正常的绝经后妇女中进行测量,将其分为3组:PMO组、骨质减少组和骨密度(bone mineral density,BMD)正常的女性。进一步评估PAC、PRC和ARR水平及其与BMD的关系。
1 材料和方法
1.1 研究方案
本研究选取2016年5月至2018年8月在重庆医科大学附属永川医院骨质疏松相关门诊就诊的绝经后女性作为研究对象,符合纳入标准的受试者包括:年龄在45~80岁;体质量指数(body mass index,BMI)介于18~30 kg/m2;闭经超过36个月。排除标准:患有高血压;阻塞性睡眠呼吸暂停低通气综合征;心血管,肝脏或肾脏疾病;甲状旁腺功能亢进症;先天性或后天性骨病;过量饮酒;或在2个月内服用任何药物(包括雌激素或孕激素/睾酮补充剂)。在研究期间,患者的盐摄入量不受限制。该研究得到了医院伦理委员会的批准。研究中包括的所有参与者均理解研究目的并签署知情同意书。
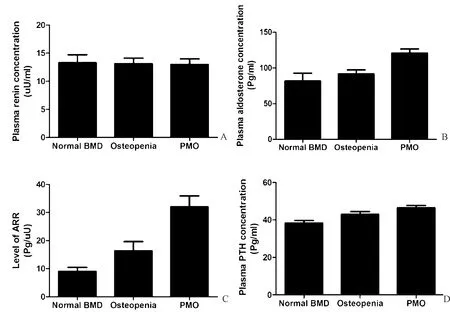
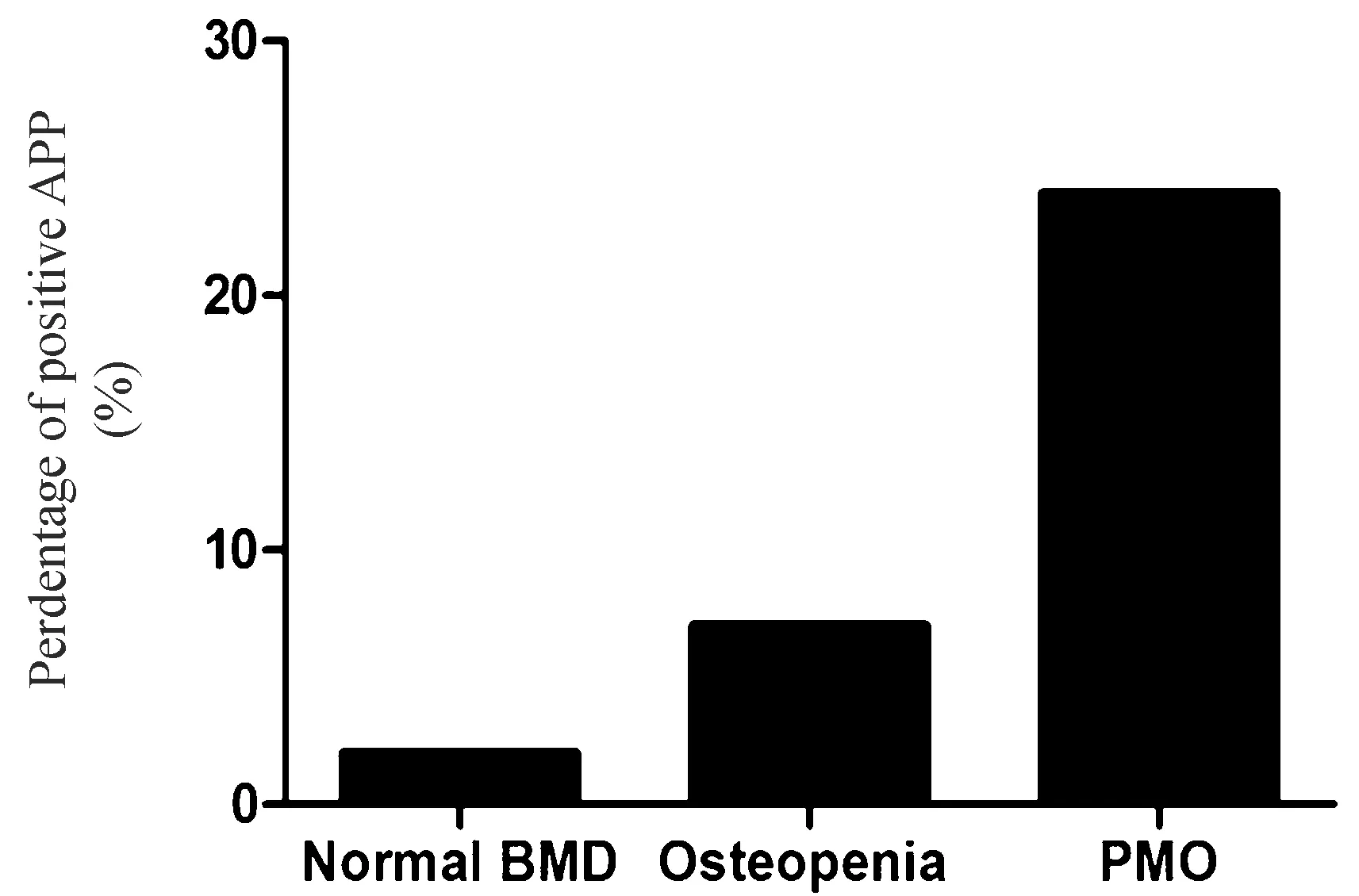
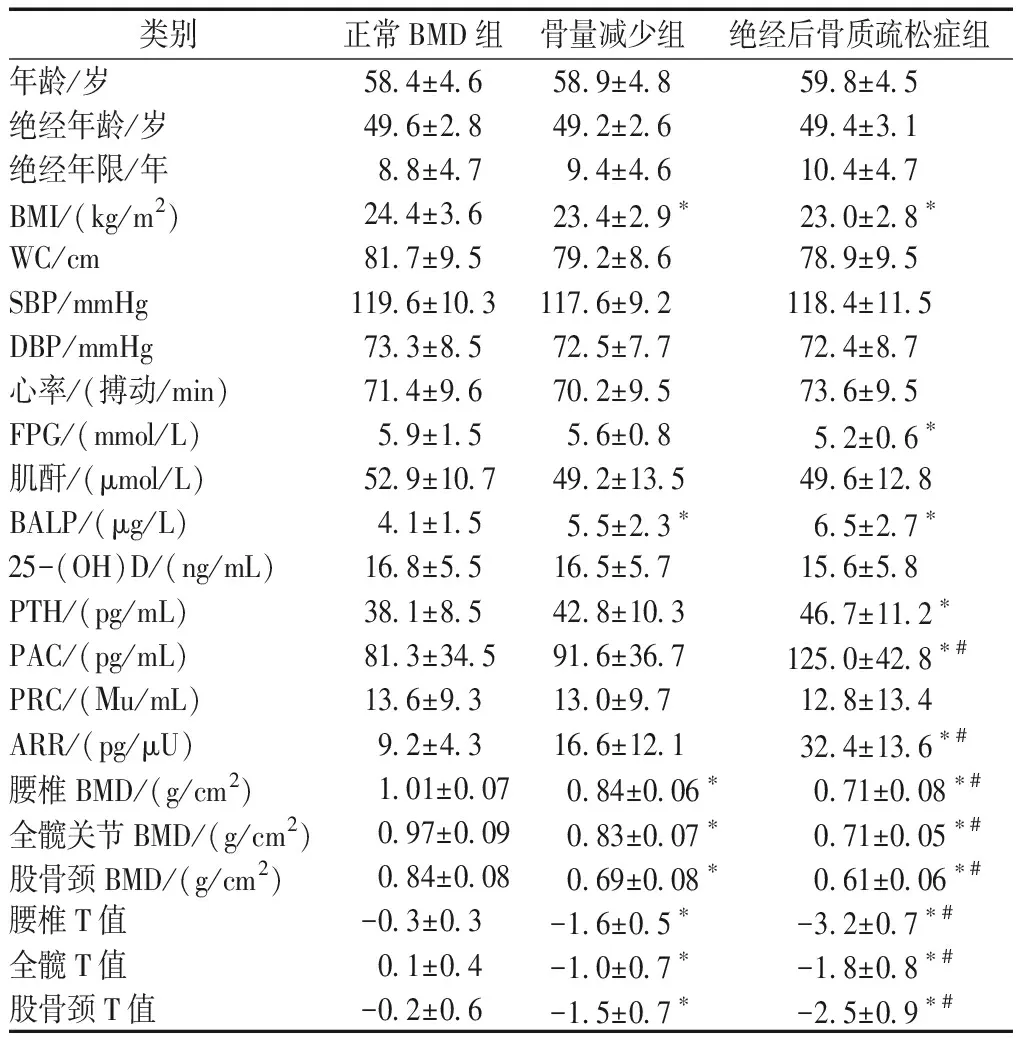
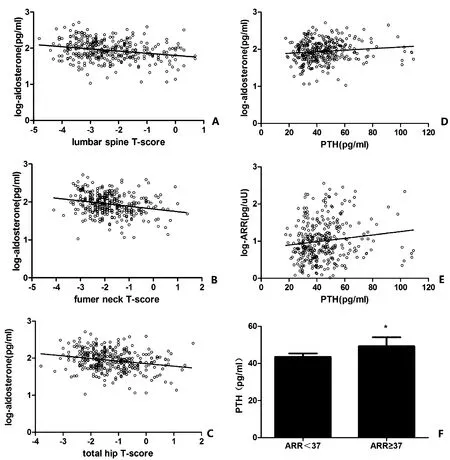
测量并记录血压(坐下10~15 min后两次读数的平均值)和心率。测量人体测量参数,例如身高、体重和腰围。BMD由DXA确定,其在髋部(股骨颈和全髋部区域)和腰椎(L1-L4)区域进行。根据腰椎、全髋或股骨颈的临床特征和BMD T评分,将受试者分为3组:PMO(BMD T评分≤-2.5)组、骨质减少组(Osteopenia,-2.5 抽取血样用于在试验前和抑制试验后2 h测量PRC和PAC,患者在此期间保持安静坐位。 PAC抑制率低于30%被认为是阳性[7]。通过化学发光免疫测定法(DiaSorin,Liaison,Italy)测量PAC和PRC。对于PAC,批间变异系数为5.8和10.5%,批内变异系数为2.1和4.2%。PRC的批间变异系数为2.9和12.8%,批内变异系数为1.2和3.7%。通过化学发光免疫测定法测量PTH、BALP、25-(OH)D。通过葡萄糖氧化酶法测量FPG。通过肌酸氧化酶法测量血清肌酐水平。受试者的BMD由经过培训的技术人员使用DXA Hologic扫描仪(Hologic Discovery QDR系列,Bedford,MA,USA)测量,并且根据先前的研究步骤[10]进行检测。 SPSS 19.0软件用于分析所有数据。Kolmogorov-Smirnov检验用于检验连续变量的分布正态性,并且通过对数变换分析非正态分布变量。计数数据均予以均数±标准差表示。对于多组间的比较,通过具有LSD测试的单向ANOVA进行分析。分类变量使用频率和比例表示,卡方检验用于比较组间差异。Pearson相关分析和线性回归模型用于确定BMD和RAAS相关参数之间的关系。Graphpad Prism 6用于制作文章柱状图。P<0.05表示差异有统计学意义。 本研究共纳入了300名绝经后妇女,其中170名患有骨质疏松症,90名患有骨质减少,40名BMD正常。表1中描述了参与者的特征。3组中年龄、绝经年龄、绝经年数、血压、心率、肌酐和25-(OH)D相当。与其他两组相比,骨质疏松组的腰椎、全髋和股骨颈的BMD T评分显著降低。随着BMD降低,BALP和PTH显著增加(P<0.05),见表1。 PRC在3组之间没有差异(图1)。然而,随着BMD降低,PAC和ARR增加(表1,图1)。使用ARR≥37.0 pg/μU作为阳性筛查的截止值,300名受试者中53名具有阳性ARR。进一步进行卡托普利抑制试验,显示血浆醛固酮的正常抑制状态。ARR的假阳性率在正常BMD组中为2.5%(1/40),在骨量减少组中为8.8%(8/90),在骨质疏松组中为25.9%(44/170)(图2)。随着BMD降低,血清PTH增加(图1)。 图1 具有正常BMD、骨质减少和绝经后骨质疏松症的绝经后妇女中PRC(A)、醛固酮(B)、ARR(C)和PTH(D)的浓度比较Fig.1 Concentrations of PRC (A), aldosterone (B), ARR (C), and PTH (D) in postmenopausal women with normal BMD, osteopenia, and postmenopausal osteoporosis (PMO) 图2 使用ARR≥37.0 pg/μU作为阳性筛查的临界值,每组ARR阳性的女性百分比Fig.2 Percentage of women with positive ARR in each group using ARR≥ 37.0pg/μU as the cutoff for positive screening PAC与所有受试者的腰椎BMD T评分(r=-0.223,P<0.001,图3 A)、股骨颈BMD T评分(r=-0.217,P<0.001,图3B)和全髋BMD T评分(r=-0.227,P<0.001,图3C)呈负相关。此外,PACH与PT (r=0.124,P<0.05,图3D)和ARR(r=0.134,P<0.05,图3E)呈正相关,但与腰椎BMD T评分(r=-0.122,P<0.05)和股骨颈BMD T评分(r=-0.113,P<0.05)呈负相关。采用包括血清PTH水平作为因变量的模型的多元线性回归分析显示,在调整年龄、BMI、腰围、收缩压、FPG和肌酐水平后,PAC仍与PTH (β=0.115,P均<0.05)或ARR(β=0.134,P<0.05)相关。此外,与具有正常ARR的受试者相比,具有阳性ARR的受试者显示出更高的PTH水平(P<0.05,图3F)。 表1 研究人群的特征Table 1 Characteristics of the study population 注:和正常BMD组比较,*P<0.05;和骨质减少组比较,#P<0.05。 图3 醛固酮浓度(对数变换)和腰椎T-评分(A)、股骨颈T-评分(B)和全髋T评分(C)之间的关系;PTH浓度与血浆醛固酮浓度(D)、ARR水平(E)之间的关联;阳性ARR亚组与正常ARR亚组(F)的PTH水平比较(*P<0.05)Fig.3 Associations between aldosterone concentration (log-transferred) and lumbar spine T-score (A), femur neck T-score (B) and total hip T-score (C); Associations between PTH concentration and plasma aldosterone concentration (D) and ARR level (E); Comparison of PTH levels between positive ARR subgroup and normal ARR subgroup (F)(*P<0.05) 本研究发现PMO与ARR升高有关。本研究表明血压正常的绝经后妇女的骨密度降低,PAC和ARR增加;25.9%的PMO女性患有假阳性ARR,远高于骨质减少和BMD正常的女性;PTH与PAC和ARR呈正相关,与BMD呈负相关,PMO对PAC和ARR的影响可能与PTH有关。 ARR被推荐作为PA的有用筛查试验,但它受许多因素的影响,包括年龄、性别、月经周期、一些药物等。确定ARR的潜在混杂因素对PA诊断很重要。根据目前的研究显示,绝经后妇女中存在大量PMO可能是PA筛查的候选人。本研究显示,PMO女性的PAC和ARR高于BMD正常或骨量减少的女性。ARR的百分比从BMD正常女性的2.5%上升到骨质减少女性的8.8%和PMO女性的25.9%,这表明在筛查PA期间假阳性的风险增加。PTH刺激骨形成和骨重吸收,并且可以导致骨量增加或减少,这取决于给药方式。在对健康志愿者的研究中,PTH使用导致尿中四氢醛酮(醛固酮的代谢产物)水平升高;此外,在肾上腺中发现了1型PTH受体[11]。一些实验研究表明,PTH以剂量依赖的方式刺激肾上腺肾小球细胞分泌醛固酮与血管紧张素II;进一步研究发现血清PTH和ARR之间存在正相关[12]。 在原发性甲状旁腺功能亢进患者中,血清PTH水平是醛固酮水平升高的独立危险因素[12]。本研究结果与那些关注醛固酮和PTH之间关联的研究是一致的。然而,一项研究发现PTH在体外直接刺激肾素[13],但在先前的人体研究或本研究中未发现PTH与肾素之间的关联。据报道,25-(OH)D与肾素活性和血管紧张素II的循环水平呈负相关,并且发现1,25(OH)2D受体复合物在体外抑制肾素表达[13]。在肥胖高血压患者中,输注血管紧张素II后,维生素D3补充后血清醛固酮增加更多[14]。但维生素D是否直接影响醛固酮尚不清楚。在本研究中,没有观察到25-(OH)D与PAC或ARR之间的关系。维生素D似乎没有归因于骨质疏松症对ARR的影响。总之,醛固酮和BMD之间的关系可以通过两个方面来说明。一方面,骨密度降低(包括骨质疏松症和骨质减少)的受试者通常伴有不规则的PTH分泌,这可能导致醛固酮升高。另一方面,PAC升高可能导致骨代谢功能障碍,导致BMD降低。一项基于人群的前瞻性队列研究表明,与原发性高血压患者相比,PA患者与骨折风险较高密切相关[15]。此外,另一项前瞻性研究显示,经手术或螺内酯治疗后,PA患者的BMD显著增加[16]。这些数据表明,较高水平的PAC可能导致骨质流失和BMD降低。 本研究存在一些局限性。首先,本研究是一个相对较小的样本。然而,即使在300名参与者中,BMD和ARR之间的关联也很显著。其次,ARR的测量仅在患有PMO的血压正常的女性中进行,而不是在患有骨质疏松症的高血压患者中进行,因此,应该在高血压患者中验证增加的假阳性结果。第三,因为本研究没有使用随机抽样方法,所以选择偏差是不可避免的。此外,未收集24 h尿样,因此,未测定24 h钠排泄和24 h钙尿。总之,PMO患者PAC和ARR显著升高;因此,在解释PMO女性的ARR阳性时应该谨慎。由于ARR的病例检测是针对高血压患者的,如果在高血压患者中验证增加的假阳性结果,则可能需要针对PMO患者的病例检测的ARR的不同截止值。此外,PMO与PAC和ARR之间的相关性可能与PTH有关,需要进一步研究。1.2 统计学处理
2 结果
3 讨论

