精浆AMH水平对非梗阻性无精症的临床预测价值
段丽 陈艺 杨帆


[摘要] 目的 探討抗缪勒管激素(AMH)水平对非梗阻性无精子症(NOA)的临床预测价值。 方法 釆用酶联免疫法和电化学发光免疫分析法检测NOA患者精浆AMH、血清促卵泡激素(FSH)以及睾酮(T)的浓度;B超检测其睾丸体积;通过睾丸显微取精术(M-TESE)检获精子;同时设置对照组,并进行统计学分析。 结果 NOA组的AMH浓度分别低于OA组[(19.53±9.13)pmol/L,(52.34±15.13)pmol/L,P<0.05]及NF组[(158.53±37.45)pmol/L,P<0.05];NOA组的FSH浓度分别高于OA组[(18.36±8.95)U/L,(5.51±3.32)U/L,P<0.05]及NF组[(6.12±3.02)U/L,P<0.05];NOA患者的睾酮浓度[(15.32±5.43)nmol/L]分别与OA组[(15.63±6.23)nmol/L]、NF组[(15.81±5.73)nmol/L]比较无显著性差异(P>0.05,P>0.05);NOA组左右睾丸体积TV[(9.58±3.83)mL,(7.46±3.57)mL]分别与OA组[(16.97±2.56)mL,(15.32±3.63)mL]、NF组[(16.23±3.53)mL,(16.84±2.83)mL]存在显著性差异(P<0.05,P<0.05)。NOA组有10人检获精子,OA组19人检获精子(P<0.05)。Logistic回归分析检验发现AMH预测NOA 患者睾丸内是否存在精子的拟合优度最佳(Wald χ2=26.198,P<0.01);ROC曲线图显示精浆AMH的AUC值最大;精浆AMH的阳性似然比为7.36[81.82%/(1-88.89%)],阴性似然比为0.20[(1-81.82%)/88.89%]。 结论 精浆AMH 浓度对于预测NOA 患者M-TESE成功与否具有重要的意义。
[关键词] 非梗阻性无精症;抗缪勒管激素;睾丸显微取精术;精子检获
[中图分类号] R446.6 [文献标识码] A [文章编号] 1673-9701(2019)31-0001-04
Clinical predictive value of seminal plasma AMH level for non-obstructive azoospermia
DUAN Li1, 2 CHEN Yi2 YANG Fan2 DU Dan2 WANG Kegeng1 LU Siyu3 SHEN Wentao4 LIU Yan1
1.Institute of Pathogenic Biology, Hengyang Medical College, Nanhua University, Hengyang 421001, China; 2.Chenzhou First People's Hospital, Chenzhou 423000, China; 3.School of Nursing, Nanhua University, Hengyang 421001, China; 4.Huilongshan Town Health Center of Tuanfeng County in Huibei Province, Tuanfeng 438800, China
[Abstract] Objective To evaluate the clinical predictive value of anti-Mullerian hormone(AMH) level for non-obstructive azoospermia(NOA). Methods Enzyme-linked immunosorbent assay and electrochemiluminescence immunoassay were used to detect the concentration of seminal plasma AMH, serum follicle stimulating hormone (FSH) and testosterone (T) in NOA patients. B-ultrasound was used to test testicular volume. And Sperm was acquired by M-TESE. The control group was set up at the same time and statistical analysis was performed. Results The AMH concentration (19.53±9.13) pmol/L in the NOA group was lower than that in the OA group (52.34±15.13) pmol/L and that in the NF group (158.53±37.45) pmol/L, P<0.05. The FSH concentration (18.36±8.95) U/L in the NOA group was higher than that in the OA group (5.51±3.32) U/L and that in the NF group (6.12±3.02) U/L, P<0.05. The testosterone concentration in NOA patients (15.32±5.43) nmol/L was not significantly different from that of OA group (15.63±6.23)nmol/L and NF group (15.81±5.73)nmol/L, P>0.05. The left and right testicular volume TV in the NOA group was(9.58±3.83)mL and(7.46±3.57)mL, which was significantly different from that in the OA group (16.97±2.56)mL and (15.32±3.63) mL, and that in the NF group(16.23±3.53)mL and(16.84±2.83)mL, P<0.05. Sperm was detected in 10 patients in the NOA group and 19 in the OA group (P<0.05). Logistic regression analysis showed that AMH predicted the best fit of sperm in the testis of NOA patients (Wald χ2=26.198, P<0.01).ROC curve showed the AUC value of seminal plasma AMH was the highest. The positive likelihood ratio of the seminal plasma AMH was 7.36(81.82%/(1-88.89%)),and the negative likelihood ratio was 0.20 (1-81.82%)/88.89%). Conclusion The concentration of seminal plasma AMH is important for predicting whether the success of M-TESE in patients with NOA or not.
[Key words] Non-obstructive azoospermia; Anti-Mullerian hormone; Microdissection testicular sperm extraction; Sperm acquisition
无精子症(Azoospermia)是男性不育的主要原因,是指连续3次精液及射精后的尿液在3000 g以上的离心标本离心15 min后,沉渣镜检未发现精子[1]。无精子症分非梗阻性无精子症(non-obstructive azoospermia,NOA)和梗阻性无精子症(obstructive azoospermia,OA)两大类,可通过激素水平和睾丸大小进行鉴别[2]。随着现代医学的发展,部分NOA患者可通过睾丸显微取精术(Micro-testicular sperm extraction,M-TESE)获取精子进行试管婴儿生育[3],但M-TESE创伤大、并发症多,因此研究无创预测睾丸穿刺取精获得精子的指标具有重要意义。本研究选择某院20例NOA患者的临床资料,分析生殖激素水平与睾丸大小等参数对M-TESE结果的预测价值,以期为NOA患者是否需要接受外科手术治疗提供临床依据,现报道如下。
1 资料与方法
1.1 一般资料
依据世界卫生组织标准,选取2015年1月~2018年12月期间在某院生殖中心不育门诊就诊的不育患者。在获得NOA患者知情同意后,收集其精浆和血清作为研究样本,同时设置梗阻性无精症OA患者和正常生育(normal fertility,NF)者为对照组。每组选取20例。NOA组20例,为各种睾丸生精功能不足而核型正常的NOA患者,包括原因不明的NOA患者15例,睾丸接受放化疗者1例,隐睾症者1例,精索静脉曲张者3例,平均年龄(33.82±5.69)岁。OA组共20例,包括输精管切除术者5例、输精管梗阻者10例和射精管梗阻者5例,平均年龄(33.82±5.69)岁。三组受试对象的年龄比较,差异无统计学意义(P>0.05)。
1.2 仪器与试剂
ELx-800型酶标仪(美国宝特,BIO-TEK),ELx-50型洗板机(BIO-TEK)均由上海新波生物技术有限公司提供;全自动电化学发光免疫分析仪(Roche HITACHI cobas 6000)由德国罗氏诊断产品(Roche Diagnostics GmbH)上海有限公司提供;体视镜(SMZ800)为日本Nikon公司产品,倒置显微镜(CKX53)为日本Olympus公司产品。B超(Logiq E9)为美国GE(General Electric Company)产品。抗缪勒管激素(anti-mullerian hormone,AMH)、促卵泡激素(follicle-stimulating hormone,FSH)检测试剂盒和睾酮(testosterone,T)检测试剂盒等均购于罗氏上海有限公司。
1.3 检测方法
1.3.1 血清促卵泡激素及睾酮的检测 待检者空腹,常规于前臂浅静脉处抽取5 mL血样,分离血清后,2 h内检测其血清促卵泡激素及睾酮的浓度。FSH浓度检测:选择罗氏Roche HITACHI型电化学发光全自动免疫分析系统及配套FSH浓度检测试剂盒,FSH的最低检测限为0.10 IU/L。根据试剂盒说明,将离心处理后的血液样本置于标本槽内,采用电化学发光免疫分析法(Electrochemiluminescent immunoassay,ECLIA)双份测定FSH水平。睾酮T浓度检测:选择配套睾酮T浓度检测试剂盒,T的最低检测限为0.14 nmol/L。根据试剂盒说明,将离心处理后的血液样本置于标本槽内,ECLIA双份测定T水平。
1.3.2 精漿中所含抗缪勒管激素浓度的检测 待检者均在釆集精液前一周停止性生活,手淫采集精液[4],置于无菌容器中37℃水浴30 min液化;1 h内取3~5 mL液化精液样本,离心5 min后置于-80 ℃贮藏备用,保存期限1个月。AMH浓度检测:选择Roche公司提供的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)双份重复测定,AMH的最低检测限为3.2 pmol/L。根据试剂盒的说明进行。将试剂盒置室温平衡30 min后使用,冻存样本复融后应经过充分的混匀。样品孔先加入样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释5倍)。设置对照组,轻轻振荡混匀后封板膜封板,37℃温育30 min;每孔加酶标试剂50 μL,轻轻振荡混匀后封板膜封板,37℃温育30 min后,洗板5遍,扣干;每孔加入显色剂A、B液各50 μL,轻振荡混匀,37 ℃避光显色15 min;每孔加终止液50 μL,轻振荡混匀;设定酶标仪波长于450 nm处,空白孔调零后,15 min内测定各孔OD值。以标准物的浓度和OD值分别为横坐标和纵坐标,绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度,再乘以稀释倍数即为样品的实际浓度。
1.3.3 B超检测睾丸体积 运用B超仪高频探头9~15 Mz进行测量,具体数据以公式为准,睾丸的体积=睾丸的前后直径×左右直径×上下直径×0.71。
1.3.4 睾丸显微取精术 取较大侧睾丸,常规消毒皮肤并麻醉后,通过显微镜放大足够倍数(通常20倍左右)后,切开至睾丸白膜,避开白膜下血管,睾丸中部切开白膜0.5~1.0 cm,用外科剪刀切开并分离,获取含有饱满不透明的曲细精管睾丸组织25~50 mg,将睾丸组织送检。剪取外观饱满、乳白色半透明或不透明、相对粗大并有张力的生精小管,体视镜下取出后置于Falcon 3001培养皿Gemete培养液(Irvine scientific,santa anna,CA,美国)中立即用注射针头撕裂研磨,倒置显微镜下查找精子。
1.4 参数计算方法
灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%,特异度=真阴性人数/(真阴性人数+假阳性人数)×100%,阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%,阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%,阳性似然比=灵敏度/(1-特异度);阴性似然比=(1-灵敏度)/特异度。
1.5 统计学方法
采用SPSS 18.0统计学软件分别进行组间统计学分析,计数资料用率(%)表示,采用χ2检验;计量资料用均数±标准差(x±s)表示,采用方差分析后采用Student-t检验,以P<0.05为差异有统计学意义。通过Logistic回归分析,筛选出与患者行睾丸穿刺活检发现精子相关程度较高的指标。应用Microsoft Excel 2013绘制受试者工作特征曲线(receiver operating curve,ROC)图[5],根据ROC曲线下的面积(area under the curve,AUC)来判断监测方法的优劣[6]。
2 结果
2.1 三组生殖激素水平、睾丸体积及有精子人数比较
NOA组的FSH浓度[(18.36±8.95)U/L]分别高于OA组[(5.51±3.32)U/L]及NF组[(6.12±3.02)U/L],差异有统计学意义(P<0.05)。NOA组的睾酮浓度[(15.32±5.43)nmol/L]分别与OA组[(15.63±6.23)nmol/L]、NF组[(15.81±5.73)nmol/L]比较,差异无统计学意义(P>0.05)。NOA组的AMH檢测值[(19.53±9.13)pmol/L]分别低于OA组[(52.34±15.13)pmol/L]及NF组[(158.53±37.45)pmol/L],差异有统计学意义(P<0.05)。B超检测睾丸体积(TV),NOA组左右两侧TV[(9.58±3.83)mL,(7.46±3.57)mL]分别小于OA组[(16.97±2.56)mL和(15.32±3.63)mL]及NF组[(16.23±3.53)mL和(16.84±2.83)mL],差异有统计学意义(P<0.05)。NOA组患者检获精子人数(10/20)低于OA组(19/20),差异有统计学意义(P<0.05)。见表1。
2.2 数据分析
2.2.1 各指标拟合度分析 采用Logistic回归分析发现:AMH对预测NOA患者睾丸内是否存在精子的拟合优度最佳(Wald χ2=26.198,P<0.05),优势比(Odds Ratio,OR)最高,为8.384;其次为FSH(Wald χ2=21.492,P<0.05),再者为睾丸体积(Wald χ2=20.934,P<0.05),T参数在回归分析模型中拟合度不佳,OR值最低。见表2。
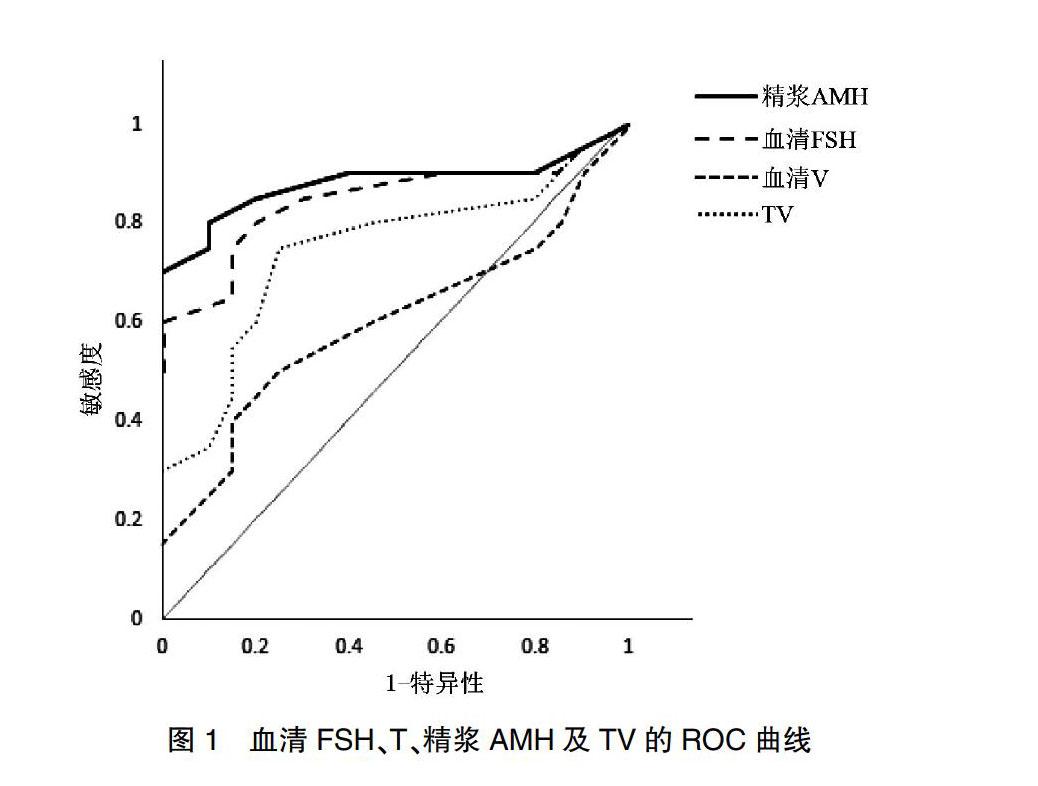
2.2.2 各指标的ROC曲线 以睾丸穿刺结果为状态变量,分别以生殖激素水平和睾丸体积及相关参数为检验变量,利用Microsoft Excel 2013绘制ROC曲线图(图1),由图1可见,精浆AMH的AUC值最大(0.87)。
2.3 各项指标预测睾丸组织活检有无精子的价值
以睾丸穿刺结果为“金标准”,20例NOA患者中有11例可在精浆中检出AMH,其中9例在睾丸组织活检中发现精子,阈值(Cut-off值)≥10.58 pmol/L;精浆检测不出AMH的患者有9例,其中8例组织活检无精子。精浆AMH的灵敏度是81.82%[9/(9+2)],特异度是88.89%[8/(8+1)];阳性预测值为90.00%[9/(9+1)],阴性预测值为80.00%[8/(8+2)];阳性似然比为7.36[81.82%/(1-88.89%)],阴性似然比为0.20](1-81.82%)/88.89%]。见表3。
3 讨论
随着人类辅助生殖技术的产生和不断进步发展,临床上出现了单精子卵胞浆显微注射术(Intracytoplasmic sperm injection,ICSI),使用显微操作技术将精子注射到卵细胞胞浆内,受精后体外培养到早期胚胎,再放回母体子宫内发育着床;因此即便是NOA患者,也可通过利用ICSI进行生育[7]。在临床实践中发现,有45%左右的NOA患者,经过多次重复的睾丸显微取精术(M-TESE),会促使睾丸产生精子量提升,从而保证ICSI的顺利进行[8]。但M-TESE创伤大、并发症多,同时要配合女性的取卵术。多次重复的外科手术诊断和治疗,给患者夫妻的经济和心理都带来巨大的影响[9,10]。因此,研究无创预测M-TESE获得精子的指标具有重要意义。
血清FSH的浓度在长时间内一直被认为是有效的无精子症标志物,如果FSH水平上升,表明精子生成障碍[11,12];然而随着M-TESE使用率越来越广泛,部分无精子症患者也可通过活检获得精子,因此血清FSH不再被认为是一个明确的无精子症的标志物[13]。
精浆AMH来源于睾丸,当人进入青春期以后,AMH会从睾丸支持细胞的最顶端逐步向周围曲细精管腔内分泌,这种现象可能与青春期睾丸开始发挥作用有关:在生精上皮特定的周期阶段,精浆内AMH的分泌增强,和精子的生成有一定的关系;即便在输精管切除术后,仍然可以在精浆中检测到AMH[14]。因此,患者精浆AMH可以理解为患者生殖系统细胞缺乏症的标志物,用于判断患者是否完全缺乏精子,AMH检测是针对NOA患者的一种无创性的检测。
在本研究中,发现NOA患者精浆AMH浓度、血清FSH浓度及睾丸大小较OA患者及正常人均有显著性差异,说明这三者与患者生精功能障碍有直接的关系,与精子的成功生成有一定的关联。Logistic回归分析发现AMH对预测NOA患者睾丸内是否存在精子的拟合优度最佳,ROC曲线图显示精浆AMH的AUC值最大,由此可见,较之血清FSH浓度及睾丸体积,精浆AMH浓度与睾丸显微取精术的成功率有更大的关联性。
阳性似然比、阴性似然比结合了敏感性、特异性、阳性预测值和阴性预测值的优点,既可以根据患者有无某项报警症状来做预测,同时又不受被检人群中病变发生率的影响,可用于多种临床环境中,因此是一个相对独立的、更具临床意义的诊断性试验效果的评估指标[15]。当阳性似然比>10或阴性似然比<0.1时,诊断或排除某种疾病的可能性就显著增加。在本项研究中,AMH浓度的似然比更加接近理想值。
由此可见,与血清FSH、T浓度和TV等经典的精子生成预测指标相比,NOA患者的精浆AMH浓度,预测M-TESE成功与否的诊断效率更高。精浆AMH浓度作为一种非侵入性持久的精子发生过少的标志物,可在ICSI术前预示睾丸精子数量恢复成功的可能性,在临床实践中具有一定的应用价值。
[参考文献]
[1] Vij SC,Sabanegh E JR,Agarwal A.Biological therapy for non-obstructive azoospermia[J].Expert Opin Biol Ther,2018,18(1):19-23.
[2] Huang IS,Huang WJ,Lin AT. Distinguishing non-obstructive azoospermia from obstructive azoospermia in Taiwanese patients by hormone profile and testis size[J].J Chin Med Assoc,2018,81(6):531-535.
[3] Ran R,Kohn TP,Ramasamy R. Innovations in surgical management of nonobstructive azoospermia[J].Indian J Urol,2016,32(1):15-20.
[4] 劉伯龙,王娟花,唐正,等.解脲支原体感染对不育男性精液质量及生育能力的影响[J].中南医学科学杂志,2016,44(4):421-424.
[5] 杨浏,黎增文.用Excel制作ROC曲线[J].现代检验医学杂志,2005,20(4):81-82.
[6] Bandos AI,Guo B,Gur D.Jackknife variance of the partial area under the empirical receiver operating characteristic curve[J].Stat Methods Med Res,2017,26(2):528-541.
[7] Rosenwaks Z,Pereira N.The pioneering of intracytoplasmic sperm injection:Historical perspectives[J]. Reproduction,2017,154(6):F71-F77.
[8] Hibi H,Sumitomo M,Fukunaga N,et al. Superior clinical pregnancy rates after microsurgical epididymal sperm aspiration[J]. Reprod Med Biol,2017,17(1):59-63.
[9] 唐金鑫,宋乐彬,秦超.睾丸显微取精术在非梗阻性无精子症中的应用[J].中华男科学杂志,2016,22(8):730-734.
[10] 张靖,梁晓燕,刘贵华.睾丸显微取精术的应用与提高[J].临床外科杂志,2018,26(2):88-90.
[11] 毛金观,金玉霞.无精子症、严重少精子症睾丸容积与血FSH和AZF基因微缺失的相关性分析[J].中国优生与遗传杂志,2017,25(5):26-27.
[12] 李芃,许蓬,宋世威,等.FSH治疗特发性非梗阻性无精子症的疗效分析(附15例报告)[J].生殖医学杂志,2019, 28(2):192-194.
[13] Hussein A,Ozgok Y,Ross L,et al. Optimization of spermatogenesis-regulating hormones in patients with non-obstructive azoospermia and its impact on sperm retrieval:A multicentre study[J].BJU Int,2013,111(3):110-114.
[14] Alfano M,Ventimiglia E,Locatelli I,et al.Anti-mullerian hormone-to-testosterone ratio is predictive of positive sperm retrieval in men with idiopathic non-obstructive azoospermia[J]. Sci Rep,2017,7(1):17638.
[15] Egeland T,Slooten K. The likelihood ratio as a random variable for linked markers in kinship analysis[J]. Int J Legal Med,2016,130(6):1445-1456.
(收稿日期:2019-07-12)

