南海鸢乌贼中型群雌性个体肌肉和性腺组织能量积累及其分配
朱 凯,孙程婕,陈新军,2,3,林东明,2,3,刘海涛,古 昊
(1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海 201306)
鸢乌贼(Sthenoteuthis oualaniensis)为大洋性暖水种,隶属于鞘亚纲(Coleoidea),枪形目(Teuthoidea),柔鱼科(Ommastrephidae),分布于印度洋、太平洋的赤道和亚热带等海域[1]。类似于其他头足类,鸢乌贼具有生命周期短、生长速度快等生活史特点[2],其世代更新速度快、生物资源量丰富,是世界重要的经济性头足类之一[4]。鸢乌贼主要的作业渔场有琉球群岛渔场、中国台湾以西渔场、亚丁湾渔场和印度洋西北海域渔场等[4]。近年来,资源量可观的鸢乌贼在我国南海也被发现[5],并且针对该资源的捕捞业发展迅速,已经成为该海域最具开发潜力的捕捞对象之一[6]。鸢乌贼在我国南海海域的海洋食物链中扮演着重要角色,在食物网中具有重要生态地位,既是小型游泳动物的捕食者,同时也被大型鱼类所捕食[7]。已探明的南海海域鸢乌贼包括中型群和微型群两个群体,中型群体型较大且背部具有发光器,微型群体型较小,二者在性腺发育、生长特性以及分布海域等方面具有显著差异[6],且单一群体内部的雌雄性也具有二态性[8],因此在鸢乌贼的研究中将单一群体的单一性别作为研究单位可以得到更加准确的结论。
能量密度(energy denisty)(单位体质量所含能量值)是水生动物生物能量学研究的一个重要内容[9]。在天然条件下,水生动物能量密度既是其自身发育状况、生命进化史及其对外界环境因子适应性反应的直接表现[10],也是衡量身体能量储备水平、繁殖产卵策略的重要指标[11-12]。本研究利用组织能量密度测定法,测定了我国南海鸢乌贼中型群雌性个体胴体等组织的能量密度,计算分析肌肉和性腺组织的绝对和相对组织能量积累及其随着性腺发育的变化规律,旨在初步量化这些个体在不同性腺发育阶段的生殖能量投入与占比,探讨生殖活动过程中的生殖投入类型。本研究不仅可拓展肌肉组织能量分析的内容和生殖投入的来源类型,而且将研究个体划分至群体水平以提升结论的可靠性,以期为完善鸢乌贼不同群体的繁殖策略研究做铺垫,并为其他大洋性柔鱼的相关研究提供参考。
1 材料与方法
1.1 样本来源
鸢乌贼样本来自我国南海灯光罩网船的渔获物,采样海域为 9°11′16″~11°22′55″N、111°15′36″~115°52′12″E,采样时间为 2017年4—6月。期间,进行了8个站位的鸢乌贼样本采集,每个站位平均随机采集样本60尾。采集后的样本置于-20°环境下冷冻保存。
1.2 生物学测定
样本在实验室中进行解冻(常温)并进行生物学测定,共测定分析了鸢乌贼中型群雌性个体82尾,测定的参数主要为胴长(mantle length,ML)、体质量(body weight,BW)、胴体质量(mantle weight,MW)、尾鳍质量(fin weight,FW)、足腕质量(arm weight,AW)、缠卵腺质量(nidamental gland weight,NGW)、输卵管复合体质量(oviducal complex weight,OCW)、卵巢质量(ovary weight,OW)以及性腺成熟度(maturity stage,MAT)。长度和质量数据分别精确至1 mm和0.1 g。性腺成熟度参照林东明等[13]的划分标准,共划分为8个等级,其中Ⅰ、Ⅱ期为性腺未成熟,Ⅲ期为生理性发育期,Ⅳ~Ⅵ期为性腺成熟期,Ⅶ期为排卵期,Ⅷ期为产卵后期。经测定,Ⅰ~Ⅵ期个体数量分别为 24、22、9、13、8、6尾。样本中未发现Ⅶ、Ⅷ期个体。
1.3 组织能量密度测定
使用Parr 6100型氧弹热量仪(Calorimeter Parr 6100)对组织的能量密度进行测定。测定的组织样本包括胴体、尾鳍、足腕、缠卵腺、输卵管复合体和卵巢。按照性腺成熟度Ⅰ~Ⅵ期,进行每个性腺发育时期组织样本的采集,其中胴体组织采自腹部,约5 g左右湿样;足腕组织采自左第4腕足,约3 g左右;尾鳍、缠卵腺、卵巢和输卵管复合体则采取整个组织。各性腺成熟度胴体、足腕和尾鳍组织的能量密度值均进行单独测定,Ⅰ~Ⅵ期测定数量分别为 24、22、9、13、8和 6。因Ⅰ~Ⅲ期个体的性腺组织较小,将其缠卵腺或卵巢组织混合后进行测定,每个时期进行4次测定,Ⅳ~Ⅵ期每个个体的缠卵腺或卵巢组织进行单独测定,Ⅰ ~Ⅵ期测定数量分别为4、4、4、13、8和6;由于输卵管复合体组织发育较晚,因此只取Ⅳ期及以上时期的整个组织并进行每个样本的测定,Ⅳ~Ⅵ期测定数量分别为13、8和6;每个组织称取湿重(wet weight,WeW)后,置入冷冻干燥机(Christ Alpha 1-4/L D plus)干燥至恒重后称取干重(dry weight,DW),组织研磨后装入离心管中备用,研磨机型号为Retsch MM 400。随后,称取一定量的组织干粉,测定组织能量密度(energy density,ED)。湿重和干重测定精确至0.001 g。
1.4 数据处理
组织的绝对能量积累(absolute energy accumulation,AE,单位:kJ)计算公式为:
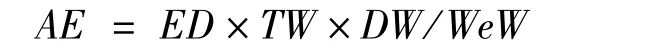
式中,ED为计算组织的能量密度,单位:kJ·g-1;TW为计算组织的总体质量,单位:g;DW为计算组织的干重,单位:g;WeW为计算组织的湿重,单位:g。
假设鸢乌贼中型群雌性个体的总能量等于每个需计算组织的能量之和(total energy,TE)。以此为基准,计算每个组织在不同性腺发育时期的能量积累占比,分析各组织的能量积累变化过程。
每个组织的相对能量积累(relative energy accumulation,RE,单位:%)计算公式为:
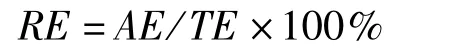
式中,TE为计算个体的总能量,单位:kJ。
对胴体、尾鳍、足腕等3个肌肉组织和总体性腺组织(缠卵腺、输卵管复合体和卵巢)的绝对能量积累与个体胴长(AE-ML)进行ModelⅡ回归分析[14],获得每个组织能量积累的残差值并将其进行标准化。利用残差指标对个体质量特征与生殖投入、能量分配等之间的关系进行分析[15-18]:残差的正、负性分别表征个体质量特征的好与坏。性腺组织能量-胴长残差与肌肉组织能量-胴长残差之间的相关性:正相关关系说明性腺与肌肉组织之间没有能量的传递,负相关关系则说明肌肉组织能量转化用于性腺组织的生长发育[16,19-20]。
1.5 数据分析
利用单因素方差分析(One Way-ANOVA)和Tukey HSD检验方法检验各组织能量密度、组织能量积累和投入分配等在性腺成熟度水平上的差异性,利用Pearson相关性检验法对各组织绝对能量积累之间以及各肌肉组织-胴长残差和性腺组织-胴长残差的相关性进行检验[21]。数据之间的模型拟合采用线性模型。使用Excel 2007和SPSS 18.0软件进行数据处理与分析。
2 结果与分析
2.1 组织能量密度
鸢乌贼中型群雌性个体的胴体、尾鳍、足腕、缠卵腺、输卵管复合体和卵巢的组织能量密度分别为(22.06±1.24)kJ·g-1、(22.50±1.25)kJ·g-1、(22.83±1.13)kJ·g-1、(21.10±0.80)kJ·g-1、(24.33±1.41)kJ·g-1和(21.76±1.32)kJ·g-1(表 1),其中以输卵管复合体组织的能量密度为最大,缠卵腺组织的能量密度为最小(F=14.99,P<0.01)。随着性腺发育,胴体组织的能量密度逐渐增大(F=3.01,P=0.02),差异主要存在于Ⅰ期和Ⅵ期之间(P<0.05);尾鳍、足腕、缠卵腺、输卵管复合体和卵巢等组织的能量密度波动较小,不同性腺成熟度之间没有显著性差异(尾鳍:F=0.79,P=0.57;足腕:F=1.03,P=0.41;缠卵腺:F=0.96,P=0.46;输卵管复合体:F=3.99,P=0.07;卵巢:F=2.20,P=0.08)。
2.2 肌肉、性腺组织能量积累
鸢乌贼中型群雌性个体肌肉组织的绝对能量积累值较性腺组织大。其中,胴体、尾鳍、足腕等肌肉组织的能量积累分别为142.44~783.61 kJ、33.47~181.96 kJ和 51.93~523.05 kJ,平均值分别为(324.52±125.30)kJ、(71.04±31.48)kJ和(168.34±90.77)kJ。缠卵腺、输卵管复合体和卵巢等性腺组织的能量积累分别为0.01~40.93 kJ、0.00~78.63 kJ和 0.11~115.09 kJ,平均值分别为(4.61±9.01)kJ、(6.04±15.36)kJ和(13.84±26.98)kJ。随着性腺发育,肌肉和性腺各组织的能量积累显著增加(ANOVA:胴体,F=13.62,P<0.01;尾鳍,F=12.71,P<0.01;足腕,F=18.23,P<0.01;缠卵腺,F=25.01,P<0.01;输卵管复合体,F=90.29,P<0.01;卵巢,F=69.27,P<0.01),并均在Ⅵ期达到最大值(图1)。其中,在性腺发育过程中,肌肉组织绝对能量的增长呈现波动变化,Ⅳ~Ⅵ期呈现降低的趋势;性腺组织的绝对能量呈现增加的趋势,在性腺发育成熟期增加尤为显著(Tukey HSD:P<0.05)。
同时,性腺发育期间,性腺和肌肉组织的能量积累存在显著性正相关关系(P<0.05;图2)。其中,缠卵腺、输卵管复合体、卵巢等组织能量积累与足腕组织能量积累的相关性较高(缠卵腺,R2=0.66;输卵管复合体,R2=0.50;卵巢,R2=0.57),与尾鳍组织能量积累的相关性次之(缠卵腺,R2=0.57;输卵管复合体,R2=0.40;卵巢,R2=0.44)。

表1 南海鸢乌贼中型群不同组织的能量密度Tab.1 Energy density of different tissues in medium form of female S.oualaniensis in the South China Sea
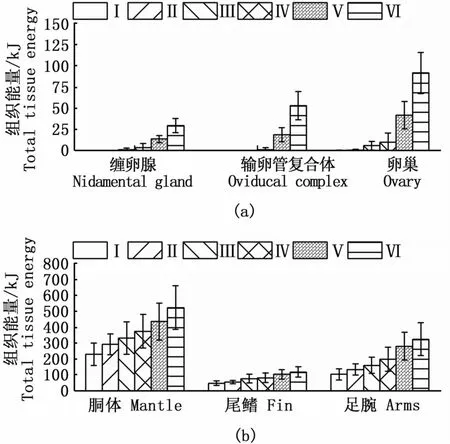
图1 不同性腺成熟度南海鸢乌贼中型群雌性个体性腺组织(a)和肌肉组织(b)的能量积累分布Fig.1 Energy accumulation of gonadal tissues(a)and somatic tissues(b)with sexual maturation in medium form of female S.oualaniensis in the South China Sea
2.3 肌肉、性腺组织相对能量积累
在同一性腺成熟度等级下,肌肉组织的相对能量积累较高,性腺组织则较低。其中,在Ⅰ~Ⅳ期,肌肉组织相对能量积累很高,胴体、尾鳍和足腕组织合计占比保持在97.75%~99.79%;在性腺成熟期(Ⅴ~Ⅵ期),肌肉组织相对能量积累显著下降(P<0.05),在Ⅵ期的合计占比为83.59%(图3)。
随着性腺发育,胴体和尾鳍组织的相对能量积累呈下降趋势,并在不同性腺成熟度等级之间具有统计学差异(胴体:P<0.01;尾鳍:P=0.02),足腕组织的相对能量积累呈上升趋势,但在不同性腺成熟度等级之间没有差异(足腕:P=0.11)。相反,随着性腺发育,缠卵腺、输卵管复合体和卵巢等性腺组织能量的合计占比逐渐增大并具有统计学差异(缠卵腺:P<0.01;输卵管复合体:P<0.01;卵巢:P<0.01),在Ⅵ期时3者相对能量积累最高,分别为 2.62%、4.62%和8.35%。
2.4 肌肉、性腺组织能量分配
ModelⅡ回归分析显示,肌肉和性腺组织的能量积累均与胴长呈显著的相关性,相关系数均大于0.60(表 2)。
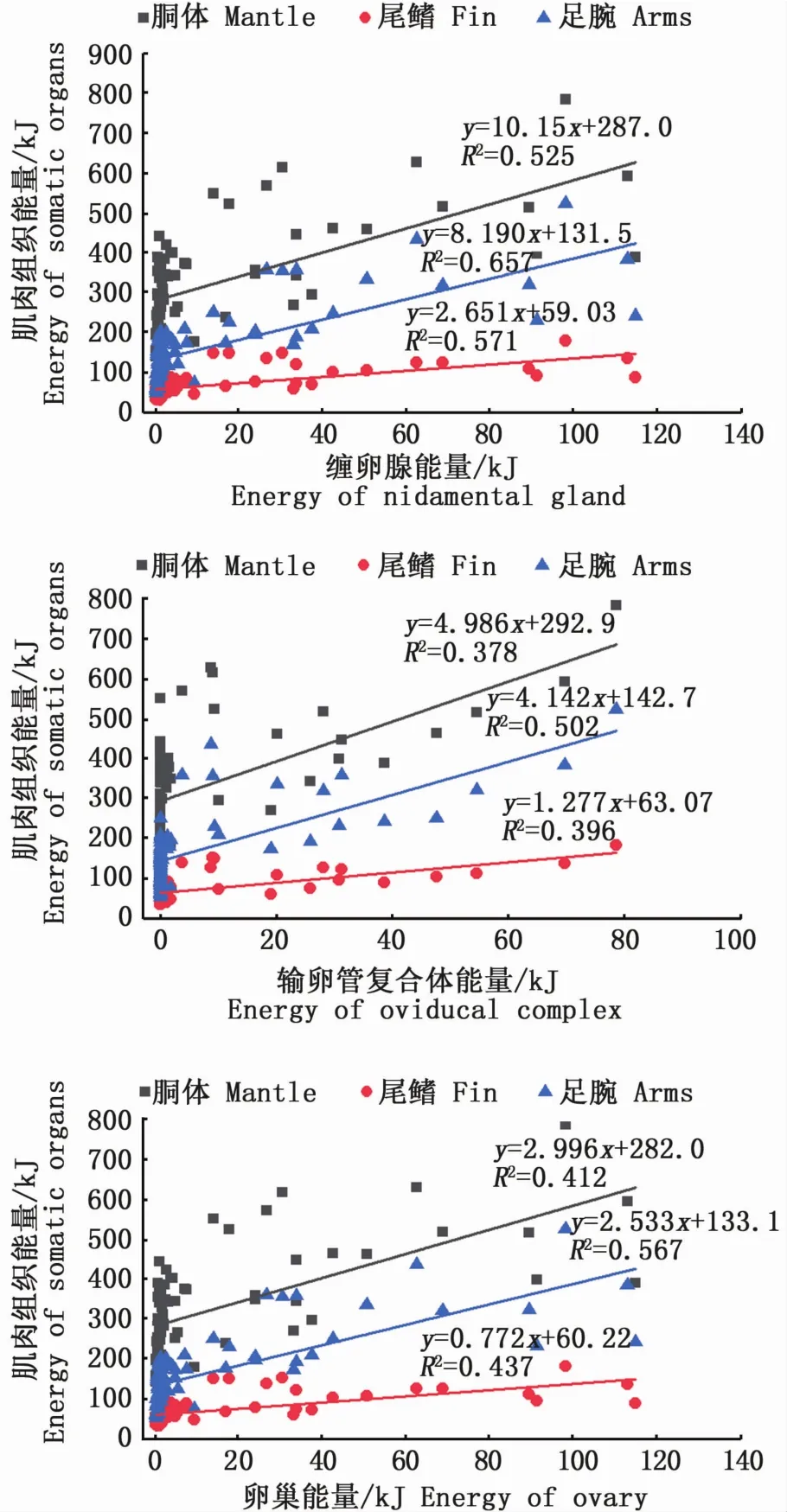
图2 南海鸢乌贼中型群雌性个体性腺组织能量积累和肌肉组织能量积累的关系图Fig.2 Relationships between energy accumulation of gonadal tissues and somatic tissues in medium form of female S.oualaniensis in the South China Sea
组织能量积累与胴长ModelⅡ回归的残差关系显示,性腺组织能量-胴长残差(TiEGo-MLresidual)与肌肉组织能量-胴长残差(TiEMa-MLresidual、TiEAr-MLresidual和TiEFi-MLresidual)之间总体上呈现正相关关系,其中TiEGo-MLresidual与TiEAr-MLresidual之间存在显著相关性(P<0.05)。结果表明,性腺发育过程中,在总体上性腺组织和肌肉组织之间能量的交换并不显著。其中,Ⅰ~Ⅲ期性腺组织能量-胴长残差(TiEGo-MLresidual)与肌肉组织能量-胴长残差(TiEMa-MLresidual、TiEFi-MLresidual和TiEAr-MLresidual)呈线性正相关关系,且TiEGo-MLresidual与TiEFi-MLresidual、TiEAr-MLresidual两者之间的线性关系显著(P<0.05)(图4)。而在Ⅲ~Ⅵ期,TiEGo-MLresidual与肌肉组织能量-胴长残差(TiEMa-MLresidual、TiEFi-MLresidual和TiEAr-MLresidual)呈弱的负相关关系(图4)。结果表明性腺发育前期肌肉组织和性腺组织之间并无能量的转移;而在性腺发育期和性腺成熟期,胴体、尾鳍和足腕等组织则可能将部分能量转化用于性腺组织的生长发育,但这种组织能量转化并不影响肌肉组织的完整性。
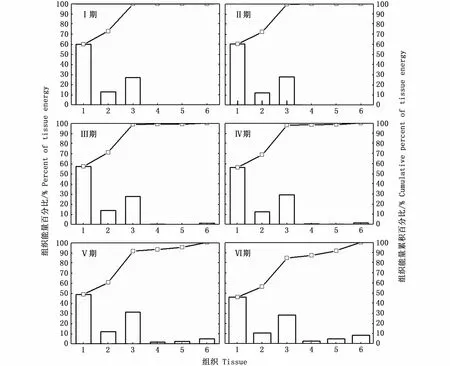
图3 不同性腺成熟度南海鸢乌贼雌性个体肌肉组织和性腺组织能量积累百分比Fig.3 Relative energy accumulation of somatic and gonadal tissues in medium form of female S.oualaniensis in the South China Sea
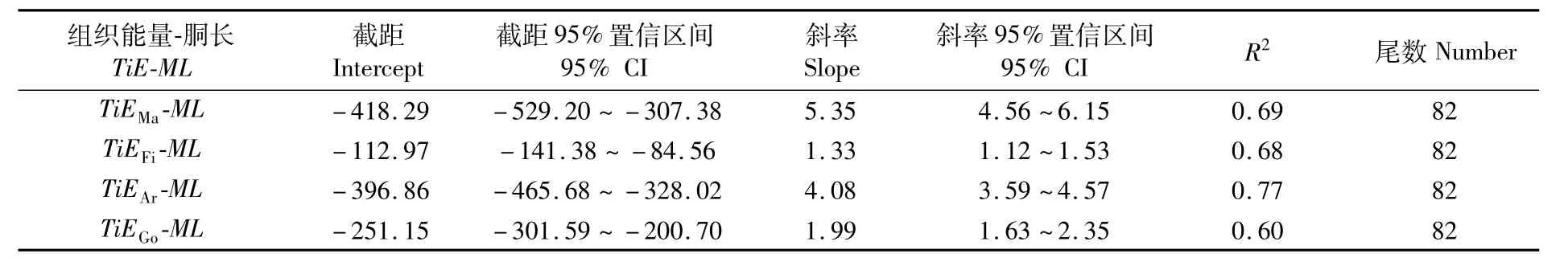
表2 南海鸢乌贼中型群雌性个体胴长与肌肉、性腺等组织能量积累的ModelⅡ回归参数表Tab.2 ModelⅡ regression statistics between mantle length(ML)and energy accumulation of mantle(TiE Ma),fin(TiE Fi),arms(TiE Ar)and gonadal tissues(TiE Go)in medium form of female S.oualaniensis in the South China Sea
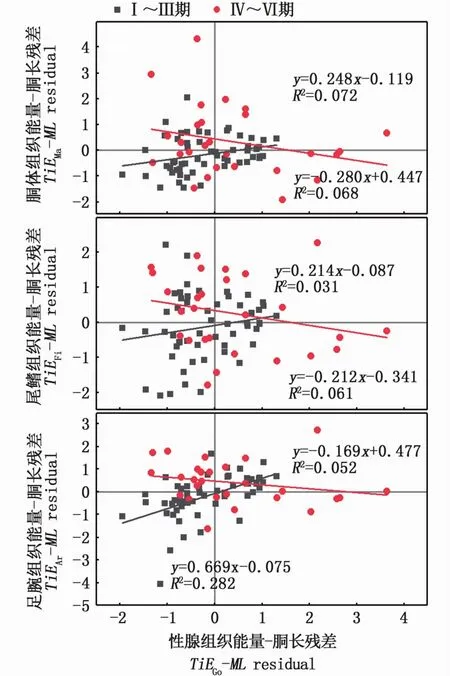
图4 南海鸢乌贼中型群雌性个体组织能量与胴长Model II回归拟合的残差关系图Fig.4 Relationships between residuals calculated from somatic and gonadal tissue energy-mantle length Model II regression equations in medium form of female S.oualaniensis in the South China Sea
3 讨论
3.1 组织能量密度
水生生物作为水生生态系统的重要组成部分,能量密度反映了相同质量的组织中所含能量的高低,是生物体内储备能量的基础衡量指标,也是这些生物在其生活过程中营养富集和生长状况的评价标准,可为探讨它们适应各种自然环境变化的营养动力学过程提供基础资料[9,12,21-22]。本研究表明,南海鸢乌贼中型群雌性个体部分组织间的能量密度具有显著性差异。组织能量密度是由其营养成分所决定,其差异反映了鸢乌贼中型群雌性个体不同组织之间的营养成分组成存在差异,这与其他学者的研究结果类似,于刚等[23]、邱月等[24]曾报道南海鸢乌贼胴体和足腕组织的蛋白和粗脂肪含量具有一定的差异。在其他种诸如虎斑乌贼(Sepia pharaonis)[25]、金乌贼(Sepia esculenta)[26]等的研究中也发现性腺组织的蛋白质含量要显著高于其他组织。这些研究表明头足类不同组织在营养成分上的差异均可导致其能量密度的不同,也因此反映出各组织的能量(营养成分)分配的差异,即鸢乌贼本身对于体细胞生长、性腺发育等生命活动所获得的能量供给是有差异的。
同时,头足类属种在不同性腺发育时期的摄食活动、食物可利用性等变化[27-28],也一定程度影响着个体组织生化组成的变化[29],从而导致这些种类的组织在不同性腺发育阶段的能量密度可能会产生差异性[10]。然而,在性腺发育过程中,南海鸢乌贼中型群雌性个体的肌肉和性腺组织的能量密度保持了一定的稳定性。除了肌肉组织能量密度在Ⅰ期和Ⅵ期之间存在显著性差异之外,其他组织的能量密度在不同成熟度之间均不存在统计学差异,这与西南大西洋阿根廷滑柔鱼(Illex argentinus)性腺组织能量密度随性腺发育的变化有所不同,后者的输卵管复合体和卵巢的组织能量密度随着性腺发育增加显著[10,30]。
此外,中型群雌性个体各组织的能量密度均低于西南大西洋阿根廷滑柔鱼相对应组织的能量密度[10,30]。一方面,这种差异性可能是不同种类组织的蛋白质、脂肪等生化组成比例不同所致[10,23,29];另一方面,繁殖产卵策略的不同也会使得属种间的组织能量密度存在差异[30]。鸢乌贼为多次产卵者,并且在产卵间隙保持摄食和体细胞生长的状态[31];而阿根廷滑柔鱼为间歇性终端产卵,产卵活动开始后便逐渐停止摄食[32-34]。前者随着性腺发育性腺细胞的发生和卵子形成较为缓慢,后者自性腺发育成熟后便快速发育性腺细胞并传输至输卵管存储,而性腺细胞发育过程中的变动因素卵黄物质是组织能量积累的主要物质单元[35-36],因而两者产生了组织能量积累上的不同。
3.2 组织能量积累与投入分配
头足类属种为典型的性腺发育滞后于个体生长的海洋软体动物,除鹦鹉螺属(Nautilus)外,均为终身一次繁殖产卵[33,37]。这些种类在性腺发育前摄食盈余能量主要用于个体生长,而随着性腺发育更多的盈余能量将投入性腺组织发育及配子发生[31-32,34]。本研究显示,随着性腺发育,南海鸢乌贼中型群雌性个体的肌肉和性腺组织的绝对组织能量积累均不断增加。该研究结果与其他头足类属种的组织能量积累相一致[31-32,34],也表明了头足类属种组织能量积累及其生殖投入是对其终生一次繁殖产卵策略的选择性进化适应[34]。然而,南海鸢乌贼中型群雌性性腺组织的相对能量积累在Ⅵ期达到最高值,为16.40%,低于其他头足类属种。如,阿根廷滑柔鱼性腺组织的相对能量积累在Ⅳ期时的占比为 28.90%[10];乳光枪乌贼(Loligo opalescens)的性腺质量在成熟期甚至达到体质量的50%以上[38]。这可能与不同种类之间产卵策略的属种特殊性相关,因为不同的产卵策略对生殖能量的积累及其投入分配存在一定的差异性[39]。
头足类的性腺发育与体内的生物合成活动相关,在个体生长和繁殖之间起到了平衡作用[40]。其中,有些头足类属种体细胞的生长速度随着性腺发育而降低[41-42],并且个体肌肉组织之间以及肌肉组织与性腺组织之间存在能量流动的迹象[43],而且繁殖期间所需的能量依赖于体内既有能量的转移[21]。相反地,另一些属种如强壮桑椹乌贼(Moroteuthis ingens)性腺发育所需的能量完全依赖于胴体、尾鳍等肌肉组织能量的转化,自性腺开始发育,其肌肉组织萎缩并转化能量供给性腺发育和配子发生[15]。本研究显示,南海鸢乌贼中型群雌性个体自Ⅲ期开始,肌肉组织的相对能量积累逐渐降低,性腺组织的相对能量积累占比则持续增加,说明随着性腺发育,个体摄食的能量积累逐渐转向性腺组织的生长发育。同时,组织胴长-能量积累回归关系的残差分析显示,在性腺成熟度Ⅲ期以后胴长-性腺组织能量积累残差与胴长-肌肉组织能量积累残差之间呈负相关关系,表明肌肉组织的积累能量可能部分转化用于性腺组织的生长发育。但是,这种能量转化应该不是以牺牲肌肉组织的完整性为代价,因为性腺组织能量-胴长残差与肌肉组织能量-胴长残差之间的相关系数均比较小,R2仅为0.05到0.07之间。这应该与其产卵期间保持正常的摄食活动与体细胞生长的生活史特性密切相关,研究表明鸢乌贼生殖能量投入主要来源于摄食活动[31],而个体存储能量则仅在性腺发育过程中提供一定的辅助支持。
综上所述,南海鸢乌贼中型群雌性个体肌肉、性腺组织的绝对能量积累随着性腺发育不断增加,并且自生理性发育期(Ⅲ期)后性腺组织的相对能量积累显著增加,而肌肉组织的相对能量积累在生理性成熟期(Ⅳ~Ⅵ期)下降显著。同时,性腺成熟度达到Ⅲ期及以上时,胴长-性腺组织能量积累关系残差与胴长-肌肉组织能量积累关系残差呈弱的负相关关系。这些结果表明南海鸢乌贼中型群雌性个体的组织能量积累及其生殖能量投入有其一定的属种灵活性,生殖投入主要来源于摄食活动[31],肌肉组织能量积累在性腺发育过程中部分转化以满足性腺发育对能量的较大需求。但是,鸢乌贼的这种生殖投入模式仍需要深入开展肌肉组织、性腺组织等生物化学及其营养成分的相似性分析研究,以及结合胃含物及其与性腺组织的生化成分相似性分析,以进一步了解该种类的生殖投入策略,为可持续开发利用该资源提供科学基础。

