牛膝总皂苷对大鼠椎间盘髓核细胞外基质合成的影响
王新立,刘汝银,王西彬,岳宗进
(河南省中医院脊柱外科,河南 郑州 450000)
椎间盘退变性疾病是中老年人的常见病和多发病,被认为与椎间盘结构的崩塌和功能失调有关[1]。髓核细胞为类软骨细胞,是椎间盘髓核的主要细胞,能够合成及分泌II 型胶原(collagen II)、聚集蛋白聚糖(aggrecan)等功能性细胞外基质,在维持椎间盘结构稳定、功能完整等方面起着关键性作用[1-2]。研究认为,椎间盘退变与髓核细胞数量减少及其细胞外基质代谢失衡导致的细胞微环境改变密切相关[2-3],但其具体分子机制尚未完全明确。牛膝提取物被证实具有促进软骨细胞增殖、增加软骨细胞collagen II 表达、恢复软骨基质成分、修复软骨损伤的作用[4-6]。牛膝总皂苷(Achyranthes bidentatasaponins,ABS)作为传统中药牛膝的主要有效成分,也被证实能够促进软骨细胞增殖,抑制软骨细胞凋亡,修复软骨组织损伤[7-8],但是否影响髓核细胞的存活及其细胞外基质合成尚未见报道。本实验以大鼠椎间盘髓核细胞为研究对象,体外建立氧糖剥夺(oxygen glucose deprivation,OGD)模型模拟椎间盘髓核细胞退变微环境,探究ABS 对髓核细胞增殖、凋亡和细胞外基质合成的影响,并探讨其可能的作用机制,以期为相关发病机制及其治疗方法的研究提供新思路和实验依据。
1 材料
1.1 动物 SPF 级雄性SD 大鼠(6 周龄,体质量220~250 g),由河南中医药大学实验动物中心提供,动物生产许可证号SYXK(豫)2015-0005。所有动物实验均经过河南中医药大学实验动物伦理委员会批准(批准文号Z1.0/513)。
1.2 试剂 DMEM 培养基(批号12800-017)、胎牛血清(FBS,批号16000-044)、胰酶(批号25200-056)、Ⅱ型胶原酶(批号C21901)均购于美国Gibco 公司。ABS 由本课题组提取制备,质量分数约52%。沉默信息调节因子2 相关酶1(sirtuin1,SIRT1)抑制剂6-氯-2,3,4,9-四氢-1H-咔 唑-1-甲酰胺(6-chloro-2,3,4,9-tetrahydro-1H-carbazole 1-carboxamide,EX527,批号E7034)、自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA,批号M9281)均购于美国Sigma 公司。CCK-8 细胞活性检测试剂盒(批号C0038)、caspase-3 活性检测试剂盒(批号C1115)、RIPA 裂解液(批号P0013)、BCA 蛋白检测试剂盒(批号P0011)均购于上海碧云天生物科技有限公司。Annexin V-FITC/PI 凋亡检测试剂盒(批号BD556547)购自美国BD 公司。TRIzol(批号80802)、MML-V逆转录试剂盒(批号 K1622)均购于美国Invitrogen 公司。SYBR Premix Ex TaqⅡ试剂盒(批号RR820A)购于宝生物工程(大连)有限公司。PCR 引物由上海生工生物工程有限公司合成。Collagen II(批号sc-52658)、Aggrecan(批号sc-166951)抗体购于美国Santa Cruz 公司;SIRT1 抗体(批号 2493S)购于美国 Cell Signaling Technology 公司;ATG5(批号ab108327)、LC3(批号ab128025)、p62(批号ab109012)、β-actin(批号ab8226)抗体及辣根过氧化物酶标记的二抗均购于英国Abcam 公司。
2 方法
2.1 大鼠椎间盘髓核细胞的分离与培养 采用1%戊巴比妥钠麻醉SD 大鼠,无菌条件下分离其脊柱,收集腰椎间盘。解剖显微镜下分离椎间盘髓核组织,用含双抗的PBS 清洗后剪碎,依次采用0.25% 胰酶和0.2%Ⅱ型胶原酶在37 ℃水浴中分别消化30 min、3 h。离心后收集细胞沉淀,重悬于含10% FBS 及1% 青霉素/链霉素的DMEM 培养液,置于37 ℃、5%CO2条件下培养,每3 d 换液1次。待细胞融合度约80% 左右,用0.25% 胰酶消化传代,选取第3 代细胞进行实验。为了选择合适的作用浓度,向培养基中添加不同浓度(0、20、40、60、80 μg/mL)ABS,培养48 h 后CCK-8 试剂盒检测细胞存活率。
2.2 氧糖剥夺模型及分组 采用体外OGD 模型,用于模拟髓核细胞退变微环境。将大鼠椎间盘髓核细胞分为对照组,采用正常培养基培养大鼠椎间盘髓核细胞;OGD 组,将细胞培养基更换为无血清无糖的DMEM 培养基,置于37 ℃低氧(5% CO2、1% O2、94% N2)条件下培养12 h;OGD +ABS组,向无血清无糖的 DMEM 培养基中添加40 μg/mLABS,再于37 ℃低氧中培养;OGD+ABS+EX527 组,向无血清无糖的DMEM 培养基中添加40 μg/mLABS、2 μmol/L SIRT1 抑制剂EX527,再于37 ℃低氧中培养;OGD+ABS+3-MA 组,向无血清无糖的DMEM 培养基中添加40 μg/mLABS、5 mmol/L 自噬抑制剂3-MA,再于37 ℃低氧中培养。
2.3 CCK-8 检测细胞存活率 按照CCK-8 细胞存活率检测试剂盒操作,检测各组细胞存活率。将经过不同处理的各组细胞以2×105/mL 浓度接种于96孔板,培养24 h 后每孔加入20 μL CCK-8 溶液,37 ℃孵育2 h,酶标仪检测450 nm 处吸光度值(A450)。
2.4 流式细胞术检测细胞凋亡 按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作,检测各组细胞凋亡。将经过不同处理的各组细胞以3.5×105/mL浓度接种于6 孔板,用冷PBS 洗涤细胞2 次,加入500 μL 结合缓冲液悬浮细胞。向细胞悬液中依次加入10 μL Annexin V-FITC、10 μL PI,缓慢混匀,室温避光孵育15 min,于1 h 内在FACS Calibur 流式细胞仪上检测细胞凋亡情况。
2.5 caspase-3 试剂盒检测caspase-3 活性 按照caspase-3 活性检测试剂盒说明书操作,检测各组细胞caspase-3 活性。收集经过不同处理的各组细胞,冷PBS 洗涤细胞1 次,加入细胞裂解液,冰上裂解10 min,离心后收集上清。向96 孔板每孔分别加入10 μL 各组上清、10 μL caspase-3 底物、80 μL 反应缓冲液,混匀后37 ℃孵育2 h,酶标仪检测405 nm 处吸光度值(A405)。
2.6 实时定量PCR 检测collagen II和Aggrecan mBNA表达 收集经过不同处理的各组细胞,Trizol 法提取细胞总RNA,用MML-V 逆转录试剂盒合成模板cDNA。以β-actin 为内参,利用SYBR Premix Ex Taq Ⅱ试剂盒,按照说明书行实时定量PCR 检测。引物序列如下:collagen II正向5′-GGAAGAGTGGAGACTACTGGATTGAC-3′,反向5′-TCCATGTTGCAGAAAACCTTCA-3′;Aggrecan正向5′-TCTACCGCTGCGAGGTGAT-3′,反向 5′-TGTAATGGAACACGATGCCTTT-3′;β-actin 正向5′-TCCTAGCACCATGAAGATC-3′,反向 5′-AAACGCAGCTCAGTAACAG-3′。按照2-△△Ct法计算各组细胞中目的基因的相对表达量。
2.7 Western blot 检测collagen II、Aggrecan、SIRT1及自噬相关蛋白表达 收集经过不同处理的各组细胞,RIPA 裂解,离心提取总蛋白,BCA 蛋白检测试剂盒测定蛋白浓度。蛋白样品采用10% SDS-PAGE进行分离,电转移至PVDF 膜上,5% 脱脂牛奶室温封闭1 h,漂洗后分别与抗collagen II(1∶800)、Aggrecan(1∶1 000)、SIRT1(1∶1 000)、ATG5(1∶1 000)、LC3(1∶1 000)、p62(1∶10 000)、β-actin(1∶1 000)等抗体4 ℃孵育过夜,漂洗后与辣根过氧化物酶标记的二抗(1∶5 000)室温孵育1 h,漂洗后加入发光液显影。用Image J 软件分析条带灰度,以目标蛋白与内参β-actin 灰度值的比值作为目标蛋白的相对表达水平。
2.8 统计学分析 用SPSS 22.0 软件进行统计学处理,采用组间单因素方差分析及LSD-t 检验进行两两比较,所有实验均重复3 次,数据以(±s)表示。以P<0.05 为差异有统计学意义。
3 结果
3.1 ABS 对髓核细胞存活率的影响 如图1 所示,ABS 质量浓度为20~40 μg/mL时,大鼠椎间盘髓核细胞存活率逐渐升高,在40 μg/mL 时最强(P<0.01),而ABS 质量浓度60~80 μg/mL 时细胞存活率逐渐降低,表明低质量浓度下能促进大鼠椎间盘髓核细胞的存活率。

图1 不同质量浓度ABS 对髓核细胞存活率的影响Fig.1 Effects of different concentrations of ABS on the survival rate of nucleus pulposus cells
3.2 ABS 抑制OGD 诱导的髓核细胞凋亡 如图2所示,与对照组比较,OGD 组细胞存活率降低(P<0.05),细胞凋亡 率、caspase-3 活性升高(P<0.05);加入ABS 干预后,与OGD 组比较细胞存活率升高(P<0.05),细胞凋亡、caspase-3 活性降低(P<0.05),表明ABS 可减少退变微环境中髓核细胞的凋亡。
3.3 ABS 对OGD 诱导的髓核细胞胞外基质的影响 如图3 所示,与对照组比较,OGD 组细胞collagen II、AggrecanmRNA 和蛋白表达水平均下调(P<0.05),表明OGD 模拟的退变微环境下,髓核细胞胞外基质collagen II、Aggrecan 表达减少;与OGD 组比较,OGD+ABS 组collagen II、AggrecanmRNA 和蛋白表达水平均上调(P<0.05),表明ABS 可抑制退变微环境中髓核细胞的胞外基质减少。
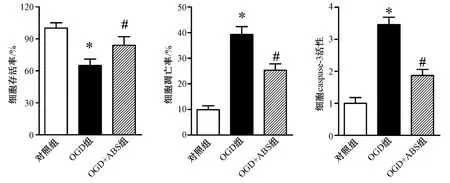
图2 ABS 对OGD 诱导的髓核细胞凋亡的影响Fig.2 Effects of ABS on OGD-induced apoptosis of nucleus pulposus cells
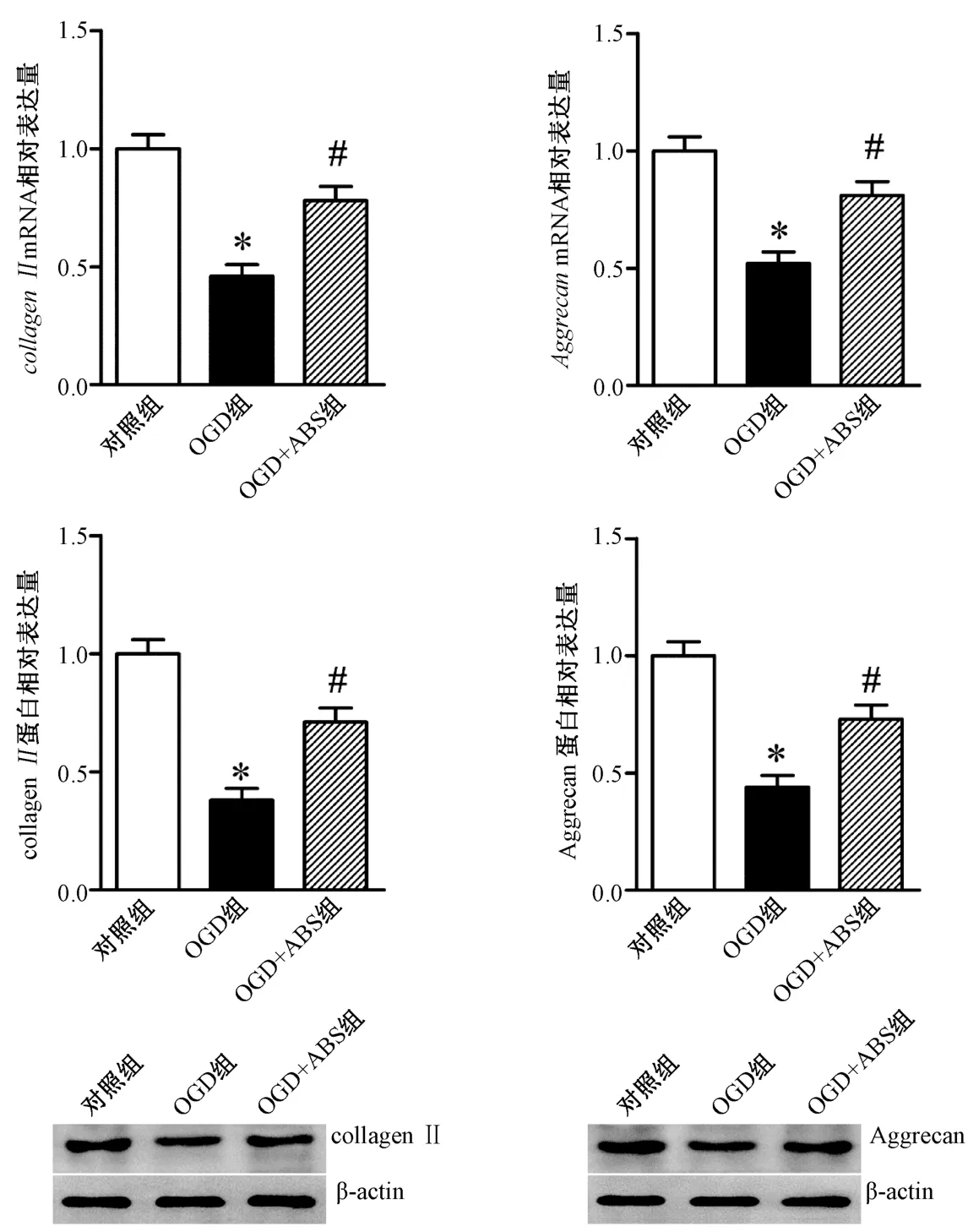
图3 ABS 对OGD 诱导的髓核细胞胞外基质的影响Fig.3 Effects of ABS on OGD-induced extracellular matrix of nucleus pulposus cells
3.4 ABS 激活SIRT1/自噬信号通路促进髓核细胞存活和细胞外基质合成 SIRT1 和自噬相关信号通路被证实与退变髓核细胞的存活及其胞外基质合成密切相关[2,9]。如图4 所示,与对照组比较,OGD组SIRT1、ATG5 和LC3Ⅱ/LC3Ⅰ蛋白表达均减少,p62 蛋白表达增加(P<0.05);与OGD 组比较,OGD+ABS 组SIRT1、ATG5 和LC3Ⅱ/LC3Ⅰ的蛋白表达均增加,p62 蛋白表达减少(P<0.05),表明在OGD 模拟的退变微环境下,ABS 处理激活了SIRT1/自噬信号通路。与OGD +ABS 组比较,OGD+ABS+EX527 组和OGD+ABS+3-MA 组的细胞存活率下调(P<0.05),细胞凋亡率上调(P<0.05),collagen II、Aggrecan 蛋白表达水平均下调(P<0.05),表明抑制SIRT1/自噬信号通路可抑制ABS 诱导的髓核细胞存活和细胞外基质合成。

图4 ABS 激活SIRT1/自噬信号通路对髓核细胞存活和胞外基质合成的影响Fig.4 Effects of ABS-activated SIRT1/autophagy signaling pathway on the survival of nucleus pulposus cells and extracellular matrix synthesis
4 讨论
髓核退变,包括髓核细胞数量的减少及其胞外基质减少引起的髓核功能障碍,被认为是椎间盘退变的主要因素[2-3],因此,促进髓核细胞的存活,增加髓核细胞胞外基质合成,或减少其胞外基质降解对于抑制椎间盘退变进程具有重要意义。研究表明,ABS 能够促进软骨细胞增殖,抑制软骨细胞凋亡[7-8],但其是否影响类软骨细胞-髓核细胞的存活及胞外基质代谢尚不明确。因此,本研究首先采用不同ABS 体外干预大鼠椎间盘髓核细胞,发现低浓度下能够促进大鼠髓核细胞的增殖,提示它可影响髓核细胞的存活。为了进一步探究ABS 是否影响退变微环境中髓核细胞的存活,本研究采用OGD 模型体外模拟髓核细胞退变微环境,发现ABS 处理后可使处于OGD 环境中的髓核细胞的增殖显著增加、凋亡显著减少,细胞caspase-3 活性显著降低,提示它可促进退变微环境中髓核细胞的存活。
椎间盘退变往往伴随着髓核细胞胞外基质的减少,使得髓核组织结构不稳,髓核细胞功能发生障碍,从而增加髓核细胞基质合成、分泌,或者减少其基质降解,能有效延缓椎间盘退变进程[3,10]。既往研究表明,牛膝提取物能增加软骨细胞collagen II 表达并恢复软骨基质成分[4,6];本研究发现,ABS 后处理可使处于OGD 环境中的髓核细胞的主要细胞外基质collagen II、AggrecanmRNA 和蛋白表达均显著增加,提示ABS 可促进退变微环境中髓核细胞的胞外基质合成与分泌。
SIRT1 能够调控细胞的多种生命活动,已被证实可以调控软骨细胞的分化,代谢以及抗应激能力,并且影响软骨细胞的增殖、凋亡、自噬、胞外基质表达[11]。研究发现,SIRT1 和自噬相关信号通路可以调控退变髓核细胞的存活和胞外基质合成[2,9],多种中药有效成分可通过调控两者来影响髓核细胞的存活及胞外基质合成[12-13]。本研究发现,ABS 处理可显著上调OGD 环境中髓核细胞SIRT1、ATG5、LC3Ⅱ/LC3Ⅰ蛋白表达,下调p62蛋白表达,提示ABS 可激活退变微环境中髓核细胞的SIRT1/自噬信号通路。此外,SIRT1 抑制剂EX527 或自噬抑制剂3-MA 的干预可显著抑制OGD环境中ABS 介导的髓核细胞增殖增加、凋亡减少、collagen II 和Aggrecan 蛋白表达上调,提示ABS 可能通过激活SIRT1/自噬信号通路促进大鼠椎间盘髓核细胞存活和细胞外基质合成。
综上所述,ABS 可通过激活SIRT1/自噬信号通路促进退变髓核细胞的存活及其胞外基质表达,进而抑制椎间盘髓核退变。本研究为椎间盘退变性疾病的治疗提供了新方向,也为ABS 在椎间盘退变性疾病的防治应用提供了实验依据。

