系统性硬化症合并肺间质病变患者外周血中IL-8、CXCR1、CXCR2的表达及意义
张帆,韩卫全,庞艳,龚子龙,肖婷,夏露
系统性硬化症(systemic sclerosis,SSc)是以皮肤和内脏组织呈弥漫性或局限性纤维化进行性硬化的自身免疫性疾病[1]。临床上以弥漫性或局限性皮肤增厚、内脏(心脏、肺等)器官结构异常、器官缺血为特征性病变[2]。但SSc早期病症较轻,常被人们忽视而延误治疗时机,导致病情加重。据统计65%以上的SSc患者肺部受到牵连,50%以上患者肺部呈现弥漫性肺间质病变(interstitial lung disease,ILD),即为SSc-ILD,且ILD成为SSc致死的主要原因[3]。近年来多项研究表明趋化因子与免疫性疾病的发病机制相关[4]。IL-8是由单核细胞、巨噬细胞分泌的单核因子,在炎性反应和免疫反应中具有重要作用。研究表明,IL-8作为趋化因子受体1(CXCR1)、CXCR2的配体,与CXCR1、CXCR2结合后能够特异性地趋化单核细胞、淋巴细胞聚集到病变部位,引起组织的损伤[5]。多项研究表明,IL-8与受体CXCR2结合,趋化免疫细胞,激活多种炎性因子的表达[6]。但关于IL-8、CXCR1、CXCR2在SSc-ILD中的作用及其与肺功能关系的研究报道较少。本研究通过检测SSc-ILD患者IL-8、CXCR1、CXCR2水平及免疫球蛋白IgA、IgG、IgM水平,分析IL-8、CXCR1、CXCR2与SSc-ILD发病机制的相关性,为及时有效地诊治SSc-ILD提供理论依据,报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2019年5月武汉市第五医院风湿免疫科治疗的系统性硬化症患者42例作为研究对象,均符合中华医学会风湿病学分会制定的SSc诊断标准[7],其中合并ILD患者25例作为SSc-ILD组,非ILD患者17例作为SSc-非ILD组。另选取同期来院体检的健康者30例为健康对照组。SSc-ILD组男2例,女23例,年龄22~60(43.75±11.06)岁;病程6个月~11年,平均(47.18±22.19)个月。SSc-非ILD组男3例,女14例,年龄23~60(44.31±10.12)岁;病程6个月~9年,平均(40.55±23.06)个月。健康对照组男5例,女25例,年龄25~65(48.34±10.56)岁。3组研究对象性别、年龄等临床资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准,且受试者及家属知情同意并自愿签署同意书。
1.2 选择标准 (1)纳入标准:①SSc-ILD诊断符合Fleischne学会命名委员会关于SSc-ILD的定义;②无其他慢性病史。(2)排除标准:①其他病因引起的肺部病变;②入选前1周服用过激素类药物。
1.3 观测指标与方法
1.3.1 肺功能检测:3组研究对象早晨禁食,采用德国耶格公司生产的SpiroUSB型肺功能仪检测肺功能,用力肺活量(forced vital capacity,FVC),第一秒用力呼气容积(forced expiratory volume in the first second,FEV1)占预计值百分比(FEV1%),取测定3次的平均值。
1.3.2 外周血CXCR1、CXCR2 mRNA表达检测: (1)样本采集,早晨空腹采集所有受试者静脉血5 ml,分别置于2个EP管中,一管于含肝素的无菌EP管中用Ficoll Hypaque分离外周血单个核细胞(PBMCs),一管室温静置30 min,离心收集血清,-20℃冰箱保存备用;(2)PBMC制备,取肝素抗凝全血2 ml于10 ml离心管中,加入等体积PBS溶液稀释,再转入预先准备的Ficoll Hypaque 4 ml,离心后上层白色即为PBMC;加入RPMI1640完全培养液5~10 ml,2 000 r/min离心10 min,洗涤细胞2次,收集沉淀细胞,并以RPMI1640完全培养液调整细胞为1×106/ml;(3)取调整为1×106/ml的PBMC,依照Trizol试剂盒(北京索莱宝科技有限公司)使用步骤提取总RNA,紫外分光光度计检测其吸光度(OD)值,制作标准曲线,计算RNA浓度;将纯度良好的RNA按照反转录试剂盒(TaKaRa公司)使用说明反转录为cDNA。qRT-PCR反应体系为25 μl,SYBR Green Ⅰ qPCR Master Mix 12 μl,上下游引物各1 μl,cDNA模板1 μl,ddH2O 10 μl。荧光定量PCR仪反应程序为95 ℃ 10 min,95 ℃ 15 s,48 ℃ 30 s,72 ℃ 30 s,共40个循环。以β-actin为内参基因,使用Primer Premier 5.0设计引物序列,引物序列如表2(委托上海生工公司合成)。反应结束后收集数据,采用2-ΔΔCt算法进行Ct值分析[8],计算CXCR1和CXCR2的mRNA相对表达量。
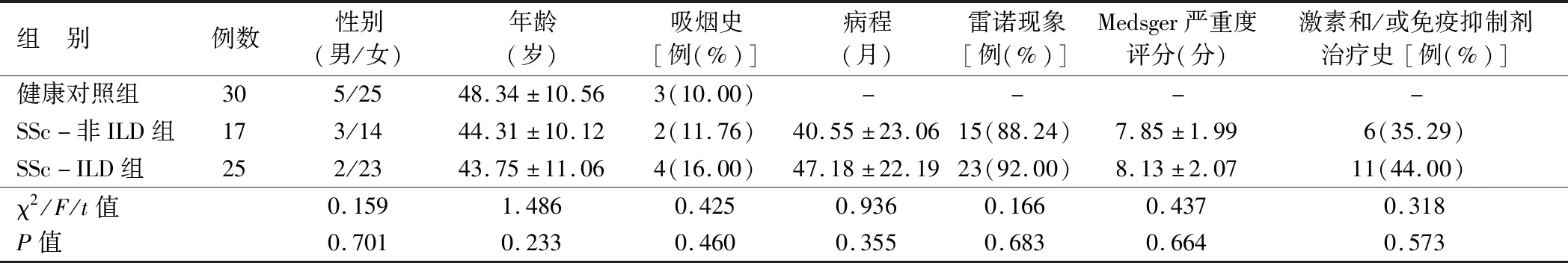
表1 3组研究对象临床资料比较
1.3.3 血清CRP、ESR、IL-8、IgA、IgG、IgM、补体C3水平检测:上述血清采用ELISA方法检测白介素-8(IL-8),试剂盒购自武汉默沙克生物科技有限公司;采用意大利Vital Microsed-System全自动血沉仪检测红细胞沉降率(ESR),免疫比浊法检测C反应蛋白(CRP)、IgA、IgG、IgM、补体C3水平。
2 结 果
2.1 3组肺功能比较 SSc-ILD组FEV1%、FEV1/FVC低于SSc-非ILD组低于健康对照组(P均<0.01),见表3。
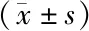
表3 3组受试者肺功能比较
2.2 3组CXCR1、CXCR2 mRNA表达水平比较 SSc-ILD组CXCR1、CXCR2 mRNA表达水平高于SSc-非ILD组高于健康对照组(P均<0.01),见表4。
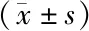
表4 3组受试者CXCR1、CXCR2mRNA表达水平比较
2.3 3组血清IL-8、ESR、CRP、IgA、IgG、IgM、C3水平比较 SSc-ILD组IL-8、ESR、CRP、IgA、IgG、IgM水平显著高于SSc-非ILD组高于健康对照组(P均<0.05), 各组C3水平比较差异无统计学意义(P>0.05),见表5。

表2 RT-qPCR引物序列
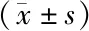
表5 3组受试者血清中IL-8、ESR、CRP、IgA、IgG、IgM、C3水平比较
2.4 外周血CXCR1、CXCR2、IL-8水平与肺功能的关系 SSc-ILD患者外周血中CXCR1、CXCR2及血清IL-8水平与FEV1%呈负相关(P<0.05);CXCR1、IL-8与FEV1/FVC呈负相关(P<0.05),CXCR2与FEV1/FVC无显著相关性(P>0.05),见表6。

表6 SSc-ILD患者CXCR1、CXCR2、IL-8与肺功能的相关性
2.5 外周血CXCR1、CXCR2、IL-8水平与相关因子的相关性 SSc-ILD患者CXCR1、CXCR2、IL-8与CRP、ESR、IgA、IgG、IgM均呈正相关(P<0.05),与C3无显著相关性(P>0.05),见表7。

表7 SSc-ILD患者CXCR1、CXCR2、IL-8与CRP、ESR、免疫球蛋白和补体的相关性
3 讨 论
SSc是以皮肤炎性反应、纤维化、增厚进而硬化、萎缩为主要特征的风湿性疾病,SSc往往引起肺脏结构异常、肺间质病变[9]。研究发现,ILD是SSc预后不良的主要因素,SSc的发病机制目前尚不清楚,但SSc-ILD的发病与多种免疫细胞、细胞因子、趋化因子等多种因素密切相关[10]。研究发现,中性粒细胞可在机体内释放细胞因子并作用于CD8+T细胞,并与释放的相关细胞因子共同参与自身免疫性疾病过程[11]。趋化因子及其受体在炎性反应中具有重要作用,特别与炎性细胞的募集密切相关[12]。目前对于SSc-ILD的早期诊断和治疗还缺乏有效的手段。为了明确SSc-ILD发病与机体免疫反应及其趋化作用的关系,本研究主要针对外周血中CXCR1、CXCR2及血清中IL-8在SSc-ILD中的表达水平及与免疫蛋白的关系进行分析。
趋化因子可分为4型,即CXC型、CC型、C型、CX3C型,趋化因子与其特异性的受体结合发挥生物学作用。CXCR1和CXCR2是一条肽链的糖蛋白,属于G蛋白耦联受体超家族成员,为趋化细胞因子的受体,其与细胞因子的活化、增殖、募集及血管形成前体物质等有关[13]。CXCR1和CXCR2主要表达于单核细胞、中性粒细胞、CD8+T细胞、肥大细胞等细胞表面;IL-8是CXCR1和CXCR2的共同配体,可促进CXC趋化因子的表达,促进中性粒细胞的表达,参与多种疾病的发生发展[14]。本研究结果显示,SSc-ILD患者外周血单核细胞上的CXCR1、CXCR2 mRNA及血清IL-8表达水平显著升高,表明IL-8可能通过与其受体结合发挥炎性反应作用。CXCR1和CXCR2与IL-8结合后能够激活G蛋白耦联受体通路,介导炎性反应。研究报道,无抗原活性的突变体G31P与IL-8受体CXCR1、CXCR2结合后可抑制中性粒细胞的趋化作用,减轻炎性反应[15]。鳞状细胞癌患者的皮肤损伤部位中IL-8及其配体CXCR1、CXCR2异常表达[16]。临床上常结合肺功能检测评估ILD对肺脏的损伤程度,FVC对于肺间质纤维化病变反应敏感。本研究对患者肺功能指标检测结果显示,SSc-ILD组患者FEV1%、FEV1/FVC明显降低,表明SSc-ILD可能严重影响患者的肺功能。进一步进行Spearman相关性分析,结果显示IL-8、CXCR1、CXCR2与FEV1%、FEV1/FVC密切相关,表明随着IL-8介导的炎性反应的增强,肺功能受损严重。研究表明,IL-8可引起外周血中性粒细胞增加,产生呼吸爆发、溶酶体酶促进肺部炎性反应。
IgA是分泌型蛋白中的主要蛋白,是机体防御中的第一道防线,可介导细胞毒性作用(ADCC),在免疫性疾病中常升高[17]。研究发现在过敏性紫癜患者中IgA合成增加,促进炎性细胞因子IL-8、TNF-α、IL-6等过度表达,造成肾损伤。IgG约占免疫球蛋白的75%,是血清免疫球蛋白的主要成分[18]。IgM是抗原刺激后机体内最先出现的抗体。研究报道,在系统性红斑狼疮、风湿病等免疫性疾病中IgG表达升高,可提高免疫反应[19]。IL-8是重要的促炎细胞因子和中性粒细胞趋化因子,研究报道,在儿童肺炎支原体感染中IL-8促进炎性反应,刺激机体产生自身免疫反应,引起IgG、IgM水平升高[20]。本研究结果显示,SSc-ILD组患者IgA、IgG、IgM水平显著升高,C3水平减少,且IL-8、CXCR1、CXCR2均与IgA、IgG、IgM有关,表明SSc-ILD中IL-8引起的炎性反应刺激机体启动自身免疫应答,引起自身免疫紊乱。CRP在正常机体表达较少,在机体感染和炎性反应时浓度显著升高,其与ESR是临床常用的非特异性炎性指标。本研究结果显示,与SSc-非ILD组和健康对照组比较,SSc-ILD组ESR、CRP水平明显升高,相关性分析显示,IL-8、CXCR1、CXCR2与ESR、CRP相关,表明IL-8、CXCR1、CXCR2可能参与机体非特异性炎性反应,引起组织损伤。
综上所述,SSc-ILD患者血清中趋化因子IL-8、CXCR1、CXCR2表达显著升高,炎性因子IL-8表达也显著升高,表明IL-8可能通过其受体CXCR1、CXCR2在SSc-ILD疾病中发挥作用,但其与炎性因子的作用机制,以及与肺功能指标的作用机制有待进一步研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
张帆:设计研究方案,实施研究过程,论文撰写;韩卫全:提出研究思路,分析试验数据,论文审核;庞艳:实施研究过程,资料搜集整理,论文修改;龚子龙、肖婷:进行统计学分析;夏露:课题设计,论文撰写

