圆二色光谱、红外光谱法解析羊乳和牛乳β-酪蛋白结构及性质差异
李 萌,王 娟,魏子凯,康佳欣,张 玲,Tabys Dina,刘 宁*,张 爽*
1. 乳品科学教育部重点实验室(东北农业大学),黑龙江 哈尔滨 150030 2. 东北农业大学医院,黑龙江 哈尔滨 150030
引 言
近年来,羊乳以营养价值高、低致敏性、易消化吸收等特点,深受广大消费者的青睐。羊乳比牛乳中蛋白质、维生素及矿物质等营养成分的含量更高[1-2],且现代医学研究已经证实摄入羊乳可有效改善牛乳蛋白过敏症状[3]。因此,为了满足不能食用牛乳制品的特殊人群营养需求,尤其是患有牛乳蛋白过敏症的婴幼儿营养需求,分析羊乳和牛乳之间的差异,对研制更适合婴幼儿的配方食品具有重要的指导意义。
羊乳和牛乳之间的差异,主要体现在蛋白含量及结构方面[4]。β-酪蛋白是羊乳酪蛋白中含量最多的一种蛋白(约占酪蛋白总量的54.8%),可在消化过程中被降解成多种具有生物活性的肽段,这些生物活性肽在免疫、营养、消化代谢等方面发挥着重要的作用[5-6]。羊乳和牛乳β-酪蛋白结构及性质的不同,是造成羊乳和牛乳在结合钙的能力、消化吸收能力等方面存在差异的主要原因。
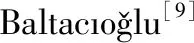
目前对β-酪蛋白的研究多集中于牛乳β-酪蛋白,对羊乳β-酪蛋白结构以及羊乳和牛乳β-酪蛋白结构差异的研究还鲜有报道。因此,本研究采用圆二色光谱和红外光谱技术测定羊乳和牛乳β-酪蛋白的结构,利用分光光度法对二者的疏基含量及溶解性进行了初步探究,旨在获得羊乳β-酪蛋白结构及功能性质方面的信息,为今后研制出营养价值更高、更适合婴幼儿的配方食品提供有利的理论依据。
1 实验部分
1.1 材料
生鲜山羊乳,采自齐齐哈尔飞鹤牧场;牛乳β-酪蛋白、尿素、Tris购于美国sigma公司;SDS-PAGE凝胶电泳试剂盒、二喹啉甲酸(bicinchoninic acid, BCA)试剂盒购于上海碧云天生物技术有限公司;其余试剂均购于天津市天力化学试剂有限公司。
1.2 仪器与设备
蛋白质纯化仪AKTA Exploer(美国GE公司);LC-MS/MS Thermo Q-Exactive质谱仪(美国Thermo Scientific公司);J-815型圆二色光谱仪(日本Jasco公司);Nicolet 6700型傅里叶变换红外光谱仪(美国Thermo Nicolet公司);DU800紫外可见分光光度计(美国Beckman公司)。
1.3 方法
1.3.1 羊乳β-酪蛋白的制备
(1)羊乳β-酪蛋白的色谱分离
将羊乳样品离心以除去脂肪,调节pH值至4.6,收集酪蛋白沉淀并冻干。取冻干后的酪蛋白沉淀600 mg,溶于30 mL的平衡缓冲液(20 mmol·L-1Tris,3 mol·L-1urea,1%β-巯基乙醇,pH 7.0),涡旋使其充分溶解后,离心弃去沉淀。将上清液从进样环打入AKTA Exploer蛋白质纯化仪中,用0.3 mol·L-1NaCl溶液进行梯度洗脱并用自动集样器收集各个洗脱峰。
(2)羊乳β-酪蛋白SDS-PAGE电泳和纯度鉴定
将各个洗脱峰的蛋白溶液进行SDS-PAGE电泳,考马斯亮蓝染色液染色1 h后进行脱色,直至条带清晰可见。用凝胶成像仪扫描获得电泳图片并进行分析,根据Marker的位置和各个样品的相对分子质量确定含有β-酪蛋白的洗脱峰。
(3)羊乳β-酪蛋白的液相色谱-串联质谱(LC-MS/MS)鉴定
取10 μL消化后的蛋白溶液样品进行质谱检测。LC-MS/MS参数:液相色谱:色谱柱C18,Eprogen(5 μm,150 Å);梯度洗脱0~60 min,100%A;0~60 min,5%~80%B;流动相A:0.1%甲酸的水溶液,B:0.1%甲酸的乙腈溶液;流速400 nL·min-1;柱温室温;检测波长214 nm。质谱:正离子模式;扫描范围50~2 200m/z;毛细管电压1 500 V;干燥气体温度150 ℃。应用Proteome Discoverer 1.4软件整合的MASCOT对UniProtKB Bovidae蛋白数据库进行搜索、分析和鉴定。
1.3.2 圆二色光谱、红外光谱分析羊乳和牛乳β-酪蛋白二级结构的差异
(1)圆二色光谱测定羊乳和牛乳β-酪蛋白的二级结构
取羊乳和牛乳β-酪蛋白样品各1 mg,分别溶于2 mL磷酸盐缓冲液(0.01 mol·L-1,pH 7.0),加入石英比色皿置于圆二色光谱仪上进行检测,具体参数为:样品池光径1 mm,步长0.1 nm,扫描范围190~250 nm,扫描速度120 nm·min-1。用Origin Pro 8.5软件作图,并用CD Pro软件拟合蛋白质中二级结构的组成与含量。
(2)红外光谱测定羊乳和牛乳β-酪蛋白的二级结构
取羊乳和牛乳β-酪蛋白样品各1 mg,分别与10 mg溴化钾均匀混合压片后,置于红外光谱仪中,在400~4 000 cm-1频率范围内扫描32次。用Origin Pro 8.5软件采集谱图并对特征峰进行标注,用Peakfit Version 4.12软件在相应谱带范围内进行基线校正,并经Savitsk-Golay函数平滑、去卷积处理,对二阶导数曲线进行多次拟合[10],使拟合残差达到理想水平。根据各二级结构单元对应峰的面积,计算蛋白质中各二级结构的含量。
1.3.3 羊乳和牛乳β-酪蛋白功能性质的测定
(1)羊乳和牛乳β-酪蛋白总疏基和表面疏基含量的测定
使用Ellman’s法测定两种蛋白的巯基含量[11]。表面巯基含量的测定:取适量两种蛋白样品用pH 8.0的Tris-Gly缓冲溶液(含4 mmol·L-1的EDTA)稀释至100 mL,取5 mL稀释液,加入0.1 mL的Ellman’s试剂。室温避光震荡30 min后,于10 000 r·min-1离心10 min,取上清液并用紫外分光光度计测定其在412 nm处的吸光值,以仅加Ellman’s试剂为空白对照。总巯基含量的测定与测定表面巯基含量方法一致,所使用的缓冲溶液为含4 mmol·L-1EDTA,8 mol·L-1尿素,pH为8.0的Tris-Gly缓冲溶液。
巯基(SH)含量的计算公式如下
式中:A412为样品在412 nm处的吸光值;D为样品稀释倍数;c为干物质浓度,mg·mL-1。
(2)羊乳和牛乳β-酪蛋白溶解性的测定
参照Singh[12]等的方法。在室温条件下,分别取两种蛋白溶液样品(10 mg·mL-1)用磁力搅拌器搅拌1 h,然后调整pH值并继续搅拌30 min,12 000 r·min-1离心20 min。用BCA试剂盒法测定上清液的蛋白浓度,此浓度与总蛋白浓度之比即为该蛋白质的溶解度。
1.4 数据处理及统计分析

2 结果与讨论
2.1 羊乳β-酪蛋白的制备
2.1.1 羊乳β-酪蛋白的色谱分离纯化
对酪蛋白样品进行梯度洗脱的结果如图1所示。从图1可以看出,本次纯化过程中出现一个较大的穿过峰和三个蛋白洗脱峰,将这三个蛋白洗脱峰分别标记为峰Ⅰ、峰Ⅱ和峰Ⅲ。由于酪蛋白样品含有的未与柱子结合的蛋白和其他杂质的洗脱液会先从柱子流出,因此层析图中首先出现了一个较大的穿过峰。另外,图1中三个蛋白洗脱峰没有发生重合,说明酪蛋白分离效果较好,且与峰Ⅰ和峰Ⅲ相比,峰Ⅱ的峰型较大,说明其所代表的蛋白质所占比例较高。
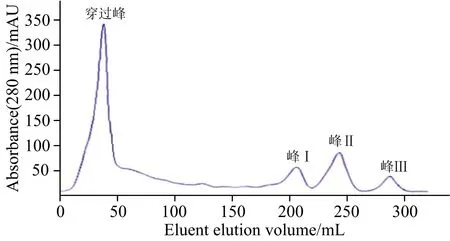
图1 DEAE-Sepharose Fast Flow离子交换层析法纯化羊乳β-酪蛋白结果
Fig.1Purificationofgoatmilkβ-caseinbyDEAE-SepharoseFastFlowanionexchangechromatography
2.1.2 羊乳β-酪蛋白SDS-PAGE电泳和纯度鉴定
图2为各峰洗脱液经SDS-PAGE电泳鉴定后的结果。从图2可以看出,峰Ⅰ和峰Ⅱ均为单一的蛋白质,但峰Ⅱ相对百分含量较大,其纯度高达90%。根据SDS-PAGE图谱及β-酪蛋白的相对分子质量,可初步判定峰Ⅱ为β-酪蛋白的目标峰。
图2 羊乳β-酪蛋白SDS-PAGE电泳结果
2.1.3 羊乳β-酪蛋白的LC-MS/MS鉴定
对峰Ⅱ蛋白组分进行LC-MS/MS鉴定,结果显示在UniProtKB Bovidae数据库中编号为Q95L76的蛋白得分最高,为15 678分,且该蛋白检测出可信度较高(Score>11)的肽段共11条,这11条肽段的信息匹配表如表1所示。图3标红部分为该蛋白肽段及碎片离子质量数实测值与理论值相符的肽段序列,序列覆盖率为53%。因此,根据SDS-PAGE电泳及质谱鉴定结果,可以确认本研究纯化所得的峰Ⅱ蛋白组分为羊乳β-酪蛋白。

表1 LC-MS/MS测定羊乳β-酪蛋白的肽段信息匹配表Table 1 Peptides matching table of goat milk β-casein by LC-MS/MS
2.2 圆二色光谱、红外光谱分析羊乳和牛乳β-酪蛋白二级结构的差异
2.2.1 圆二色光谱测定羊乳和牛乳β-酪蛋白的二级结构
图4为羊乳和牛乳β-酪蛋白的圆二色光谱谱图。根据图4和相关参考文献对蛋白质圆二色光谱的峰谱指认信息[13],羊乳和牛乳β-酪蛋白在190 nm左右均出现一个较为明显的正峰谱带,此处特征峰为α-螺旋在192 nm与β-折叠在185~200 nm处特征峰的重合峰,说明这两种蛋白结构中均含有α-螺旋和β-折叠。另外,在200~210 nm之间出现一个明显的负峰谱带,此处特征峰为α-螺旋在208 nm与无规卷曲在200 nm处特征峰的重合峰,而当波长超过206 nm后,两种蛋白样品的峰谱谱带均开始向正峰发展,这是β-转角在206 nm特征峰的谱带所造成的结果,说明这两种蛋白结构中还存在着大量的β-转角和无规卷曲。使用CD pro软件分析两种蛋白各二级结构的相对百分含量,结果如表2所示。

图3 羊乳β-酪蛋白的质谱序列覆盖情况

图4 羊乳β-酪蛋白和牛乳β-酪蛋白圆二色光谱图
表2圆二色光谱测定羊乳β-酪蛋白和牛乳β-酪蛋白中各二级结构的百分含量
Table2Percentageofsecondarystructureingoatmilkβ-caseinandbovinemilkβ-caseinbyCirculardichroism

羊乳β-酪蛋白/%牛乳β-酪蛋白/%α-螺旋2.7±0.21a4.3±0.13bβ-折叠15.3±0.08a19.5±0.12bβ-转角31.8±0.11a32.4±0.09a无规卷曲50.2±0.16a43.8±0.14b
注:同列肩标字母不同表示差异显著(p<0.05)
Note: Difference letters above same column indicate significant difference (p<0.05)
根据表2可以看出,羊乳β-酪蛋白内部α-螺旋、β-折叠含量显著低于牛乳β-酪蛋白(p<0.05),无规卷曲含量则显著高于牛乳β-酪蛋白(p<0.05)。据报道,蛋白质分子中α-螺旋和β-折叠能够形成紧密的无空腔结构,而与α-螺旋和β-折叠结构相比,无规卷曲结构的构象稳定性和紧密程度则相对较差[14],因此,羊乳β-酪蛋白中较低含量的α-螺旋和β-折叠以及较高含量的无规卷曲结构使其分子的无序性更高,结构更加疏松开放。
2.2.2 红外光谱测定羊乳和牛乳β-酪蛋白的二级结构


图5 羊乳β-酪蛋白和牛乳β-酪蛋白红外光谱图
Fig.5Fouriertransformationinfraredspectroscopyspectraofgoatmilkβ-caseinandbovinemilkβ-casein
表3红外光谱测定羊乳β-酪蛋白和牛乳β-酪蛋白中各二级结构的百分含量
Table3Percentageofsecondarystructureingoatmilkβ-caseinandbovinemilkβ-caseinbyFouriertransformationinfraredspectroscopy

羊乳β-酪蛋白/%牛乳β-酪蛋白/%α-螺旋12.1±0.14a31.2±0.22bβ-折叠18.9±0.18a28.3±0.13bβ-转角7.8±0.09a8.6±0.11a无规卷曲52.7±0.16a34.6±0.15b
注:同列肩标字母不同表示差异显著(p<0.05)
Note: Difference letters above same column indicate significant difference (p<0.05)
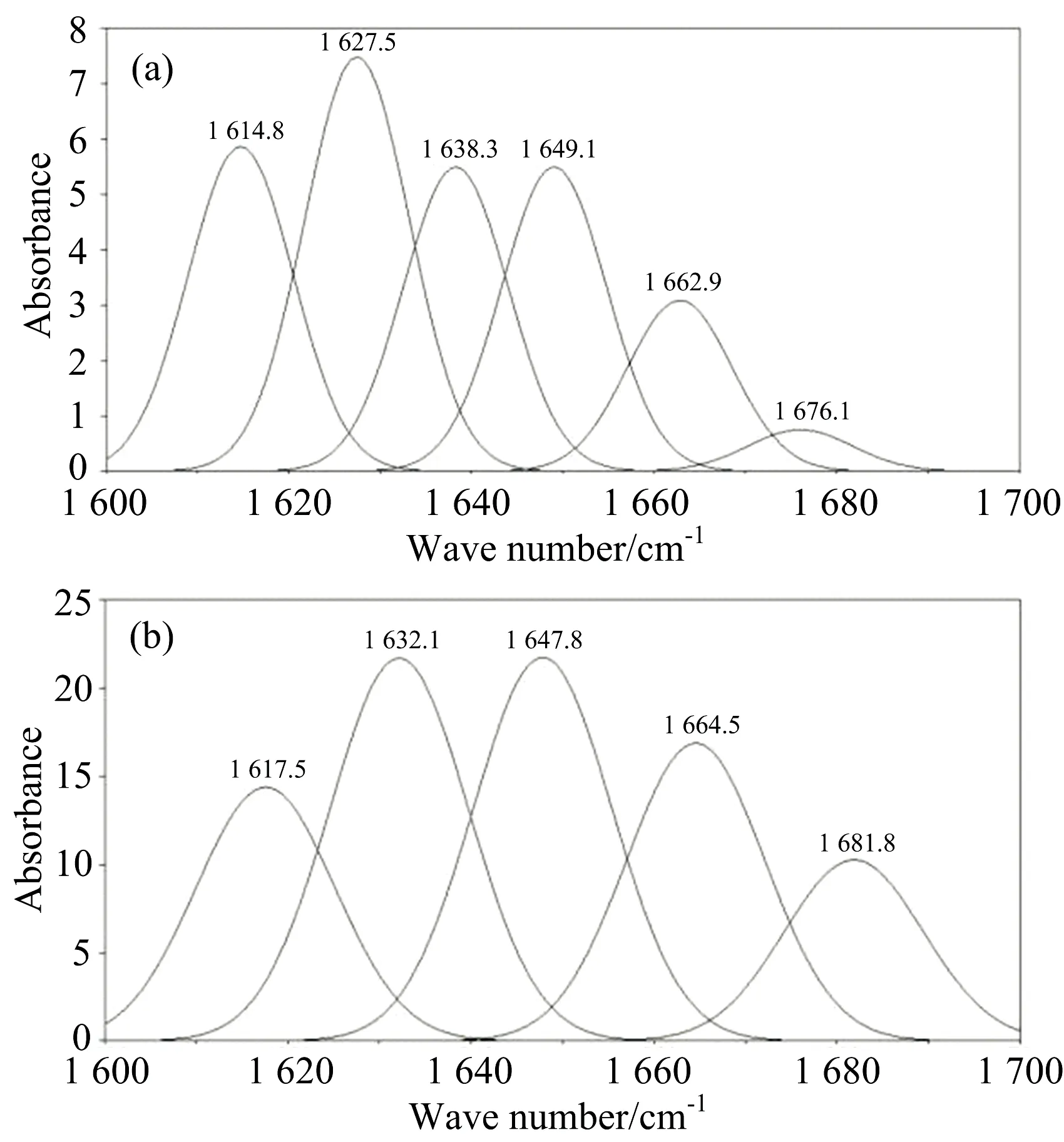
图6 羊乳β-酪蛋白和牛乳β-酪蛋白酰胺Ⅰ带高斯曲线拟合图(a):羊乳β-酪蛋白酰胺Ⅰ带高斯曲线拟合图;(b): 牛乳β-酪蛋白酰胺Ⅰ带高斯曲线拟合图
Fig.6GaussiancurvefittingmapofamideⅠbandsofgoatmilkβ-caseinandbovinemilkβ-casein
(a): Gaussian curve fitting map of goat milk β-casein amide Ⅰ band; (b): Gaussian curve fitting map of bovine milk β-casein amide Ⅰ band
2.3 羊乳和牛乳β-酪蛋白功能性质的测定
2.3.1 羊乳和牛乳β-酪蛋白总疏基和表面疏基含量的测定
表4为羊乳和牛乳β-酪蛋白总巯基和表面巯基含量。从表4可以看出,两种蛋白表面巯基含量相似,但羊乳β-酪蛋白总巯基含量显著低于牛乳β-酪蛋白(p<0.05),这说明羊乳β-酪蛋白的巯基主要以暴露巯基的形式分布于蛋白质分子的表面,其内部巯基含量更低。巯基是蛋白质中重要的功能基团之一,具有较高的生物活性,其可与二硫键在巯基/二硫键氧化还原酶的催化下进行相互转化,羊乳β-酪蛋白胶束内部更低的巯基含量使其内部二硫键含量更少。

表4 羊乳β-酪蛋白和牛乳β-酪蛋白总巯基和表面巯基含量Table 4 Total and surface sulfhydryl content of goat milk β-casein and bovine milk β-casein
注:同列肩标字母不同表示差异显著(p<0.05)
Note: Difference letters in the same column indicate significant difference (p<0.05)
2.3.2 羊乳和牛乳β-酪蛋白溶解性的测定
溶解性可以反映出蛋白质内部结构发生变性和聚集的程度,是蛋白质最重要的物理、化学和功能性质之一。羊乳和牛乳β-酪蛋白在不同pH值条件下的溶解性曲线如图7所示。从图7可以看出,两种蛋白的溶解性具有明显的pH依赖性,且二者等电点(pH为4~5)接近,溶解性曲线均呈现出在接近等电点时溶解性降低,远离等电点时溶解性升高的趋势。
当两种蛋白溶液的pH值在等电点附近时,蛋白分子表面所带的正电荷与负电荷恰好相等,导致蛋白分子与分子间的相互作用力增强,此时羊乳β-酪蛋白比牛乳β-酪蛋白的溶解性低,说明羊乳β-酪蛋白分子表面包含更多的疏水基团;当两种蛋白溶液的pH值远离等电点时(pH 2~4和pH 6~10),蛋白分子则处于酸性或碱性的环境中,此时蛋白质分子带有静电荷,由于静电排斥和离子水化作用,蛋白质分子之间不易聚集,因此溶解性较高,同时,溶液中离子强度的增大使蛋白表面的电荷发生堆积,促进蛋白结构的展开,且结合表4可知,羊乳β-酪蛋白包裹在胶束内部的巯基含量低于牛乳β-酪蛋白,因此这很好的解释了羊乳β-酪蛋白在偏离等电点时溶解性更高的原因。
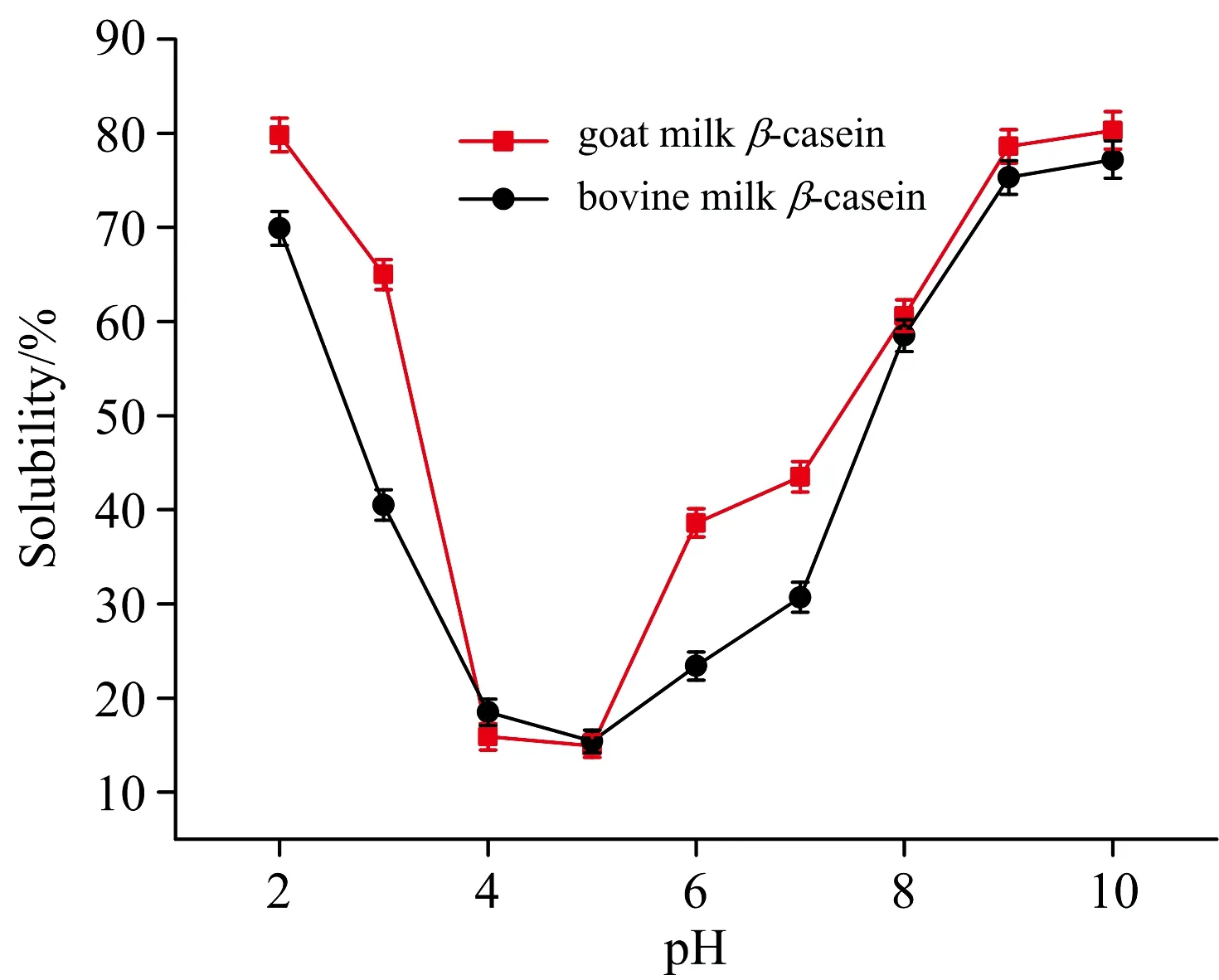
图7 羊乳β-酪蛋白和牛乳β-酪蛋白的溶解性-pH曲线
3 结 论
圆二色光谱和红外光谱检测结果表明:与牛乳β-酪蛋白相比,羊乳β-酪蛋白二级结构中α-螺旋、β-折叠和β-转角的含量更少,无规卷曲含量更高,羊乳β-酪蛋白分子结构更倾向于无序性,蛋白分子的柔韧性更好。
羊乳β-酪蛋白与牛乳β-酪蛋白表面巯基含量相似,但前者总巯基含量显著低于后者,羊乳β-酪蛋白内部巯基含量更低。
羊乳β-酪蛋白和牛乳β-酪蛋白在接近等电点(pH为4~5)时,溶解性降低,远离等电点溶解性升高。在pH 2~4和pH 6~10时,羊乳β-酪蛋白溶解性高于牛乳β-酪蛋白,而在等电点时前者溶解性低于后者,羊乳β-酪蛋白分子与分子间相互作用力更强,分子表面包含了更多的疏水基团。

