益生元对藏灵菇发酵乳细菌多样性和胞外多糖产量的影响
杨铭,郭婷,杜鸿宇,张弛,杨贞耐,朱宏,张健
(1.北京工商大学北京食品营养与人类健康高精尖创新中心,北京100048;2.北京工商大学食品添加剂工程技术研究中心,北京100048;3.北京工商大学食品质量与安全北京实验室,北京100048;4.石家庄君乐宝乳业有限公司,石家庄050221)
0引言
藏灵菇,是由乳酸菌、醋酸菌和酵母菌等多种微生物形成的共生体系[1],是开菲尔传统乳制品发酵剂的优质来源[2]。胞外多糖是藏灵菇的主要活性代谢产物之一,对于藏灵菇颗粒的生长,发酵乳质构的形成,肠道递送过程中微生物活性的保护具有重要作用[3],研究发现藏灵菇胞外多糖具有消炎、抑菌、抗氧化、免疫和肠道菌群调节等多种生物活性[4],是食品功能因子和医药生物材料的研究热点之一[5]。但藏灵菇胞外多糖产量较低限制了其开发和应用[6]。
益生元是一类能够选择性改变微生物群落组成和结构的物质[7]。近期研究发现益生元通过改变发酵食品中微生物的组成和丰度增加胞外多糖产量,在发酵豆乳中加入益生元后戊糖片球菌的活性升高、胞外多糖产量增加了3-4倍[8]。添加乳果糖后酸奶中保加利亚乳杆菌的活菌数增加了2.2 logcfu/mL,黏度显著增加[9]。这与传统的改变碳源调控菌株的糖代谢通路不同,益生元更多的是通过改变微生物群落的构成影响菌株胞外多糖的产量[10]。
实验室前期研究确定了培养温度、底物浓度、接种量、发酵时间等对藏灵菇胞外多糖产量的影响[11],明确了藏灵菇胞外多糖的理化和加工特性[12]。本研究将XOS、GOS、Inulin和FOS等常见的寡糖和多糖益生元作为碳源培养藏灵菇。考察益生元对藏灵菇微生物组成、丰度,胞外多糖产量和发酵特性的影响,以期提高藏灵菇胞外多糖的产量,提升藏灵菇发酵乳的品质和功能性。
1材料与方法
1.1材料与试剂
藏灵菇,采集自西藏林芝牧户(NCBI accession number,PRJNA513828);脱脂乳粉,新西兰恒天然乳业集团;低聚木糖、低聚半乳糖、菊粉、低聚果糖,美国Sigma公司;三氯乙酸(TCA)、无水乙醇、苯酚、浓硫酸、分析纯试剂,国药集团化学试剂有限公司;离子交换柱填料DEAE-Sepharose Fast Flow英国Waterman公司;Sepharose CL-6B层析柱填料,瑞典Amersham Bioscience公司;透析袋(8 000~14 000 D),北京鼎国生物技术有限公司。
CR 21GⅢ立式高速冷冻离心机,日本HITACHI公司;MLS-3750高压蒸汽灭菌器,日本三洋公司;U 3900紫外分光光度计,日本HITACHI公司;S20数显pH计,梅特利-托利多仪器有限公司;DV-III Ultra黏度计,美国Brookfield公司;THZ-D电热恒温培养箱,上海一恒仪器科技有限公司;DNA提取试剂盒,德国Qiagen公司;2.5L厌氧培养盒,日本三菱化学公司。
1.2实验方法
1.2.1酸奶的制备和益生元的添加
以115℃灭菌15 min后的脱脂乳为基质,按5%的比例将活化好的藏灵菇接种到每组灭菌的脱脂乳培养基中,再向各组乳中分别添加1.5%XOS、1.5%GOS、1.5%Inulin、1.5%FOS,于37℃分别在有氧及无氧条件下发酵酸奶。(有氧条件为用除菌膜封口在空气状态下培养,其中氧气浓度约为21%;无氧条件是使用厌氧培养盒培养)
1.2.2 p H值的测定
采用p H计直接测定的方法。
1.2.3黏度的测定
用旋转式黏度计直接测定,参数设置参考曹永强等[13]的研究方法。使用LV34转子,转速为5 r/min,采样点间隔5 s,扫描时间2 min。每个样品平行测定三次,取平均值。
1.2.4胞外多糖的提取及含量的测定
胞外多糖的提取参考曹永强等[14]的方法,将活化好的藏灵菇按3%(v/v)的接种量接种到脱脂乳培养基中,在37℃下培养24 h。向发酵液中加入80%(m/v)的三氯乙酸(TCA)溶液至终浓度为4%(m/v),室温下搅拌2 h,10 000×g 4℃离心45 min,去除细胞和蛋白。取上清液并加入两倍体积的无水乙醇(95%),于4℃冷藏静置12 h,10 000×g 4℃离心45 min。沉淀用蒸馏水溶解,装入分子截流量为8 000~14 000 Da的透析袋中透析48 h,每8 h换一次蒸馏水。再经浓缩、冷冻干燥制得粗多糖。使用DEAE-Sepharose Fast Flow离子交换柱和Sepharose CL-6B凝胶柱对粗多糖层析纯化。
1.2.5菌群组成和丰度的测定
参考郝晓娜[15]的16SrRNA测定菌群组成多样性的方法,采用试剂盒QIAamp DNA Stool Mini Kit提取酸奶样品中的总DNA,用0.8%琼脂糖凝胶电泳检测提取DNA的质量,同时采用紫外分光光度计对DNA进行定量分析。对稀释后的DNA基因组使用Q5高保真DNA聚合酶进行PCR扩增,PCR扩增产物交由美吉生物公司进行测序和序列数据整理,组成和丰度数据的统计分析由实验室自己完成。
1.2.6菌群丰度影响的关联分析
菌群种类作为变量,添加益生元的种类和通氧量作为环境因素,每个在有氧或无氧条件下添加益生元的发酵乳作为样本。采用CANOCO 4.5统计分析软件对数据进行分析。
1.3数据统计
采用SPSS13.0软件进行数据统计处理,p<0.05表示差异显著,p>0.05表示差异不显著。应用CANOCO 4.5统计分析软件对发酵乳中菌群进行冗余分析(Redundancy analysis,RDA)。
2结果与分析
2.1益生元对藏灵菇胞外多糖产量的影响
为了考察XOS,GOS,Inulin和FOS 4种益生元对藏灵菇胞外多糖产量的影响,研究分别将4种益生元加入藏灵菇发酵乳中,在有氧和无氧条件下发酵48 h后,检测发酵乳中胞外多糖含量。结果如图1所示,4种益生元均能够显著增加藏灵菇胞外多糖的产量(P<0.05),大小依次为XOS>GOS>FOS>Inulin。氧气对藏灵菇胞外多糖的产量也存在较大影响,且对不同益生元组藏灵菇胞外多糖的影响不同。综合来看,无氧条件下XOS的产量最高达2117.55 mg/L,是对照组(未添加益生元)的16.9倍,也高于实验室之前的报道的藏灵菇胞外多糖产量[11]。GOS组和FOS组有氧发酵的胞外多糖产量高于无氧发酵,Inulin组在有氧和无氧条件下的胞外多糖产量差异不显著(P>0.05)。表明不同益生元对藏灵菇胞外多糖产量的影响与是否厌氧发酵有关,这可能是藏灵菇中需氧菌和厌氧菌在有氧和无氧条件下益生元代谢发生了变化。
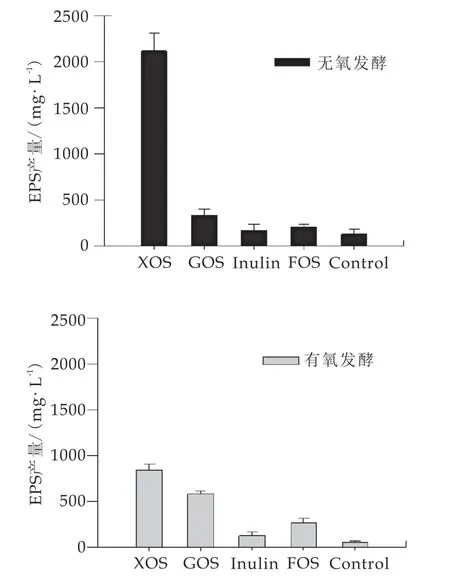
图1益生元对藏灵菇胞外多糖产量的影响
2.2益生元对藏灵菇发酵乳细菌组成的影响
益生元是现代菌群微生态调节的重要功能因子[16]。为明确在有氧和无氧条件下,益生元对藏灵菇微生物组成的影响,采用宏基因组学方法,针对细菌基因组16s DNA V3-V4区,研究了4种益生元对藏灵菇细菌组成和丰度的影响。结果如图3所示,藏灵菇中共鉴定出细菌12属(个别鉴定到种),与国内外报道的一些藏灵菇和开菲尔的细菌种属一致[17-19]。4种益生元对藏灵菇的12个属的细菌均表现出调节能力,调节后组间丰度最大差异(△A,△A=Abundancemax-Abundancemin)较高的属包括Lactobacillus sp.(△A=44%),Leuconostoc sp.(△A=23%),Lactococcus sp.(△A=13%),Weissella sp.(△A=10%)和Streptococcus sp.(△A=9%)。采用无氧培养时,4个益生元组的细菌种类减少为9个属,Acetobacter sp.、Shewanella sp.和Pseudomonas sp.菌无法检出。无氧和有氧条件下受益生元影响较大的菌群有,XOS组无氧条件下最高菌群为Lactobacillus bulgaricus丰度57%,有氧条件下Lactobacillus bulgaricus下降-25%,Weissella sp.和Acetobacter sp.属菌群丰度比无氧条件增加+20%和+9%,推测XOS组厌氧条件下胞外多糖产量高可能这些菌的丰度变化有关。其它益生元组菌群丰度变化相对较小,无氧和有氧条件相比GOS组Shewanella sp.(+11%),Pseudomonas sp.(-10%)丰度变化较大;Inulin组Lactobacillus sp.(-15%)和Acetobacter sp.(+12%)丰度变化较大;FOS组Lactobacillus sp.(-7%)、Lactobacilluskefiri(+10%)、Leuconostoc sp.(+15%)和Shewanella sp.(+14%)丰度变化较大。
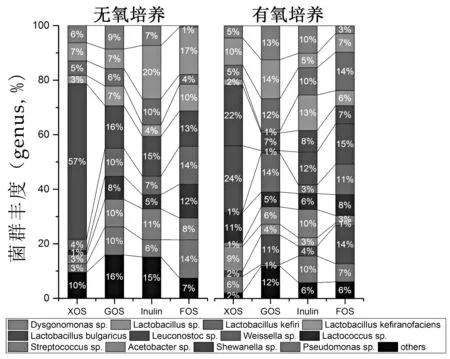
图3益生元对藏灵菇发酵乳细菌多样性的影响
2.3益生元对藏灵菇菌群组成影响的冗余分析
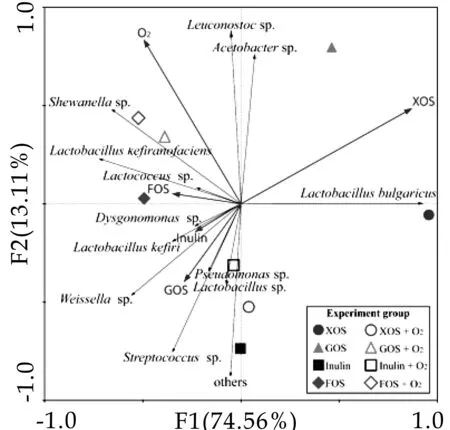
图4菌群丰度与影响因素的冗余分析
为了进一步明确益生元的种类和氧气对于藏灵菇发酵乳中的微生物多样性的影响,对发酵乳中微生物多样性与益生元、氧气进行了冗余分析(RDA)。首先对样品数据进行去趋势对应分析,分析结果显示样本梯度长度最大值为1.279。根据Smilauer[20]等的方法,当梯度长度最大值小于3时,适于线性模型RDA线性模型法分析。结果如图4所示,图中箭头代表对发酵乳不同的影响因素,其方向代表该因素对发酵乳中微生物多样性影响的取向,长短代表对微生物种类影响的大小。横纵坐标分别代表各排序轴对物种数据的解释量。在有氧的情况下,Acetobacter sp.、Leuconostoc sp.、Shewanella sp.、Lactococcus sp.、Lactobacillus kefiri生长较好,这可能与它们的需氧和微需氧特性有关,氧气和益生元促进了其增殖[21]。而其余的六个菌属可能更适合在无氧的条件下协同生长。同时可以看出,在氧气和XOS的共同作用下,藏灵菇发酵乳中醋酸杆菌和明串珠菌的生长情况显著优于在无氧情况下生长情况,这与菌群丰度的定量分析结果一致,结合胞外多糖产量的数据可推测这两种菌株可在有氧条件下产生大量的胞外多糖,而无氧的条件更适合保加利亚乳杆菌生长并代谢产生大量胞外多糖,实验室也利用纯培养方法在XOS培养的藏灵菇中分离出了一株产胞外多糖的保加利亚乳杆菌KW14-3。此外,仅考虑益生元对藏灵菇菌群多样性的影响,FOS对藏灵菇中Shewanella sp.、Lactobacillus kefiranofaciens和Lactococcus sp.生长促进作用较强;Inulin对Lactobacillus kefiri、Dysgonomonas sp.和Shewanella sp.的生长促进作用较强;GOS对Pseudomonas sp.、Lactobacillus sp.和Streptococcus sp.生长促进作用较强。
无论是在有氧还是无氧的条件下,RDA分析图中益生元射线的指向和长度表明,XOS对藏灵菇发酵乳菌群的调节作用与GOS、Inulin和FOS的调节作用有较大差异,后三种益生元对于菌群的调节作用较为接近。这可能是加入XOS的发酵乳中胞外多糖产量显著高于其他三组的原因。
2.4益生元对藏灵菇发酵乳p H和黏度的影响
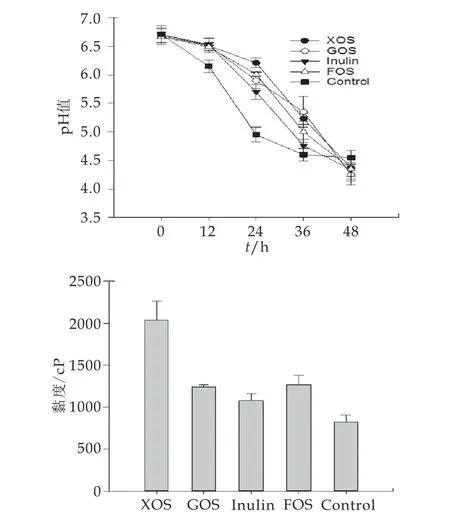
图5无氧条件下发酵益生元对藏灵菇发酵乳黏度的影响
鉴于无氧发酵藏灵菇的胞外多糖产量最高,实验考察了无氧条件下益生元对藏灵菇发酵乳p H和黏度的影响,结果如图5所示,添加了4种益生元的发酵乳的pH值均随时间的延长而下降,对4条曲线进行线性拟合,斜率(k)为最大p H下降速度,则k XOS=-0.042,k GOS=-0.0418,k Inulin=-0.0524,k FOS=-0.0487和k Control=-0.0597可知添加益生元后藏灵菇发酵乳的pH下降速率变慢,发酵终点的pH值低于未添加组。蒋萌蒙等[22]在添加木糖醇、菊粉、低聚果糖、低聚麦芽糖4种益生元对酸乳的影响的研究中也得到了相似的结论,即益生元的添加有利于酸奶的发酵及p H值的下降。益生元中Inulin的pH下降速度最快,Inulin的趋势与已报道的结论相同,另外3种益生元的趋势与Farinha等人[23]的结果不一致,这可能是由于本实验中的厌氧条件和培养基组成差异造成的。发酵终点添加了FOS的发酵乳的pH值最低,为4.10。但各组样品的最终pH差异并不显著(P>0.05)。
发酵乳的黏度是评价其感官性状的重要指标,益生元的添加可提高发酵乳的黏度赋予发酵乳粘稠浓厚的口感[24]。由图5可知,在有氧发酵条件下,添加了不同种益生元对发酵乳的黏度产生了显著影响(P>0.05),其中添加了XOS的发酵乳的黏度最高为2038 cp,这与XOS组胞外多糖产量最高结果相一致,胞外多糖能够提高发酵乳的黏度和结构稳定性[25]。添加了Inulin的发酵乳的黏度最低为1077 cp,但与对照组相比,添加益生元均能有效改善藏灵菇发酵乳的黏度特性。
3结论
益生元是现代菌群微生态调节的重要功能因子。以往的研究多集中于益生元对肠道菌群的影响,而对发酵乳中菌群调节作用的研究较少。实验比较了XOS、GOS、Inulin和FOS 4种益生元对藏灵菇菌群和胞外多糖的产量影响。无氧条件下XOS会促进藏灵菇中Lactobacillus bulgaricus菌株增殖为优势菌群(丰度57%),降低Weissella sp.(-20%)和Acetobacter sp.(-9%)菌群丰度,使得藏灵菇发酵乳中的产量达2117.55 mg/L,是对照组(未添加益生元)的16.9倍。GOS、Inulin和FOS有氧发酵条件下,也分别通过对藏灵菇菌群丰度的调节(Shewanella sp.、Lactobacillus kefiranofaciens、Lactococcus sp.、Lactobacillus kefiri、Dysgonomonas sp.、Pseudomonas sp.、Lactobacillus sp.和Streptococcus sp.)使藏灵菇胞外多糖的产量分别增加了11.62倍、2.52倍和10.06倍。对藏灵菇发酵乳的pH和黏度分析显示,添加益生元减慢了pH下降速度,但降低了发酵终点的p H值。添加XOS、GOS、Inulin和FOS 4种益生元发酵乳的黏度分别增加2.48倍、1.51倍、1.31倍和1.54倍。研究表明XOS、GOS、Inulin和FOS益生元能够通过改变藏灵菇的菌群构成,增加藏灵菇胞外多糖产量,改善藏灵菇发酵乳的品质。本研究为应用益生元改善天然复合发酵剂菌株构成,提高发酵乳品质提供理论依据。

