均三乙苯的合成研究
马婉莹,张风雨,丁 茯,王东平,2
(1.沈阳化工大学 化学工程学院, 辽宁 沈阳 110142; 2.大连理工大学 精细化工国家重点实验室, 辽宁 大连 116024)
多烷基芳烃1,3,5-三乙苯(均三乙苯)具有较高的沸点(215 ℃)、稳定的化学性质,可以作为高温反应的溶剂.均三乙苯作为原料可以通过Blanc溴甲基化反应制备三溴甲基化产物1,3,5-三溴甲基-2,4,6-三乙苯[1],继而可以容易地引入各种官能化基团,其中3个乙基位于苯环平面的同一侧面,引入的3个官能化基团位于苯环的另一个侧面,从而得到具有特定功能的树枝状、笼状、杯状化合物等,可用于分子识别[2]、生化[3]以及超分子化学[4]等;其二溴甲基化产物也可用于合成多金属核圆形螺旋体[5].目前,市售的均三乙苯主要通过苯与溴乙烷的傅克烷基化反应得到,然而生成1分子均三乙苯的同时,该反应还产生了3分子的氢溴酸,对环境造成较大的污染[1].此外,均三乙苯还可以通过InCl3催化的丁炔三聚环化反应获得,然而该反应需要用到相对于丁炔1/3(摩尔比)的助剂2-碘苯酚,由此造成分离困难和较高的成本[6].从经济环保的角度出发,上述两种方法均有局限性.因此,需要开发更为经济、环保的均三乙苯生产工艺.
乙苯是重要的石油化工原料,主要用于生产苯乙烯.烷基化法生产乙苯和苯乙烯的工艺将导致我国每年产生高达数十万吨的副产物多乙苯.我国苯乙烯生产过程中产生的主要副产物是多乙苯.多乙苯主要由重芳烃二乙苯(质量分数为91.6 %,其中邻、间、对质量分数为分别为3.85 %、60.43 %、27.32 %)、三乙苯(质量分数为3.75 %)和四乙苯(质量分数为1.83 %)构成.目前,综合利用多乙苯资源的途径单一、技术难度大,其中的主要途径是通过吸附分离获得具有较高经济价值的对二乙苯[7].本文开拓了综合利用多乙苯资源的其他途径,通过路易斯酸催化的烷基化、异构化、歧化反应,将上述多乙苯转化为均三乙苯,其中在合成1分子均三乙苯时仅产生1分子的氢溴酸,工艺更为经济、环保.
1 实验部分
1.1 主要试剂和仪器
苯(AR)、溴乙烷(AR)、无水三氯化铝(AR)、混合二乙苯(AR,邻、间、对摩尔分数分别为2.08 %、78.86 %、18.38 %)和间二乙苯(AR),国药集团化学试剂有限公司;1,2,4-三乙苯,上海阿拉丁生化科技股份有限公司;1,2,4,5-四乙苯,萨恩化学技术(上海)有限公司;薄层层析硅胶板,烟台江友硅胶开发有限公司.ARX-500核磁共振仪,CDCl3溶剂,TMS内标,Bruker;安捷伦气相色谱仪(7890A),色谱柱,美国安捷伦公司,型号KB-WAX,30 m×0.32 mm×0.50 μm,柱箱温度150 ℃,进样器温度250 ℃,FID检测器,检测温度为300 ℃,载气为氮气,流量25 mL/min,采用面积归一化法计算.
1.2 合成路线
合成路线如图1所示.
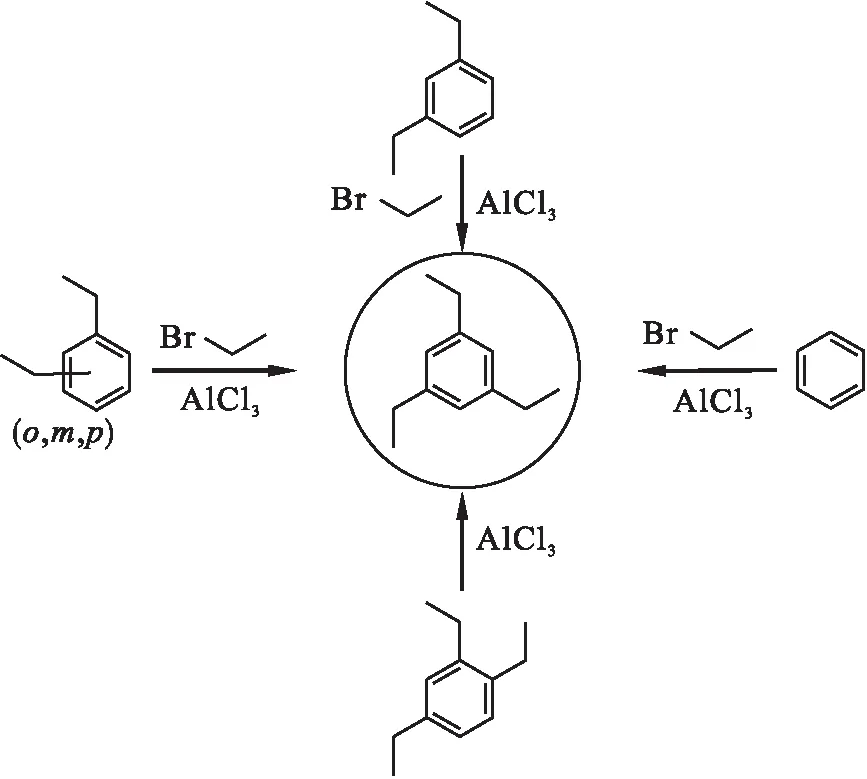
图1 合成路线Fig.1 Synthesis route
1.2.1 以苯为原料的均三乙苯的合成
根据文献[1]方法,将无水三氯化铝(1.33 g,0.01 mol)加入到连有酸性气体吸收装置的装有温度计的四口圆底烧瓶中,并将反应瓶置于冰水浴中冷却.边搅拌边滴加溴乙烷(22.88 g,0.21 mol),然后缓慢滴加苯(7.81 g,0.1 mol).待泡沫消失后,滴加剩余的溴乙烷(10.90 g,0.1 mol).移除冰水浴,反应自然升温到室温,并反应12 h.将反应混合物倒入冰水混合物中,然后用二氯甲烷萃取.分离有机相,无水硫酸钠干燥、过滤、浓缩得黄色油状物.用微量蒸馏器减压蒸馏,得到无色透明油状物均三乙苯(14.67 g),摩尔产率90.4 %.薄层色谱层析Rf(TLC)=0.8[V(正己烷)∶V(二氯甲烷)=10∶1].1H-NMR(500 MHz,CDCl3)∶δ=1.25 (t,9H),2.63 (q,6H),6.89 (s,3H).13C-NMR(125 MHz,CDCl3)∶δ=15.7,28.9,124.9,144.3.
1.2.2 以间二乙苯和混合二乙苯为原料的均三乙苯的合成
将Lewis酸催化剂(0.01 mol)加入到连有酸性气体吸收装置的装有温度计的四口圆底烧瓶中,并将反应瓶置于冰水浴中.边搅拌边滴加溴乙烷(11.99 g,0.11 mol),然后缓慢滴加二乙苯(13.42 g,0.1 mol).待泡沫消失后,将反应保持一定温度,并用气相色谱仪监测反应.反应完毕后,将反应混合物倒入冰水混合物中,然后用二氯甲烷萃取.此后的处理过程同1.2.1,得到无色透明油状物均三乙苯.
1.2.3 以1,2,4-三乙苯为原料的均三乙苯的合成
将无水三氯化铝(1.33 g,0.01 mol)加入到连有酸性气体吸收装置的装有温度计的四口圆底烧瓶中,并将反应瓶置于冰水浴中冷却.边搅拌边缓慢滴加1,2,4-三乙苯(16.22 g,0.1mol).移除冰水浴,反应自然升温到室温,并用气相色谱仪监测反应.反应完毕后,将反应混合物倒入冰水混合物中,然后用二氯甲烷萃取.此后的处理过程同1.2.1,得到无色透明油状物均三乙苯(14.42 g),摩尔产率88.9 %.
2 结果与讨论
2.1 均三乙苯的合成
2.1.1 以苯为原料的均三乙苯的合成
根据文献[1]方法,在Lewis酸AlCl3催化下,苯与溴乙烷发生傅克烷基化反应,生成了1,3,5-三乙苯,核磁氢谱与文献[6]中所报道的一致.如图2所示,在该反应中,随着溴乙烷滴加完毕,几乎所有的原料苯都转化为多取代的烷基苯.然后随着反应进行,二乙苯的含量逐渐降低;1,2,4-三乙苯和1,2,4,5-四乙苯的含量在前9 h几乎不变,但是在二乙苯反应完毕时,二者的含量略微降低;产物均三乙苯的含量一直增加,直到反应完毕.在整个反应过程中,动力学产物1,2,4-三乙苯的含量一直很低.这很可能是因为傅克烷基化反应是可逆的,在强活性催化剂AlCl3的作用下,生成的1,2,4-三乙苯迅速发生歧化反应生成1,2,4,5-四乙苯和间二乙苯,然后前者发生失烷基化反应,后者发生再烷基化反应,生成具有较低位阻的热力学稳定的产物均三乙苯;此外,1,2,4-三乙苯还可能发生异构化反应生成均三乙苯.
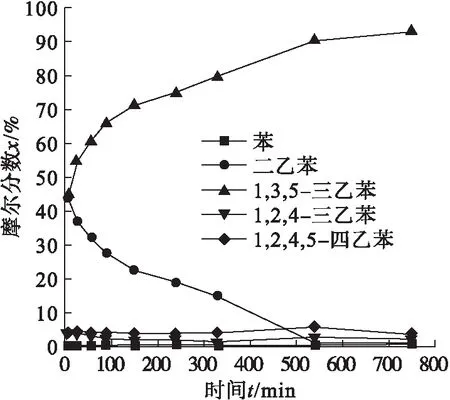
图2 反应时间对反应的影响Fig.2 The effect of reaction time on reaction
2.1.2 以间二乙苯为原料的均三乙苯的合成
在上述苯与溴乙烷的傅克烷基化反应中,生成1分子均三乙苯的同时,还生成了3分子的氢溴酸,对环境污染较大.根据图2所示,二乙苯可以与溴乙烷继续反应生成均三乙苯.因此,接下来研究工业副产物多乙苯与溴乙烷的傅克烷基化反应.多乙苯中,二乙苯的含量超过90 %(质量分数),其中间二乙苯的含量又超过了一半,因此,首先以间二乙苯为模型底物研究其与溴乙烷的傅克烷基化反应.
2.1.2.1 催化剂的影响
在傅克烷基化反应中,许多Lewis酸和质子酸均可以用做催化剂.然而在间二乙苯与溴乙烷的傅克烷基化反应中,在室温、相同的反应条件下只有强Lewis酸AlCl3可以催化反应,使反应顺利进行.中等强度的Lewis酸SnCl4、弱Lewis酸TiCl4和ZnCl2以及质子酸浓H2SO4都没有催化效果.因此,效力最强的Lewis酸AlCl3被选做该反应的优选催化剂.
2.1.2.2 温度的影响
冰浴下加料完毕,分别将反应升至室温和保持在0 ℃,研究温度对反应的影响.如图3所示,在室温下,原料间二乙苯在10 min时就几乎转化完毕,在2.5 h时反应完毕.如图4所示,在0 ℃下,反应需要9 h才能反应完.考虑到能耗以及操作的难易程度,反应温度优选为室温.

图3 室温下反应时间对反应的影响Fig.3 The effect of reaction time on reaction at room temperature
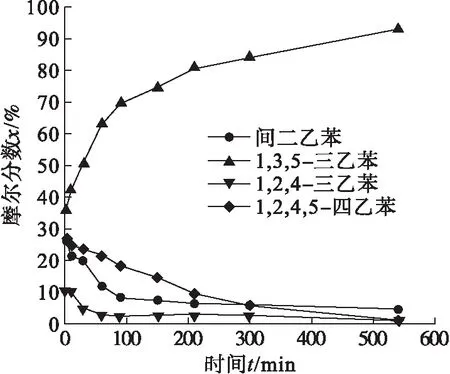
图4 0 ℃下反应时间对反应的影响Fig.4 The effect of reaction time on reaction at 0 ℃
由图4可以清晰地发现:在间二乙苯与溴乙烷的反应过程中,除产物均三乙苯外,还有两个中间体:1,2,4-三乙苯和1,2,4,5-四乙苯.这两个中间体的含量随着反应进行逐渐降低,即在傅克烷基化反应的历程中,经历了这两个中间体阶段.
2.1.3 以混合二乙苯为原料的均三乙苯的合成
以间二乙苯为原料的傅克烷基化反应能够顺利进行,并且取得了超过90 %的摩尔转化率.工业副产物多乙苯含有的二乙苯则是邻、间、对二乙苯的混合产物,分别为3.85 %、60.43 %、27.32 %(质量分数),因此,采用市售的混合二乙苯(邻、间、对摩尔分数分别为2.08 %、78.86 %、18.38 %)为底物模型,进一步优化反应条件.
2.1.3.1 催化剂用量对反应的影响
由表1可知:随着催化剂AlCl3的摩尔比从0.05增加至0.15,反应时间从3.5 h缩短到1.5 h,摩尔产率也从88.6 %增加到93.2 %.然而,当催化剂的摩尔比进一步增加至0.2时,反应时间和产率几乎没有变化.因此,反应的优选催化剂用量为n(AlCl3)/n(二乙苯)=0.15.
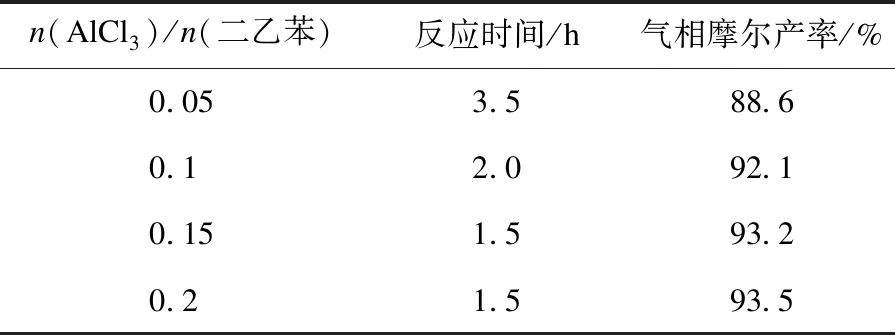
表1 催化剂用量对反应的影响Table 1 The effect of catalyst amount on reaction
反应条件:二乙苯为0.1 mol,溴乙烷为0.11 mol,室温.
2.1.3.2 溴乙烷与二乙苯摩尔比对反应的影响
由表2可知:随着溴乙烷与二乙苯摩尔比的增加,反应时间从2 h缩短到1.5 h,然后保持不变;摩尔产率则先由91.5 %增加到93.4 %,随后当摩尔比进一步增加时,产率则明显地降低.这是因为过量的溴乙烷与产物均三乙苯继续反应生成四乙苯,从而导致产率下降.因此,溴乙烷与二乙苯摩尔比优选为1.1.

表2 溴乙烷与二乙苯摩尔比对反应的影响Table 2 The effect of mole ratio of EtBr/ diethylbenzene on reaction
反应条件:二乙苯为0.1 mol,AlCl3为0.015 mol,室温.
由以上研究可知,溴乙烷与二乙苯进行反应的优选反应条件为:AlCl3作为催化剂,摩尔比n(二乙苯)∶n(溴乙烷)∶n(AlCl3)=1∶1.1∶0.15,室温,反应时间为1.5 h.该反应生成1分子均三乙苯的同时,只生成了1分子的氢溴酸,明显降低了对环境的污染.
2.2 多乙苯与溴乙烷的反应机理
2.2.1 以1,2,4-三乙苯为原料的均三乙苯的合成
在2.1.2研究中,1,2,4-三乙苯作为反应的中间体存在于反应过程中,为了研究反应的机理,需将1,2,4-三乙苯作为反应底物,研究其在催化剂AlCl3存在下的转化情况.此外,工业多乙苯中含有3.75 %(质量分数)的1,2,4-三乙苯,因此,也有必要研究其在Lewis酸存在下的转化规律.
如图5所示,随着反应进行,原料1,2,4-三乙苯的含量逐渐降低;歧化产物1,2,4,5-四乙苯和间二乙苯的含量先升高至最高点,然后逐渐降低,并且变化趋势基本一致;产物均三乙苯的含量一直升高,直至反应结束.因此,这是一个典型的连串反应,即1,2,4-三乙苯通过歧化反应生成中间体1,2,4,5-四乙苯和间二乙苯,然后通过去乙基化和再乙基化反应等生成均三乙苯.此外,1,2,4-三乙苯也可能通过异构化反应直接生成均三乙苯.
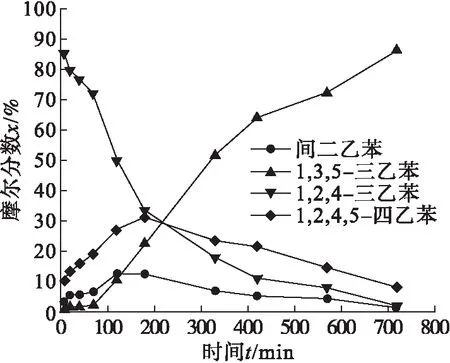
图5 反应时间对反应的影响Fig.5 The effect of reaction time on reaction
2.2.2 反应机理
根据前述研究,由二乙苯制备均三乙苯的反应机理如图6所示.多乙苯由含量最多的间二乙苯代表,由于乙基是给电子的邻对位定位基,间二乙苯在高活性催化剂AlCl3作用下首先生成动力学控制的产物1,2,4-三乙苯,然后氢质子进攻苯环,使得邻接乙基活化并转移,从而完成异构化生成均三乙苯[见图6(a)].此外,反应生成的1,2,4-三乙苯,在催化剂AlCl3作用下还可以发生歧化反应,生成1,2,4,5-四乙苯和间二乙苯,前者被氢质子进攻,使得乙基活化并断裂生成1,2,4-三乙苯;前述断裂的乙基进攻间二乙苯,并脱掉质子生成均三乙苯[见图6(b)].
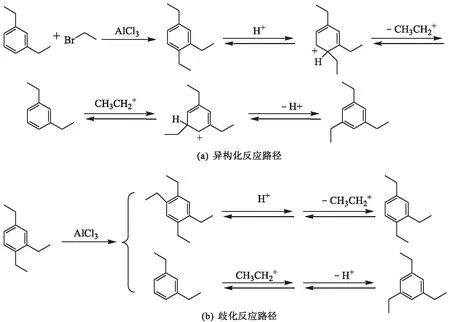
图6 反应路径Fig.6 Reaction path
3 结 论
以混合二乙苯和1,2,4-三乙苯为模型底物,研究了多乙苯与溴乙烷的反应,优选的反应条件为:AlCl3作为催化剂,n(二乙苯)∶n(溴乙烷)∶n(AlCl3)=1∶1.1∶0.15,室温,反应时间为1.5 h.该反应在产生1分子均三乙苯时仅排放出1分子的氢溴酸,对环境污染相对较小.多乙苯制备均三乙苯的反应路径是:(1)二乙苯发生傅克烷基化反应生成三乙苯,随后通过异构化/歧化反应生成热力学稳定的产物均三乙苯;(2)中间体四乙苯通过脱烷基化反应、异构化反应等生成均三乙苯.

