三例胆囊神经内分泌癌的病理特点及诊疗体会
杜洋,范培芝,钟振东,朱岱阳,刘剑鸣,易为民,彭创,孙增鹏,刘苏来
(湖南师范大学附属第一医院/湖南省人民医院,湖南 长沙 410002,1.普外三科,2.肝胆外科)
胆囊神经内分泌癌(gallbladder-neuroendocrine carcinomas,GB-NECs)是一种非常罕见的疾病,发病率仅占所有神经内分泌肿瘤的0.2%~0.5%[1]。其中,GB-NECs分化程度低且高度恶性,确诊通常是通过术后病理检查及免疫组化。GB-NECs临床特点与胆囊腺癌相似,早期临床表现无特异性,很难早期诊断,恶性程度高,易进展和复发,预后差。现收集2015年5月至2019年5月期间湖南师范大学附属第一医院肝胆外科收治的3例GB-NECs临床资料,并对其病理特点及诊疗预后进行总结,以提高对GB-NECs的临床诊疗经验。
1 临床资料
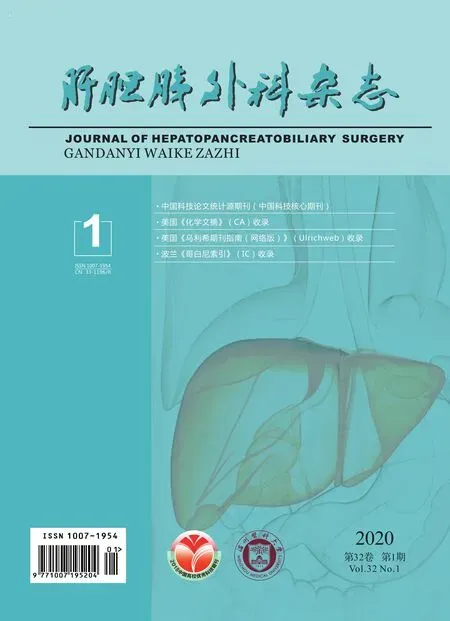
病例1:患者女性,52岁,因“反复右上腹疼痛6个月,再发加重4 d”于2015年5月18日入院。既往行“右肾切开取石术”及“甲状腺结节切除术”。查体:腹平坦,右侧腰背部可见约15 cm长手术瘢痕,右上腹压痛,肝区叩击提示右上腹疼痛。实验室检查示:糖类抗原CA19-9、糖类抗原CA125、癌胚抗原(carcino-embryonic antigen,CEA)、甲胎蛋白(alpha-fetoprotein,AFP)等正常。腹部彩超示:肝内近胆囊处高回声结节性质待查考虑占位肝Ca累及胆囊?其他不排;胆囊内声像考虑胆囊多发结石胆囊炎;胆总管下端声像 考虑胆总管先天性囊状扩张。主要诊断:(1)胆囊占位:胆囊癌?(2)肝内包块性质待查:胆囊癌肝转移?(3)胆囊结石伴胆囊炎;(4)胆总管扩张(图1)。于2015年5月27日行胆囊癌根治术+胆总管探查+T管引流术,术中可见胆囊壁增厚达1 cm,灰白实性质硬,与肝脏有明显纤维间隔,肝脏处可见一6.0 cm×3.5 cm×2.5 cm肿块,灰白实性质中。病理检查示:肝脏组织及胆囊NETs G3级,胆囊高-中分化腺癌,弥漫分布于胆囊壁全层,未侵犯肝脏,胆囊切缘净。免疫组化及特殊染色:NETs G3:突触素(synaptophysin,Syn) (+),嗜铬粒蛋白A(chromogranin A,CgA) (+),CK19(+),CK7(-),p53(++),Ki-67(+)75%;胆囊高-中分化腺癌:突触素(Syn) (-),嗜铬粒蛋白A(CgA) (-),CK19(+),CK7(+),p53(+),Ki-67(+)50%;癌胚抗原(CEA)(±);CD34血管(+);PAS(-)。具体见图2。

图1 病例1腹部彩超:示肝内近胆囊处探及一约38 mm×35 mm高回声结节,形态规则,边界不清,与胆囊分界不清,内部回声不均匀;肝内可见数个稍高回声结节,形态规则,边界尚清,内部回声不均匀
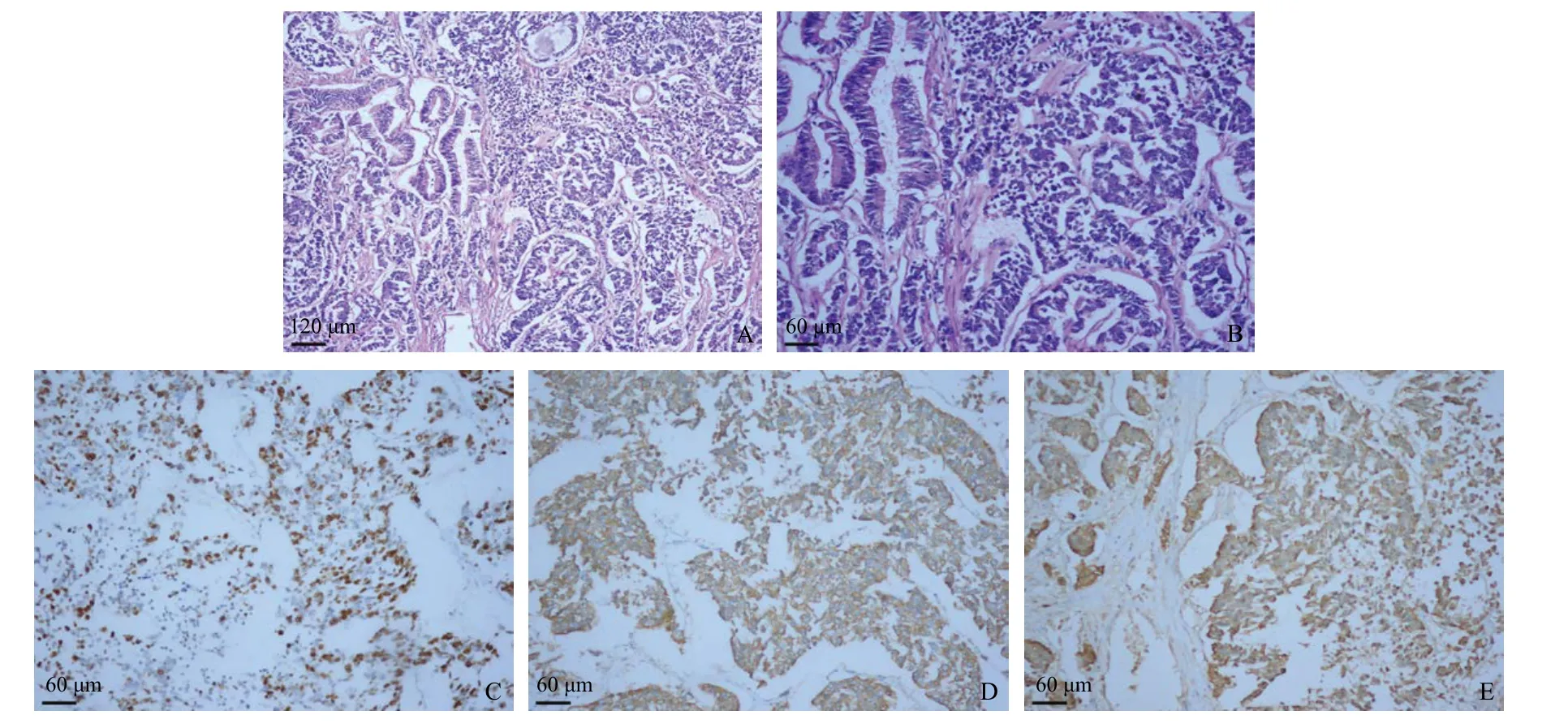
图2 病例1病理HE染色和免疫组化结果
病例2:患者女性,63岁,因“皮肤黄染、纳差、尿黄10 d”于2018年9月2日入院,既往体健。查体:肝区叩击提示右上腹疼痛。实验室检查:甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原CA125等未见异常。糖类抗原CA19-9:40.76 U/mL↑。腹部CT增强示:肝门区软组织肿块并肝内胆管扩张,性质待定,考虑胆管癌并胆囊受侵犯可能性大,上腹部CTA及CTV未见明显异常。腹部MRI示:肝门区及胆囊颈部异常信号灶,性质待定。考虑肝门胆管癌,肝总管受累,累及胆囊颈部并肝内胆管扩张;胆囊癌累及肝门区胆管、肝总管并肝内胆管扩张,肝门区及腹膜后多发淋巴结转移。主要诊断为:(1)肝门胆管癌并侵犯胆囊?(2)胆囊癌侵犯肝门?(3)肝门区及腹膜后多发淋巴结转移癌(图3),于2018年9月19日行腹腔镜胆囊癌根治+肝门部胆管整形+胆肠内引流术,术中可见胆囊颈部及体部处可见一质硬区,大小4.0 cm×3.5 cm×3.0 cm,切面灰白灰黄,实性质硬,与周围组织界限欠清,肉眼未侵及肝脏。病理检查示:(胆囊+肝脏4、5、6段+肝门淋巴结)胆囊混合型腺神经内分泌癌(gallbladder-mixed adeno neuroendocrine carcinomas,GB-MANECs),其中神经内分泌癌约占70%,外分泌癌约占30%;外分泌癌中约15%为中分化管状腺癌,15%为中分化鳞状细胞癌,侵及胆囊壁全层并侵出浆膜面,肝切缘净;胆囊内可见较多脉管内瘤栓及神经侵犯,可见多灶出血坏死,淋巴结(0/12)。免疫组化结果:NECs成分:Ki-67(+85%),p63(-),CK5/6(+),CK7(-),CK20(+),Villin(-),CDX2(-),突触素(Syn) (+),神经元特异性烯醇化酶(neuron-specific enolase,NSE) (-),CD56(+),CK(pan) (-),CD34血管(+)。腺癌成分:Ki-67(+40%),p63(-),CK5/6(+),CK7(+),CK20(-),Villin(+),CDX2(灶状+),CK(pan) (+),CD56(-);特殊染色:VG(+)。具体见图4。

图3 病例2腹部CT
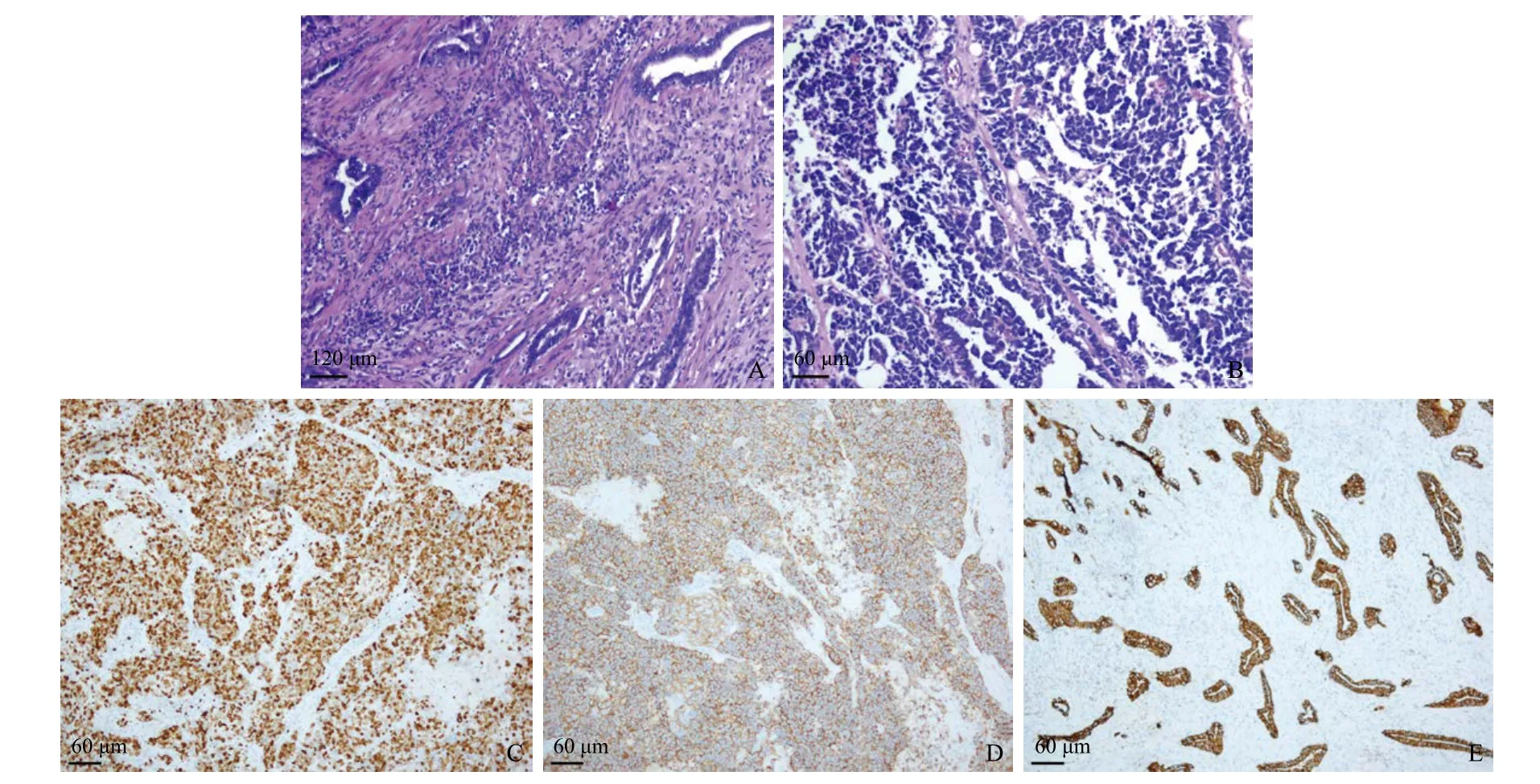
图4 病例2病理HE染色和免疫组化
病例3:患者男性,68岁,因“皮肤巩膜进行性黄染伴畏寒高热10 d余”于2018年10月22入院,既往体健。查体:右上腹深压痛,肝区叩击提示右上腹疼痛。实验室检查示:糖类抗原CA19-9、糖类抗原CA125、甲胎蛋白(AFP)、癌胚抗原(CEA)等未见异常。腹部CT增强示:胆囊、肝门区及肝脏多发病变,考虑胆囊癌累及肝门区胆管及邻近肝实质、肝内转移可能性大,胆囊结石,肝内胆管扩张。主要诊断:(1)梗阻性黄疸:胆囊癌并侵犯肝门、肝转移;(2)胆囊结石并胆囊炎;(3)重症胆管炎(图5)。于2018年10月31日行组织活检穿刺术,穿刺组织呈灰白灰黄絮状物,病理检查示:(肝脏肿块穿刺活检)恶性肿瘤,结合免疫组化考虑NETs G3,较多坏死,结合临床考虑转移。免疫组化及特殊染色结果:CK7(-),CK19(+),CK20(-),Villin(+),Ki-67(+80%),Hepatocyte(-),CD34(血管+),CD56(+),突触素(Syn) (+),嗜铬粒蛋白A(CgA) (+),磷脂酰肌醇蛋白聚糖-3(Glypican-3,GPC-3) (±);PAS(-)。具体见图6。

图5 病例3腹部CT

图6 病例3病理HE染色和免疫组化结果
2 讨论
NETs起源于Kulchitsky细胞(嗜银细胞),是一种较少见的肿瘤,可发生于消化道、肺、子宫颈、膀胱、前列腺、胰腺等多个部位,最常见于胃肠道和呼吸道。GB-NECs以女性多见,好发年龄为50~60岁,男女比例为1:1.6[2]。
GB-NECs的临床表现无明显特异性,右上腹痛是最常见的初期症状,其次是黄疸和消瘦,由于这些症状与一般的胆囊结石、胆囊炎或者胆囊癌临床表现相似,所以很难从术前的B超、CT及MRI等辅助检查直接诊断出。所有GB-NECs的患者中具有类癌综合征表现的不足1%[3],且在本组病例中2例患者有黄疸,1例患者有上腹不适症状,但均无NECs特有的腹泻、皮肤潮红等“类癌综合征”症状。
GB-NECs常用的检查手段包括肿瘤标志物、腹部彩超、CT和MRI等。但糖类抗原CA19-9、糖类抗原CA125等肿瘤标志物指标常为阴性结果,超声检查也只能发现胆囊壁的增厚及胆囊壁的隆起样病变等,CT和MRI检查均难以将其与其他胆囊肿瘤相辨别。总之,术前的影像学检查只有助于初步判断肿瘤的来源和性质,不能确诊肿瘤的类型。影像学检查的意义主要在于早期发现胆囊病变及与病变组织与周围组织关系,以便制定下一步治疗方案。对于GB-NECs的患者,腹部CT多表现为胆囊不规则较大肿块,多侵犯邻近的肝实质,沿胆囊颈、胆囊管生长,同时伴有肝门、腹膜后淋巴结转移及侵犯肝门部脂肪,在动脉期强化程度往往高于或等于肝实质,在静脉期强化程度往往等于或低于肝实质。尽管如此,这种影像学表现也与常见的胆囊腺癌较难区别,本组3例病例在术前均考虑胆囊癌,但术前均未考虑GB-NECs。病例3患者术前CT提示了胆囊癌伴远处肝转移的可能,这也为该患者进一步行姑息治疗而非手术治疗的方案提供了理论依据。
对于GB-NEC的确诊有赖于术后病理免疫组化染色,这对于肿瘤的确诊及分级均有重要的意义,免疫组化中嗜铬粒蛋白(CgA)、突触素(SYN)等指标在NEC中阳性率较高,这也是确诊NEC的主要依据。2010版WHO按NETs的细胞分化程度分为3级:G1,核分裂象数<2和(或)Ki-67指数<2%;G2,核分裂象数2~20和(或)Ki-67指数3%~20%;G3,核分裂象数>20和(或)Ki-67指数>20%[4]。G1级,恶性程度较低,无明显早期转移,故预后一般尚可。由于GB-NECs恶性程度高,进展迅速,确诊时已出现淋巴结和肝脏转移,多数预后不佳。国内外研究指出,Ki-67指数越低、肿瘤体积越小,预后越好。本文中3例患者均为分化较差的NECs、Ki-67指数分别为75%、85%、80%,均为G3级,提示恶性程度较高。
外科手术是首选和最有效的治疗手段,手术方式主要包括单纯胆囊切除术、胆囊切除加肝部分切除术和淋巴结清扫。对于胆囊原位恶性肿瘤(cT1N0M0)或者胆囊恶性肿瘤仅仅侵袭黏膜层、黏膜下层或肌层,可行单纯胆囊切除。对于未发生远处转移的晚期患者,可行胆囊切除加肝部分切除术和淋巴结清扫,术中若发现胆总管明显扩张或者被肿瘤侵犯,可行胆道探查+T管引流或者胆肠内引流术。即使出现局部肝转移也尽可能行根治性切除术或减瘤手术[5],对于根治性切除术或者减瘤手术后的患者,应当按晚期pGB-NECs患者的治疗策略进行全身和局部治疗。本组3例患者中,病例1行开腹胆囊癌根治+胆总管探查+T管引流术,术后未行进一步化疗,患者术后5个月复发转移,最终生存期为8个月;病例2行腹腔镜胆囊癌根治+肝门部胆管整形+胆肠内引流术,术后未行进一步化疗,患者术后约6个月复发转移,存活至今,病例3由于术前CT已经发现肝转移,故未行手术治疗。在行肝转移灶穿刺活检证实为NEC后行GP(吉西他滨+顺铂)化疗4个疗程,疾病进展,最终生存期为3个月。
由于GB-NECs易出现全身转移,因此术后辅助治疗具有重要的作用。GB-NECs根治性切除术后的辅助治疗,由于尚无高级别的循征医学证据,可参考胰腺神经内分泌癌的辅助治疗原则。专家共识中不推荐对于根治术后的G1或G2期NECs患者进行药物辅助治疗,对于根治术后的G3期的患者,即使无淋巴结转移或脉管癌栓等高危因素,也推荐行术后辅助治疗,包括全身治疗或局部放疗,而辅助化疗推荐采用EP(顺铂+依托泊苷)或EC方案(卡铂+依托泊苷)[6]。对于G1、G2行生长抑素受体功能核素显像阳性的患者应考虑行每4周1次的长效生长抑素注射治疗可以提高患者的无病生存期[7]。病例1和病例2术后病理诊断均为GB-NECs G3期,两例患者均行根治术手术治疗,术后本应行进一步化疗,但患者均强烈拒绝行进一步辅助化疗,最终患者分别于术后5个月及6个月复发。这与预期的生存时间有一定的差距,这也证实了术后辅助化疗在GB-NECs治疗中的重要意义。对于有远处转移的GB-NECs患者,全身治疗和局部治疗同时进行往往能改变患者的预后。局部治疗包括射频消融(RFA)、肝动脉化疗栓塞(TACE)及选择性内放射治疗等治疗手段,通过控制肝转移灶,从而有效地减轻肿瘤负荷,减少激素分泌,改善患者的生活质量。全身治疗包括生物治疗(如:ssA,包括奥曲肽等)、全身化疗(如EP方案或EC方案)、生物靶向(如舒尼替尼、依维莫司)、放射性核素治疗(PRRT)。病例3患者虽经肿块穿刺活检诊断为NECs G3期,但由于已发生肝转移,故综合考虑后仅行姑息化疗。从3例患者的生存期可以得出,处在不可切除的GB-NECs且仅行姑息化疗的预后很差。
综上所述,GB-NECs是一种恶性程度高、侵袭性强的恶性肿瘤,临床表现无特异性,诊断主要依赖于术后病理。治疗以胆囊癌根治性切除手术为首选,手术治疗能明显延长患者的生存期,术后联合化疗对患者的生存期在一定程度上有提高作用。然而,由于该疾病发病率很低,相关研究较少,到目前为止还没有普遍接受的规范治疗方法,故仍需要更大样本的进一步研究。