猪链球菌2型灭活疫苗对小鼠的免疫效果评价
段倩倩,毛天骄,韩业芹,韩雪姣,魏建忠,孙 裴,李 郁
(安徽农业大学 动物科技学院,安徽 合肥 230036)
猪链球菌(Streptococcussuis,SS)是一类重要的人兽共患病原菌,不仅可引起猪的关节炎、脑膜炎、败血症、心肌炎和突发性死亡,还能感染相关人员,引起人脑膜炎、感染性休克、甚至死亡,威胁公共卫生及食品安全。根据细胞壁荚膜多糖抗原特性的不同可将其分为35个血清型(1-34型和1/2型),其中1、2、7、9型为致病型,且以猪链球菌2型(Streptococcussuisserotype 2,SS2)的致病性最强,在我国的流行范围最广,且易与其他细菌或病毒混合感染,严重影响养猪业的发展,造成巨大的经济损失[1]。
猪链球菌的防治主要依靠疫苗接种[2]。临床上常用的猪链球菌病疫苗包括灭活疫苗、弱毒疫苗和基因工程亚单位疫苗。弱毒疫苗免疫效果强且持久,但是运输、保存条件要求高,毒力易返祖,安全性差;基因工程亚单位疫苗抗原性差。灭活疫苗具有安全性强、研制周期短、易于保存和运输等优点,在实际生产中被广泛使用[3]。本研究在前期筛选出2株毒力强、抗原性好、遗传稳定的SS2疫苗菌株(HF2、HF3株)并分别制成灭活疫苗(采用ISA 201 VG矿物油佐剂)的基础上,进一步与商品化灭活疫苗(HA9801株,铝胶佐剂)同步免疫小鼠,进行免疫效果评价,从而为猪链球菌病的防控和联合疫苗的研制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 疫苗
猪链球菌2型灭活疫苗(HF2、HF3疫苗)由安徽农业大学动物传染病实验室制备。疫苗所用菌株是由本实验室自临床病例分离鉴定并通过致病性、抗原性、稳定性试验筛选出的2株毒力强、抗原性好、遗传稳定的SS2菌株(HF2、HF3株),佐剂为ISA 201 VG矿物油佐剂。HF2株对昆明鼠和斑马鱼的半数致死量(median lethal dose,LD50)分别为5.01×108、0.6×102CFU·mL-1,HF3株对昆明鼠和斑马鱼的LD50分别为3.24×108、2.34×103CFU·mL-1[4]。商品化猪链球菌2型灭活疫苗(HA9801株,铝胶佐剂)购自广东永顺生物制药股份有限公司(生产批号:2018003)。
1.1.2 攻毒菌株
BZ1株由本实验室分离自临床患急性败血症病猪,经鉴定为SS2强毒株,对昆明鼠和斑马鱼的LD50分别为3.31×108、0.9×102CFU·mL-1。国内强毒参考株HA9801、ZY05719对斑马鱼的LD50分别为3.42×105、3.58×105CFU·mL-1[5]。
1.1.3 试验动物
体质量18~22 g SPF级雌性昆明鼠购于安徽医科大学动物实验中心。
1.1.4 主要试剂
TMB显色液、脱脂奶粉购自上海碧云天生物技术有限公司;HRP标记的羊抗鼠IgG抗体购自美国博士德生物工程有限公司;细胞因子ELISA检测试剂盒(IL-4、IL-10、IFN-γ、TFN-β、MCP-1)购自美国RB公司;流式细胞抗体试剂盒购自美国BD公司;胰酪胨大豆酵母浸膏琼脂(TSA-YE)、纯化琼脂粉均购自绍兴天恒生物科技有限公司;甲醛溶液购自上海苏懿化学试剂有限公司。
1.2 方法
1.2.1 试验设计
取200只小鼠随机分为4组(编号为A、B、C、D),试验组(A-C)各40只,对照组(D)80只。A、B、C组分别颈部皮下注射HF2、HF3灭活疫苗和HA9801商品化灭活疫苗,每只注射0.2 mL,D组注射等体积生理盐水。免疫2次,间隔14 d。
1.2.2 血清中IgG抗体水平和细胞因子测定
小鼠一免14 d和二免7 d后,采集各组小鼠血清,参考文献[6]方法测定血清中IgG抗体水平,使用试剂盒检测小鼠血清中细胞因子(IL-4、IL-10、IFN-γ、TNF-β、MCP-1)含量。
1.2.3 外周血中T淋巴细胞亚群含量测定
于一免14 d和二免7 d后,经断尾处理采集小鼠外周血液,吸取100 μL抗凝血至2 mL无菌离心管,加入1.8 mL红细胞裂解液,充分混匀,在4 ℃冰箱中静置30 min,1 400 r·min-1离心5 min,去上清,加入1.8 mL PBS缓冲液(pH=7.2)反复吹洗,1 400 r·min-1离心10 s,弃去多余液体,保留约200~300 μL液体和沉淀于管底,吹打混匀,添加荧光标记的抗鼠CD3+、CD4+、CD8+T细胞单克隆抗体,将样品混匀后置4 ℃冰箱避光孵育30 min,用无菌PBS缓冲液(pH 7.2)洗涤孵育后的样品,2 500 r·min-1离心5 min,弃上清液,加入200~300 μL无菌PBS缓冲液(pH=7.2),吹打混匀。将各组细胞悬液转移至流式管,使用流式细胞仪进行检测。
1.2.4 小鼠攻毒试验
小鼠二免7 d后,A、B、C组各选10只小鼠作为试验组;D组随机抽取20只,平均分为2组,分别是攻毒对照组(D1组)和阴性对照组(D2组)。用BZ1株对试验组和攻毒对照组小鼠进行腹腔攻毒,攻毒剂量为4.29×109CFU.mL-1;阴性对照组注射等体积生理盐水。攻毒后,观察各组小鼠的精神状态、食欲及死亡情况,计算各组小鼠免疫保护率。攻毒7 d后,采集小鼠肺、肝、脾和肾脏样品,置于1.5 mL离心管中,按比例加无菌PBS缓冲液研磨。将组织悬液稀释至100、10-1、10-2后,分别取100 μL均匀涂布于TSA-YE固体培养基,37 ℃培养18 h,统计菌落数。攻毒7 d后,采集小鼠肺、肝、脾和肾脏样品置于福尔马林中进行固定和保存,送至安徽医科大学制作病理组织切片。
1.2.8 数据处理
使用SPSS 20.0软件对数据进行单因素方差分析,采用Graphpad Prime 7.0软件绘图。
2 结果与分析
2.1 血清中IgG抗体水平
由表1可知,一免14 d后,各试验组小鼠血清中IgG抗体效价分别为1∶6 400、1∶6 400、1∶12 800,A组和B组IgG抗体水平最高;二免7 d后,A、B、C组IgG抗体效价均有不同程度的上升,分别为1∶25 600、1∶12 800、1∶25 600,A组和C组IgG抗体水平最高。
2.2 血清中细胞因子含量
由图1可知,二免7 d后,各试验组小鼠血清中细胞因子含量均显著(P<0.05)高于对照组。HF2灭活疫苗免疫组(A组)小鼠血清中IL-4、IL-10含量显著(P<0.05)高于HF3灭活疫苗免疫组(B组)和HA9801商品化灭活疫苗免疫组(C组),且B组和C组间差异显著(P<0.05)。A组IFN-γ含量显著(P<0.05)高于B组,但与C组差异不显著(P>0.05)。C组TNF-β含量显著(P<0.05)高于A、B组,且A组和B组差异显著(P<0.05)。B组MCP-1含量显著(P<0.05)高于A、C组,但A组和C组差异不显著(P>0.05)。结果显示,各疫苗组均可诱导小鼠产生较高水平的细胞因子,其中HF2灭活疫苗诱导小鼠产生细胞因子(IL-4、IL-10、IFN-γ、TNF-β)的能力优于HF3灭活疫苗。
2.3 外周血中T淋巴细胞亚群含量
表1 小鼠血清中IgG抗体水平
Table 1 Detection of serum IgG antibody in mice

组别一免14 d后二免7 d后Group14 days after the firstimmunization 7 days after the secondimmunizationA1∶64001∶25600B1∶64001∶12800C1∶128001∶25600

不同柱上无相同小写字母的表示差异显著(P<0.05)。下同。 Bars marked without the same letters indicated significant (P<0.05) difference. The same as below.图1 小鼠血清中细胞因子含量Fig.1 Determination of serum cytokine levels after immunization of mice
由图2可知,一免14 d后,各试验组CD4+/CD3+、CD8+/CD3+均显著(P<0.05)高于对照组。二免7 d后,各试验组CD8+/CD3+呈上升趋势。其中,HA9801商品化灭活疫苗免疫组(C组)小鼠外周血中CD4+/CD3+显著(P<0.05)高于HF2灭活细胞免疫组(A组)和HF3灭活疫苗免疫组(B组),但A组和B组差异不显著(P>0.05);各试验组CD8+/CD3+呈上升趋势,但组间差异不显著(P>0.05)。
2.4 小鼠存活率
攻毒对照组(D1组)小鼠均死亡,阴性对照组(D2组)小鼠均存活。各试验组中,A、B、C组的免疫保护率均为100%。结果表明,HF2、HF3灭活疫苗和HA9801商品化灭活疫苗免疫小鼠均能产生良好的免疫保护力。
2.5 内脏组织荷菌数测定结果
由图3可知,各试验组小鼠组织器官的细菌定植量均显著(P<0.05)低于攻毒对照组(D1组)。HF2灭活疫苗免疫组(A组)小鼠肺脏的细菌定植量显著(P<0.05)低于HF3灭活疫苗免疫组(B组)和HA9801商品化灭活疫苗免疫组(C组)。各试验组肝脏、肾脏的细菌定植量差异不显著(P>0.05)。A、C组脾脏的细菌定植量均显著(P<0.05)低于B组。结果表明,灭活疫苗免疫组小鼠均能有效清除SS2在体内的定植。
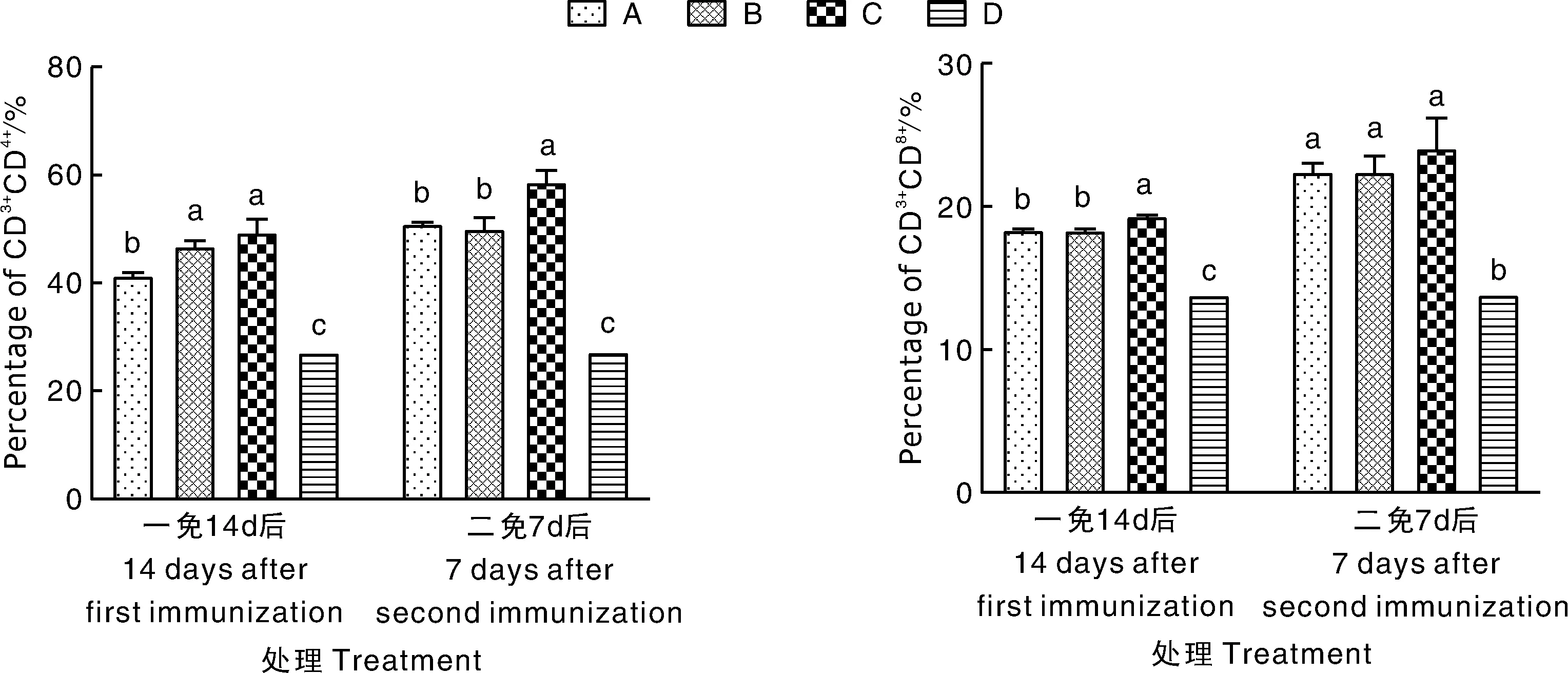
图2 小鼠外周血中CD4+、CD8+细胞亚群在总T细胞中所占百分比Fig.2 The percentage of CD4+, CD8+ T subsets in CD3+ T cells in peripheral blood of mice
2.6 病理组织学观察结果
各处理组小鼠组织病理学观察结果见图4-7。攻毒对照组(D1组)病变最为显著,表现为:肺脏充血,肺泡壁增厚,可见明显的炎症细胞浸润;肝脏整体结构异常,肝细胞排列紊乱,固缩坏死,肝窦间隙轻微增大;脾脏整体结构异常,红髓白髓分界不清,玻璃样变;肾小管上皮细胞脱落水肿,组织间轻微瘀血,大量炎症细胞浸润。阴性对照组(D2组)无明显病理变化。
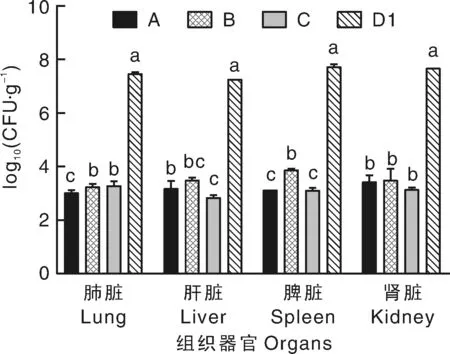
图3 攻毒小鼠各组织器官中的含菌量Fig.3 Bacterial survival in mouse blood and organs after infection

图4 各组小鼠肺脏病理组织学变化(HE染色,10×20)Fig.4 Pathological changes of lung in mice of each group (HE staining, 10×20)
各试验组中,A、B、C组的肺、肝、脾、肾脏均有不同程度的病变。其中,A组肺、肝脏均有轻微充血,肝、脾、肾脏均可见少量炎症细胞浸润;B组肺、肝、脾、肾脏均可见不同程度的炎症细胞浸润,肺脏轻微充血且肺泡壁轻微增厚,肾脏组织间轻微瘀血;C组肺、肝脏均轻微充血且有少量炎症细胞浸润,肺泡壁轻微增厚,肝脏窦间隙轻微增宽,脾脏可见明显中性粒细胞浸润,肾脏组织间质明显瘀血,少量肾小管上皮细胞脱落水肿。
3 讨论
猪链球菌病是一种重要的人畜共患病,而猪链球菌(SS)是引起该病最主要的病原。在SS的35个血清型中,SS2最为常见,流行最广且致病性最强。疫苗免疫接种是预防和控制猪链球菌病传播的有效措施。灭活疫苗具有研制周期短、安全可靠、易于保存等优点,因此在生产实际中使用最为广泛。
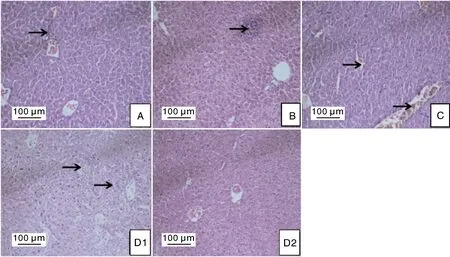
图5 各组小鼠肝脏病理组织学变化(HE染色,10×20)Fig.5 Pathological changes of liver in mice in each group (HE staining, 10×20)

图6 各组小鼠脾脏病理组织学变化(HE染色,10×20)Fig.6 Pathological changes of spleen in mice of each group (HE staining, 10×20)

图7 各组小鼠肾脏病理组织学变化(HE染色,10×20)Fig.7 Pathological changes of kidney in mice of each group (HE staining, 10×20)
灭活疫苗的免疫效果与其制苗菌株的免疫学特性密切相关。同一血清型的不同SS菌株生物学特性和致病力存在差异[7],因此用其制备的灭活疫苗免疫效果也存在差异,从而导致生产实际中免疫失败或免疫不确实。除此之外,灭活疫苗的免疫效果还与灭活佐剂类型有关[8]。本实验室自临床病例分离鉴定43株SS2,通过毒力因子鉴定、溶血性测定、昆明鼠及斑马鱼致病性试验筛选出6株强毒株,进一步通过菌株致病性试验、抗原性试验和稳定性试验,筛选出2株毒力强、抗原性好、遗传学上相对稳定的疫苗菌株(HF2、HF3),并对其培养条件进行了优化。为提高和保障制备的SS2灭活疫苗的良好抗原性,对疫苗菌株甲醛灭活条件和免疫佐剂进行优化、筛选,最终采用ISA 201 VG矿物油佐剂分别将其制备成灭活疫苗。为确定所研制的SS2灭活疫苗(HF2、HF3株,ISA 201 VG矿物油佐剂)的免疫效果,本研究将其与HA9801商品化灭活疫苗(HA9801株,铝胶佐剂)同步免疫小鼠,进行免疫效果评价。
体液免疫应答是清除细胞外病原体的有效机制之一,也是评价疫苗免疫效果的一个重要指标。IgG抗体是介导体液免疫的主要抗体,在机体抗感染过程中发挥主力作用[9-10]。本研究中,HF2灭活疫苗和HA9801商品化灭活疫苗免疫小鼠后产生的IgG抗体效价均为1∶25 600,显著高于HF3灭活疫苗,表明HF2灭活疫苗通过诱导IgG抗体来介导体液免疫的能力与HA9801商品化灭活疫苗相同,且优于HF3灭活疫苗。
细胞因子是一类具有多功能的蛋白分子,主要介导和调节免疫应答及炎症反应,因此细胞因子水平可反映机体的免疫功能状态[11]。Th细胞是产生细胞因子的重要细胞,根据其分泌性质及功能的差异,分为Th1和Th2细胞。Th1细胞可通过分泌IFN-γ、TNF-β等,介导细胞毒性T细胞、迟发型超敏反应T细胞的增殖分化,从而促进细胞免疫应答。Th2细胞分泌的IL-4、IL-10等细胞因子与B细胞增殖、分化及抗体生成有关,因此可增强机体体液免疫应答[12-14]。MCP-1可趋化单核巨噬细胞,既能介导体液免疫应答,也能促进细胞免疫应答[15]。本研究中,二免7 d后HF2灭活疫苗组的IL-4、IL-10含量均显著高于HA9801商品化灭活疫苗组,TNF-β含量显著低于HA9801商品化灭活疫苗组。此外,HF2灭活疫苗组的IL-4、IL-10、IFN-γ、TNF-β细胞因子水平均显著高于HF3灭活疫苗组,而MCP-1细胞因子水平显著低于HF3灭活疫苗组。结果表明,HF2、HF3灭活疫苗和HA9801商品化灭活疫苗在通过诱导不同细胞因子来介导机体免疫应答方面各有优势,单就HF2和HF3灭活疫苗而言,HF2灭活疫苗诱导Th1、Th2型免疫反应的能力优于HF3灭活疫苗。
T细胞是机体免疫应答的核心细胞,基于其白细胞分化抗原的不同分为CD4+和CD8+两大亚群[16]。CD4+T细胞可促进速发型变态反应,诱导辅助性T细胞和抑制性T细胞成熟,释放多种淋巴因子诱发炎症,排除抗原。CD8+T细胞可抑制B细胞产生抗体和其他T细胞分化增殖,从而调节免疫应答,也可在免疫效应阶段识别并溶解靶细胞[3]。有研究表明,CD4+、CD8+T细胞与细胞免疫水平呈正相关。本研究中,HF2和HF3灭活疫苗组的CD4+T细胞比率均显著低于HA9801商品化灭活疫苗组,而HF2与HF3灭活疫苗组间无显著性差异,且HF2、HF3灭活疫苗组和HA9801商品化灭活疫苗组的CD8+T细胞比率无显著性差异。结果表明,HA9801商品化灭活疫苗诱导速发型变态反应的能力优于HF2和HF3灭活疫苗,而HF2灭活疫苗与HF3灭活疫苗诱导细胞免疫应答的能力相同。
SS2是一种常见的猪呼吸道疾病病原体,常定植于扁桃体而不致病。当机体抵抗力下降时,SS2从扁桃体向周围淋巴组织扩散,进入血液,侵袭不同组织器官,进而引起炎症,使机体相应部位发生病变,造成损失或死亡。本研究对二免14 d后小鼠进行腹腔攻毒,通过测定攻毒保护率、组织荷菌数及分析病理组织学变化,评价SS2灭活疫苗的免疫保护效果。研究发现,HF2、HF3灭活疫苗和HA9801商品化灭活疫苗均能产生良好的免疫保护力。攻毒后,HF2灭活疫苗免疫组小鼠肺脏的细菌定植量显著低于HA9801商品化灭活疫苗免疫组,且肺、脾、肾脏的病理变化均较HA9801商品化灭活疫苗组轻微。此外,HF2灭活疫苗组小鼠肺、脾脏的组织荷菌数均显著低于HF3灭活疫苗组,且HF3灭活疫苗组小鼠的肺、肝、脾脏均有不同程度的炎症细胞浸润,肾脏组织轻微瘀血,较HF2灭活疫苗组的病理变化更明显。结果表明,HF2灭活疫苗清除肺脏SS2定植且保护各脏器不受侵害的能力优于HA9801商品化灭活疫苗和HF3灭活疫苗。
综合上述,由SS2(HF2株)制备的ISA 201 VG佐剂灭活疫苗免疫小鼠后不仅可产生较强的免疫应答,还可完全抵抗强毒株的攻击。本研究为猪链球菌病灭活疫苗的优化筛选及多联、多价疫苗的研制奠定了基础。

