纳米氢氧化铝佐剂的制备及其相关性质分析
马环,汪运洋,王晨,王珣,周第,陈兴,潘海龙
1.北京生物制品研究所有限责任公司,北京 102600;2.中国生物技术股份有限公司,北京 100020
1926年,GLENNY等证实,铝佐剂与抗原吸附后可显著增强抗原的免疫原性,至今铝佐剂仍为最广泛使用的佐剂[1]。铝佐剂主要由氢氧化铝、磷酸铝及铝几种形式构成,其中氢氧化铝佐剂应用最为广泛[2-3]。目前,氢氧化铝佐剂如何发挥其作用机制尚未完全明确,其中促进抗体产生的主要机制为储存库效应、促吞噬效应和免疫刺激效应。影响氢氧化铝佐剂免疫应答反应的因素包括抗原佐剂的吸附率、吸附强度、佐剂颗粒大小及均一性,佐剂的剂量及抗原的性质等[4],其中,佐剂颗粒大小可影响对抗原的提取、转运及与抗原相互作用[5-7]。与传统佐剂相比,纳米佐剂颗粒更小,比表面积更大,表面能更高、催化和吸附能力更强[8]。纳米铝佐剂在辅佐HBsAg方面优于传统佐剂,能快速激活和提高体液及细胞免疫水平。从免疫学观点来看,纳米佐剂均一性好,包裹或吸附的抗原颗粒可作为巨噬细胞和树突状细胞首选目标,可有效刺激免疫反应[9],且纳米佐剂可降低不良反应发生率。
商品化铝佐剂可采用氨水法或氢氧化钠法制备得到,其中氨水法反应较为温和,制备的铝佐剂均一性较好,但需增加去除氨根步骤,与氢氧化钠法相比,工艺操作更为复杂,但氢氧化钠法反应更为剧烈,过程控制难度大,且更易形成聚集性大颗粒[10]。因此,本研究通过优化现有佐剂配制工艺,增加过程控制手段,以获得纳米级佐剂,并对比不同粒径大小佐剂的质量属性,为纳米级氢氧化铝佐剂的生产及应用提供参考。
1 材料与方法
1.1 原液 白喉类毒素原液、破伤风类毒素原液及无细胞百日咳原液由北京生物制品研究所有限责任公司菌苗室提供。
1.2 主要试剂及仪器 结晶氯化铝和氢氧化钠购自国药集团化学试剂北京有限公司;激光粒度分析仪Mastersizer3000和Zetasizer Nano购自英国Malvern公司;FiveEasy Plus FE28pH计购自美国METTLER TOLEDO公司;牛血清白蛋白(BSA)购自国药集团化学试剂有限公司;UV-1990紫外可见分光光度计购自日本Shimadzu公司;电镜扫描由中科百测技术服务有限公司进行。
1.3 氢氧化铝佐剂的配制及后处理 配制40%的氢氧化钠溶液,提前预热至70℃左右,将80%的氯化铝溶液加入反应器内,搅拌均匀后维持反应温度为70℃并维持150~200 r/min搅拌转速,按照500 mL/min的速度向氯化铝溶液中滴加氢氧化钠溶液。过程取样检测pH值,当反应体系pH接近5.6左右时降低滴加速度,试验过程分别设定不同反应终点pH为5.8、6.2左右,其中低pH组(5.8左右)为Ⅰ组,高pH组(6.2左右)为Ⅱ组。到达反应终点时将反应器内液体取出20 L,分别放入两个立瓶内,其中一瓶(10 L)进行高温高压灭菌,灭菌温度121℃,灭菌时间30 min;另一瓶(10 L)室温放置。Ⅰ组所得佐剂样品编号为A、B、C,Ⅱ组所得佐剂样品编号为D、E、F。
1.4 无细胞百白破联合疫苗半成品配制 按照无细胞百白破联合疫苗配制工艺,将铝佐剂B、D稀释至一定浓度(成品氢氧化铝含量为1.3 mg/mL)后进行灭菌处理,降温至20℃左右吸附白喉类毒素原液、破伤风类毒素原液及无细胞百日咳原液,每种抗原加入后搅拌不少于10 min后加入下一种抗原,所有抗原加入后调节pH至6.2~6.5,并定容至所需体积,搅拌不少于10 min,分别得到半成品1和半成品2。
1.5 粒径分布检测 利用激光粒度分析仪测定颗粒粒径分布,通过控制添加样品的量,使遮光度达5%~15%之间后进行检测。其中Mastersizer3000用于微米级颗粒的测定,Zetasizer Nano用于纳米级颗粒的测定。
1.6 佐剂吸附率(BSA)及沉降率检测
1.6.1 吸附率 按照《中国药典》三部(2020版)方法进行。铝含量(1 mg)相同的佐剂分别吸附含量不同的BSA(0.8、1.6、4、8、12 mg)1 h,离心取上清,采用Lowry法测定上清中游离BSA含量,与加入的BSA总量比较,并计算不同佐剂对BSA的吸附率;除吸附率外,记录BSA加入量为12 mg经吸附后上清中游离BSA含量,即为上清蛋白含量;按照文献[11]方法测定吸附能力。
1.6.2 沉降率 在铝含量相同的情况下,加入氢氧化钠调节pH至6.2,将样品充分振摇均匀后取50 mL加至烧杯中,静置24 h,根据析出的上清液量,计算供试品的沉降率。
1.7 佐剂zeta电位的检测 在室温条件下取样品10 mL,pH调节至6.0,使用Zetasizer Nano检测zeta电位,每个样品检测3次后取平均值,为最终报告内zeta电位数据。
1.8 佐剂的扫描电镜观察 取佐剂B、D,经9 379×g离心30 min,弃上清,沉淀用纯化水继续洗涤2次,烘干后进行扫描电镜观察。
1.9 统计学分析 使用统计学软件Minitab,采用独立样本t检验对各组数据进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 佐剂的pH变化情况 室温放置24 h后,两组氢氧化铝佐剂的pH均有下降趋势,两组佐剂pH变化差异无统计学意义(t=0.57,P=0.624);121℃灭菌后,pH发生较为明显的变化,两组佐剂pH变化差异有统计学意义(t=7.34,P=0.018)。见表1。
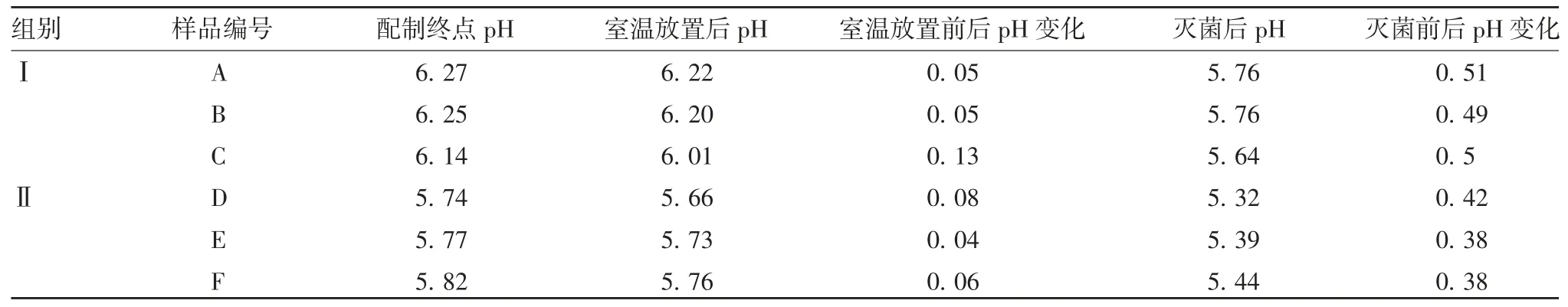
表1 两组佐剂室温放置及灭菌后的pH变化Tab.1 Changes of pH values of adjuvants in two groups after storage at room temperature and sterilization
2.2 佐剂的粒径分布 Ⅰ组氢氧化铝佐剂A、B、C的粒径分布在100~200 μm之间,而Ⅱ组氢氧化铝佐剂D、E、F的粒径分布在39~67 nm之间,二者差异有统计学意义(t=19.24,P=0.003)。见图1、图2和表2。

图1 Ⅰ组氢氧化铝佐剂A(A)、B(B)、C(C)的粒径分布Fig.1 Particle size distribution of aluminum hydroxide adjuvants A(A),B(B)and C(C)in groupⅠ
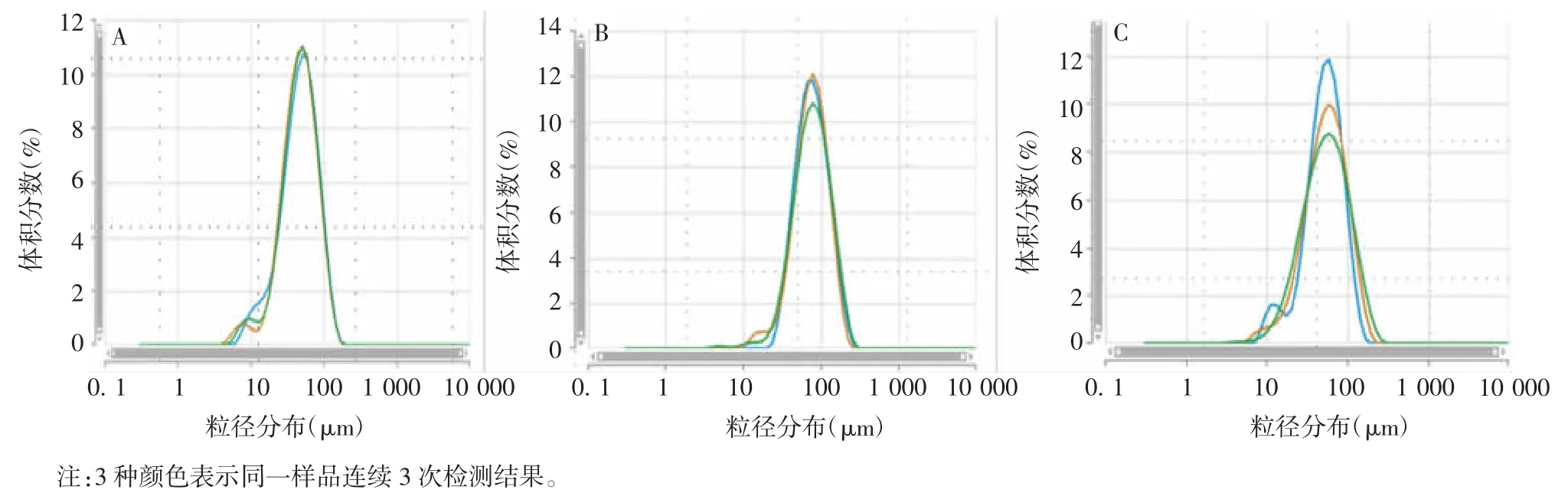
图2 Ⅱ组氢氧化铝佐剂D(A)、E(B)、F(C)的粒径分布Fig.2 Particle size distribution of aluminum hydroxide adjuvants D(A),E(B)and F(C)in groupⅡ
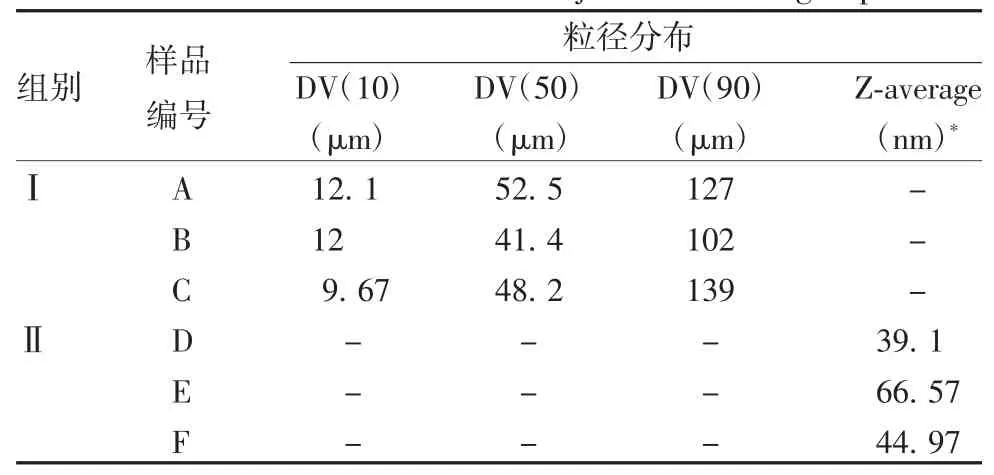
表2 两组佐剂的粒径分布Tab.2 Particle size distribution of adjuvants in two groups
2.3 佐剂的吸附率、沉降率及zeta电位 Ⅰ组与Ⅱ组氢氧化铝佐剂的吸附率、BSA的吸附能力和zeta电位差异均有统计学意义(t分别为6.01、5.17和4.24,P分别为0.027、0.035和0.024),且Ⅱ组佐剂不发生沉降。见表3。
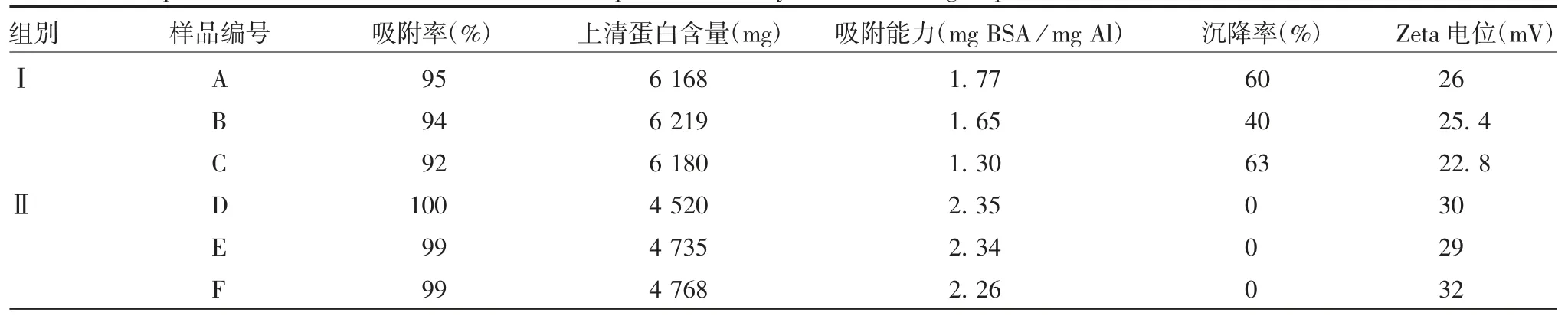
表3 两组佐剂吸附率、沉降率及zeta电位的比较Tab.3 Adsorption rate,sedimentation rate and zeta potential of adjuvants in two groups
2.4 佐剂的扫描电镜观察 两种佐剂的外观存在差异,佐剂D颗粒更小,数量更多,见图3。

图3 铝佐剂B(A)、D(B)的扫描电镜图Fig.3 Scanning electron microscopy of alum adjuvants B(A)and D(B)
2.5 吸附抗原后半成品的粒径分布 经检测,半成品1(铝佐剂B吸附)的DV(10)、DV(50)和DV(90)均大于半成品2(铝佐剂D吸附),见图4和表4。

表4 不同半成品的粒径分布(μm)Tab.4 Particle size distribution of various final bulks(μm)
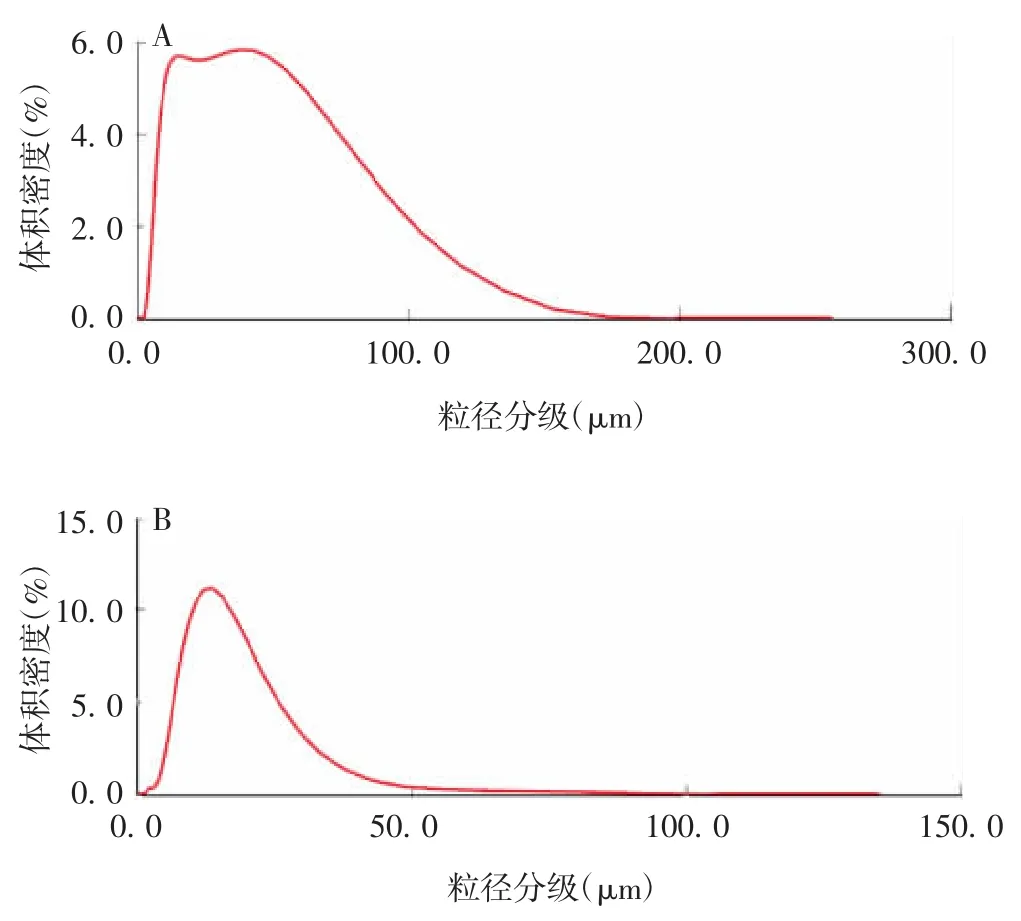
图4 半成品1(A)和2(B)的粒径分布Fig.4 Particle size distribution of final bulks 1(A)and 2(B)
3 讨论
本研究采用传统的氯化铝与氢氧化钠反应的方法制备氢氧化铝佐剂,表明在较低pH条件下配制,并采用立即灭菌的方式对所得产物进行处理可得到均一性较好的纳米佐剂。两种方法制备的佐剂理化性质差异有统计学意义(P<0.05),与高pH条件下配制的氢氧化铝佐剂相比,此方法所得佐剂具有较小的粒径分布、吸附能力更强、不发生沉降,且zeta电位更高,扫描电镜观察可见,两种方法制备的佐剂外观不同。对疫苗用佐剂来说,此种处理方式利于佐剂使用过程中微生物控制,且可增加佐剂的保存时限。按照原无细胞百白破联合疫苗配制工艺进行配制后检测粒径分布,两种佐剂吸附抗原后的粒径分布存在差异。
配制过程中,在pH达5.7之前(此时溶液中OH/Al约为2.93),变化趋势较为缓慢,胶体的外观及黏度均缓慢变化,达到拐点时,pH增长较快,黏度也急剧增加,且该体系的外观从悬浮液转变为凝胶状态。在pH曲线拐点之前,氢氧根与铝离子结合,因此对pH影响较小;达到拐点后,氢氧根以游离的形式存在于溶液中,因此氢氧化钠的加入对pH影响较大。
氢氧化铝为弱晶型的勃姆石,其具有无定型的表面结构。在氢氧化铝老化(室温放置)或高温高压灭菌过程中会有序化[10],使其转变成更稳定的多晶型物。主要原因是在老化或高温高压过程中水合铝化合物顺序的去质子化及脱水反应,反应过程如下[12]:Al(OH2)63+→Al(OH)(OH2)52++H+;2Al(OH)(OH2)52+→Al2(OH)2(OH2)84++H2O,上述反应使铝离子之前形成羟基桥,而羟基桥的形成可使无定型的氢氧化铝向结晶形式转换,同时生成质子,使pH降低。同时,如在铝盐溶液中继续加入碱液,Al2(OH)2(OH2)84+可生成不带电荷的中性Al(H2O)3(OH)3相互聚集而沉淀。
根据实验结果可知,室温放置约24 h及高温高压灭菌后,佐剂pH均降低,与室温放置相比,高温高压后pH降低更多,因此可推断,在高温高压过程中氢氧化铝的去质子化程度更高。同时,配制终点pH不同的佐剂相比,终点pH越高,pH变化值越小,原因可能是pH越高,反应体系中阴离子越多,阴离子可通过结合羟基铝化合物所带阳离子抑制去质子化反应,减少去质子化反应,进而减少pH的降低。
在分散体体系中的胶体颗粒可能生成聚合体而变成大颗粒沉淀,这种集合体如变成更紧密的聚合体,即为凝聚,形成凝聚的过程是不可逆的。当胶体颗粒接近时,颗粒之间的障碍主要来自于静电斥力,如颗粒有足够高的静电斥力,胶体相对稳定,它们之间不会生成凝集。在佐剂去质子化过程中,静电斥力增加,因此可得到更稳定的胶体颗粒,与此相对应的现象为纳米胶体不会出现沉降,且具有较高的zeta电位。
对APC提呈抗原来说,抗原颗粒大小是重要因素,且合适的颗粒大小为10 μm左右[13-14]。对用本研究制备的氢氧化铝佐剂吸附后的无细胞百白破联合疫苗进行粒径分布检测,使用纳米佐剂吸附后的粒径分布更为均一,颗粒大小(DV50)接近10 μm,更有利于APC提呈作用而诱导免疫应答反应。
根据ICHQ6B[15]要求,应采用适宜的技术进行生物技术产品和生物制品的质量特性分析(包括理化结构特征、生物学活性、免疫化学性质、纯度和杂质的鉴别)。疫苗一般含有多种成分,如蛋白质抗原、佐剂、赋形剂、稳定剂等,各成分之间可形成复杂的相互作用,因此,应将疫苗的特性、成分及结构分析作为质量控制的手段之一。无细胞百白破联合疫苗配制过程中多使用氢氧化铝佐剂作为吸附剂,现有无细胞百白破联合疫苗质量标准中包含效价、无菌检查、pH值、渗透压等项目,但未将粒径分布纳入质量控制指标。对于疫苗来说,可能影响安全性和有效性的关键因素可能包括蛋白质吸附及构象,吸附后产品的粒径分布和形态[3]。在疫苗生产过程中,成品粒径分布既可表明生产工艺的批间一致性,又可指示产品的稳定性,并可作为表征疫苗和疫苗成分的质量属性[16]。因此,后续可将粒径分布作为理化性质之一,纳入无细胞百白破联合疫苗质量控制范围内。

