氧化石墨烯对高羊茅根系生长和生理特性的影响
毛建越 赵树兰 多立安
摘 要:为探讨氧化石墨烯(GO)对植物的毒性效应,以高羊茅为试验材料,通过盆栽法研究土壤中添加不同比例GO(1%、2%、3%)对高羊茅根系生长(根生物量和根体积)及生理(丙二醛含量、保护酶活性、可溶性蛋白含量和根系活力)的影响。结果表明:2%和3% GO对高羊茅根生物量、根体积具有明显抑制作用;GO的添加提高了根系保护酶活性,增加了丙二醛含量,对高羊茅根系产生氧化胁迫损伤;根可溶性蛋白含量和根系活力随着GO比例的增加呈下降趋势,且在添加3%GO处理达到最小值。因此,添加比例高于2%的GO对高羊茅根系生长具有显著的抑制作用。
关键词:氧化石墨烯;高羊茅;生理特性;根系生长
中图分类号:Q949.71+4.2; Q948.116 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2020.02.005
Effects of Graphene Oxide on Growth and Physiological Characteristics of Roots of Festuca arundinacea
MAO Jianyue,ZHAO Shulan,DUO Li'an
(Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin 300387, China)
Abstract: In order to explore the toxic effects of graphene oxide (GO) on plants, F. arundinacea was used as the experimental material and the effects of different proportions of GO (1%, 2%, 3%) on the growth (biomass, root volume) and physiology (malonaldehyde, protective enzymes, soluble proteins, root vigor) of F. arundinacea roots were studied by pot method. The results showed that 2% and 3% GO significantly inhibited root biomass and volume of F. arundinacea. The addition of GO increased the activities of root protective enzymes and the contents of malondialdehyde, causing oxidative stress damage to the roots of F. arundinacea. Root soluble protein content and root activity decreased with the increase of GO ratio, and reached the minimum in the 3% GO treatment. Therefore, the addition of higher than 2% of GO inhibited root growth of F. arundinacea significantly.
Key words: graphene oxide; F. arundinacea; physiological characteristics; root growth
隨着纳米科技的发展,碳纳米材料的应用越来越广泛。碳纳米材料包括纳米碳管、纳米碳纤维、富勒烯、石墨烯等多种类型[1]。氧化石墨烯(Graphene Oxide,GO)是石墨烯的功能化形式,属于石墨烯的衍生物,其表面含有羟基、羧基和环氧基等含氧官能团[2]。除了具有石墨烯卓越的力学特性、热性能、光性能等特性以外,GO的各种官能团还使其表现出亲水性、阳离子吸附性、表面具大量活性位点等诸多独特的物理化学性质[3]。GO良好的性质使其在生物医学、水处理、能源存储等领域被广泛应用[4]。在生产与应用的过程中,氧化石墨烯不可避免地会释放到环境中,进而增加了其破坏生态环境的风险。
GO对植物的影响随植物种类、GO浓度、尺寸和处理时间等条件的不同而表现出不同的效应。有些研究认为,GO对植物有着正面的积极作用,其亲水特性和水传输特性可以促进菠菜和葱的发芽和生长[5];GO具有极高的比表面积使得自身有着很强的吸附性,在低浓度下可以降低Cd2+对玉米生长的抑制作用[6]。但更多的研究发现,GO对植物具有负面作用。GO微小的粒径可以使其容易进入植物细胞内,破坏细胞结构,诱导细胞内产生过氧化损伤[7]。GO甚至可以通过影响油菜基因的表达来调控其激素分泌,从而降低了油菜根长度与质量[8]。此外,GO也被发现可以放大砷对小麦的毒害作用[9],降低藻类的叶绿素含量与细胞数量[10]。植物是生态系统结构的重要组成部分和主要的初级生产者,其根系对生长发育具有重要作用,土壤中的污染物通过影响植物根系的生长而抑制地上生长,因此,通过研究GO对植物根系的影响来评估GO环境释放对植物的危害具有重要意义。
本文通过研究土壤中添加GO对高羊茅(Festuca arundinacea)根系生长和生理特性的影响,探讨GO对植物根系的毒性效应,旨在为碳纳米材料环境释放的风险评估提供依据和参考。
1 材料和方法
1.1 试验材料
试验用土壤为天津师范大学校园内0~20 cm的表层土壤。土壤pH值7.45,含盐量0.1%,有机质4.68%,全氮0.22%,全钾45.61%,有效磷22.03 mg·kg-1,饱和含水量0.56 mL·kg-1,容重0.87 g·cm-3。高羊茅种子购自江苏省盐城市震之越农产品经营部。GO购于苏州恒球石墨烯科技有限公司,为褐黄色粉末,平均厚度3.4~7.0 nm,片层直径10~50 μm,比表面积100~300 m2·g-1。
1.2 试验设计
根据GO的添加比例共设置4个处理:不添加GO(CK),添加1%、2%、3% GO。每个处理4次重复。选用直径7 cm、高8 cm的塑料花盆,每盆装入420 g土壤和一定比例的GO,混合均匀,每盆播种800粒高羊茅种子。植物为室内栽培,培养期间保证水分供应,使含水量保持在最大持水量的60%。光照为透入室内的自然光,在培养过程中定期调换花盆位置,以确保每个花盆处于一致的光照条件下。培养期间的环境温度为20~27 ℃,相对湿度为17%~54%。培养到120 d时收获植物地下部分,并进行各项指标的测定。
1.3 测定项目及方法
地下生物量的测定:将地下部分用水清洗干净并用滤纸吸取水分后,在108 ℃下杀青20 min,再于80 ℃下烘干至恒质量后称量。根系体积采用排水法测定。丙二醛(Malondialdehyde,MDA)含量测定采用硫代巴比妥酸氧化法[11]。过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法[12]。过氧化氢酶(Catalase,CAT)活性测定采用紫外分光光度法[13]。超氧化物歧化酶(Superoxide dismutase,SOD)活性测定采用氯化硝基四氮唑蓝光化还原法[14]。可溶性蛋白测定采用考马斯亮蓝法[15]。根系活力测定采用氯化三苯基四氮唑法[16]。
1.4 数据处理与统计分析
文中数据以“平均值±标准差”表示。采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),并采用Tukey法,在P<0.05水平进行数据差异显著性检验,采用Origin绘图。
2 结果与分析
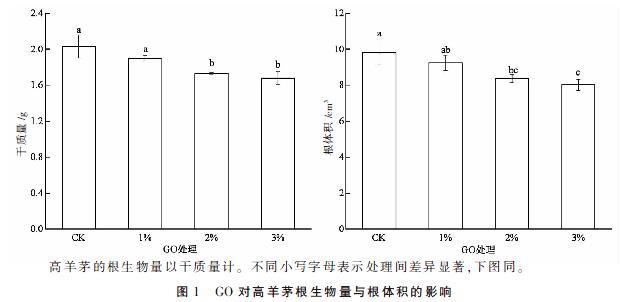
2.1 GO对高羊茅根生物量与根体积的影响
GO对高羊茅根生物量和根体积的影响如图1所示,随着GO浓度的增加,高羊茅的根生物量和根体积均呈下降趋势。与对照相比,添加2%与3% GO处理的根生物量分别下降了14.78%和17.24%,差异显著(P<0.05),添加1% GO处理略有下降但与对照差异不显著(P>0.05);添加2% 和3% GO处理的根体积分别下降了14.77%和18.33%,差异显著(P<0.05)。
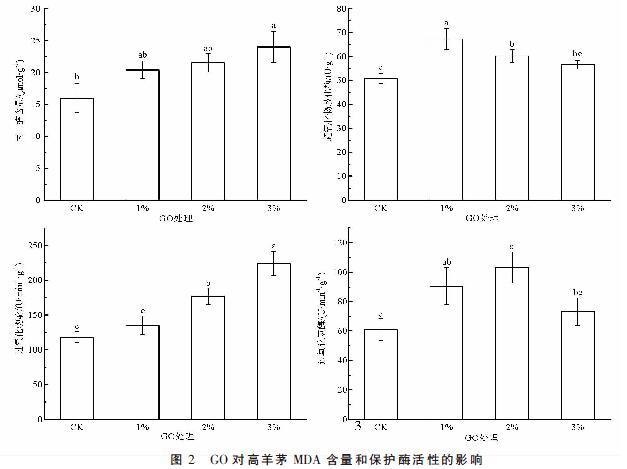
2.2 GO对高羊茅MDA含量与保护酶活性的影响
由图2可知,随GO比例增大,高羊茅根系丙二醛含量和过氧化物酶活性呈上升趋势,而超氧化物歧化酶和过氧化氢酶活性呈先升高后降低的趋势,分别在1%和2% GO处理达到最大值。与对照相比,3% GO处理丙二醛含量增加了50.13%,差异显著(P<0.05),添加1%和2% GO处理分别增加27.72%和34.48%,但差异不显著(P>0.05);1%和2% GO处理超氧化物歧化酶活性分别增加了32.79%和18.80%,差异显著(P<0.05),3% GO处理略有增加但与对照差异不显著(P>0.05);2%和3% GO處理过氧化物酶活性分别增加了49.30%和89.44%,差异显著(P<0.05),1% GO处理略有增加但与对照差异不显著(P>0.05);1%和2% GO处理过氧化氢酶活性分别增加了48.30%和68.91%,差异显著(P<0.05),3% GO处理略有增加但与对照差异不显著(P>0.05)。
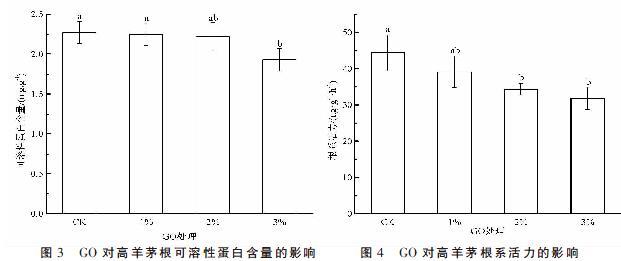
2.3 GO对高羊茅可溶性蛋白含量的影响
由图3可知,1%和2% GO处理与对照差异不显著(P>0.05),3% GO处理根可溶性蛋白含量较对照下降了14.98%,差异显著(P<0.05)。
2.4 GO对高羊茅根系活力的影响
GO对高羊茅根系活力的影响如图4所示,高羊茅的根系活力随GO比例增大呈下降趋势,1% GO处理较对照下降11.8%,但差异不显著(P>0.05),2%和3% GO处理根系活力较对照分别下降了22.67%和28.18%,差异显著(P<0.05)。
3 结论与讨论
根系是植物吸收养分的主要器官之一,它可以为地上组织运输水分和矿物质。同时,地上部分合成有机质并将其运输到根系,促进植物根系的形态建成。根系越发达,植物可以吸收的营养越多,以满足其自身的生长;根系越小,植物生长越慢[17]。根生物量与根体积是表征根系生长发育的重要指标。Chen等[7]研究表明,小麦可以通过根毛吸收GO,在高GO浓度下,小麦的根细胞受损。Hatami等[18]研究发现,丹参种子经GO处理后,幼苗的分生组织根细胞中存在GO,根部形成规则的孔隙结构;50 mg·L-1 GO处理种子后会使丹参发芽延迟且发芽率减低,根和茎长,茎鲜质量下降。Cheng等[8]研究发现25~100 mg·L-1 GO处理可缩短油菜根的长度,降低根鲜质量。Shen等[19]研究发现50 mg·L-1 GO处理抑制了水稻的根部生长,并且影响了水稻的侧根发育。本研究结果表明,与对照组相比,1% GO处理组高羊茅根生物量与根体积没有影响,当GO比例大于2%时,其对于根系生长具明显的抑制作用,与上述研究结果一致,即高浓度的GO处理,使植物根系生长受到显著抑制。
在植物体中,SOD、POD、CAT等被认为是使细胞免受氧化胁迫的保护酶,增加这些酶的活性是植物抵御氧化胁迫的生理反应[20]。MDA是反映细胞膜过氧化的重要生理指标[7]。Vochita等[21]的研究发现,500~2 000 mg·L-1 GO处理小麦时,能表现出剂量效应,500 mg·L-1 GO浓度时SOD、POD、CAT的活性达到最大值,在1 000和2 000 mg·L-1 GO浓度的酶活性降低。Li等[22]利用不同浓度(0.1,1和10 mg·L-1)的GO处理组织培养的苹果根系,发现GO处理组增加了苹果中SOD、POD、CAT的活性。Hatami等[18]研究也获得相似结果,GO使得保护酶活性升高,MDA含量增高,进而产生氧化胁迫。本试验结果表明,SOD和CAT活性呈先升后降趋势,在1%和2% GO处理显著增大;POD活性呈升高趋势,2%和3% GO处理显著升高;MDA也呈升高趋势。MDA的增加表明植物的抗氧化系统不足以保护组织免受氧化损伤,膜脂过氧化诱导的细胞结构和细胞功能损伤会导致营养状况不平衡和植物生长异常。通过MDA含量与SOD、POD、CAT活性的变化可知,GO对植物的毒害作用主要是GO在植物中累积并产生氧化胁迫,进而使植物生长受到抑制。此外,膜脂过氧化还会进一步导致DNA断裂,对植物产生遗传水平的影响[23]。
蛋白質作为植物生长中的关键物质,在植物代谢调节中具有重要作用,也是作为生理生化特性的重要指标之一,植物根系是活跃的吸收器官和合成器官,根的生长情况和活力水平直接影响地上部的营养状况及产量水平,根系活力就是一个表征植物根系的量。Gao等[17]研究发现,当幼苗暴露于浓度大于20 mg·L-1的GO时,小麦根部微管蛋白浓度明显受到抑制;GO具有表面效应,进入根部对根部细胞造成损伤进而破坏,影响其可溶性蛋白含量。还有研究表明,GO通过影响脱落酸(ABA)和生长素IAA的生物合成和浓度,进而影响油菜根生长[8]。Shen等[19]也证明GO可以影响IAA含量以调节水稻根系生长。Xie等[24]研究发现GO和ABA显著影响幼苗的形态特性和内源性植物激素含量,ABA处理与GO联合使用可使油菜根系活力迅速降低。本研究结果表明,与对照组相比,3% GO处理高羊茅可溶性蛋白显著减少(P<0.05);2%和3% GO处理根系活力显著降低。
综上所述,GO释放到土壤后,通过影响高羊茅根保护酶活性使根系产生膜脂过氧化损伤;GO使高羊茅根系可溶性蛋白含量降低,并抑制根系活力进而影响高羊茅的代谢,GO胁迫最终表现在植物根系生长受到抑制,且其对高羊茅根系生长抑制具有剂量效应。因此,应注意GO环境释放可能带来新的污染与风险。
参考文献:
[1]涂磊,段林,陈威.碳纳米材料的环境行为及其对环境中污染物迁移归趋的影响[J].应用生态学报,2009,2(1):205-212.
[2]DIMIEV A M, TOUR J M. Mechanism of graphene oxide formation[J]. ACS nano, 2014, 8(3): 3060-3068.
[3]NAVARRO D A, KAH M, LOSIC D, et al. Mineralisation and release of 14C-graphene oxide (GO) in soils[J]. Chemosphere,
2020, 238: 124558.
[4]SMITH A T, LACHANCE A M, ZENG S S, et al. Synthesis, properties, and applications of graphene oxide/reduced graphene oxide and their nanocomposites[J]. Nano materials science, 2019, 1(1): 31-47.
[5]HE Y J, HU R R, ZHONG Y J, et al. Graphene oxide as a water transporter promoting germination of plants in soil[J]. Nano research, 2018, 11: 1928-1937.
[6]YIN L Y, WANG Z, WANG S G, et al. Effects of graphene oxide and/or Cd2+ on seed germination, seedling growth, and uptake to Cd2+ in solution culture[J]. Water, air & soil pollution, 2018, 229(5):151.
[7]CHEN L Y, WANG C L, LI H L, et al. Bioaccumulation and toxicity of 13C-skeleton labeled graphene oxide in wheat[J]. Environmental science & technology, 2017, 51(17): 10146-10153.
[8]CHENG F, LIU Y F, LU G Y, et al. Graphene oxide modulates root growth of Brassica napus L. and regulates ABA and IAA concentration[J]. Journal of plant physiology, 2016, 193: 57-63.
[9]HU X G, KANG J, LU K C, et al. Graphene oxide amplifies the phytotoxicity of arsenic in wheat[J]. Scientific reports, 2014, 4: 6122.
[10]HAZEEM L J, BOUOUDINA M, DEWAILLY E, et al. Toxicity effect of graphene oxide on growth and photosynthetic pigment of the marine alga Picochlorum sp. during different growth stages[J]. Environmental science and pollution research, 2017, 24(4): 4144-4152.
[11]SUNDAR D, PERIANAYAGUY B, REDDY A R. Localization of antioxidant enzymes in the cellular compartments of sorghum leaves[J]. Plant growth regulation, 2004, 44(2):157-163.

