重复经颅磁刺激治疗抑郁症的神经机制探索及疗效预测研究进展
张斌杰,刘 健,刘梦婉,燕宝玉,郑凯中,卢虹冰,李宝娟*
(1.空军军医大学军事生物医学工程学系医学信息技术教研室,西安710032;2.西安电子科技大学生命科学技术学院,西安710126;3.空军军医大学网络中心,西安710032)
0 引言
抑郁症是一种严重精神疾病,是全球第二大致残原因[1],该病具有发病率高、危害性大等特点。根据世界卫生组织统计,全球范围内所有年龄段中超过2.64 亿人患有抑郁症,该病个体和社会负担重并且自杀率高[2]。全球范围内每年约有80 万人自杀[3],其中50%发生在抑郁期[4],抑郁症患者死于自杀的可能性是普通人群的20 倍[5]。在我国,自杀事件中抑郁症患者大约占40%[6]。
抗抑郁药物治疗是目前最常用的治疗抑郁症的临床手段。然而,临床药物治疗通常存在起效慢、复燃率高等问题。临床研究表明,只有28%~33%的患者对药物治疗反应良好[7],大量患者因不耐受或无反应而无法得到充分治疗[8-9]。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)和电休克疗法(electroconvulsive therapy,ECT)则为抑郁症患者提供了新的治疗方案。然而,ECT 需要麻醉并且患者在治疗后通常伴有严重的副作用,如认知障碍等[10]。rTMS 是一种由美国食品药品监督管理局(Food and Drug Administration,FDA)批准的新的非侵入性抗抑郁技术,其优点包括:安全、不需要全身麻醉,可采用机器人导航技术对刺激线圈进行精准定位[11],所需能量较少[12],刺激针对性强、起效快,副作用小且不产生惊厥(详见表1[13-17])。有研究表示,rTMS 抗抑郁疗效反应率可达58%,缓解率为37.1%[18],与抗抑郁药物联合使用能加速临床反应[19]。

表1 ECT 与rTMS 治疗抑郁症对比
大量文献表明,抑郁症可能是一种脑网络异常疾病[20-23],该病涉及独特的脑活动及异常脑连接[24-28]。研究表明,大脑默认网络(default mode network,DMN)、认知控制网络(cognitive control network,CCN)、凸显网络(salience network,SN)等与抑郁症的神经机制密切相关[29-31]。基于此,Li 等[32]在前期工作中提出了抑郁症的脑网络模型,指出该病主要与情感网络(affective network,AN)、奖赏网络(reward network,RN)、DMN 和CCN 等网络异常相关。
虽然rTMS 在抑郁症的临床治疗中表现良好,但其抗抑郁神经机制仍不清楚。有研究显示,rTMS 可能通过改善上述抑郁症中异常的脑网络达到抗抑郁的效果[33]。因此,本文从神经影像研究角度出发,对rTMS 抗抑郁机制探索的相关研究进行综述。同时,由于不同的患者对rTMS 治疗反应迥异,本文又进一步分析可有效预测rTMS 疗效的脑连接模式。
1 rTMS 抗抑郁的神经机制
1.1 脑活动方面
大量的临床和动物实验显示,rTMS 治疗抑郁症时产生的高频磁刺激一般作用于大脑左侧背外侧前额叶皮质(dorsolateral prefrontal cortex,DLPFC),并在皮层下组织传递,进而调节受刺激区及其他脑区的兴奋程度[34-37],或造成神经可塑性的改变,达到治疗抑郁症的目的[38-40]。Li 等[35]对经过DLPFC-rTMS 治疗的抑郁症患者进行研究发现,在刺激靶点及相连接的边缘脑区活动增加,表明DLPFC-rTMS 确实可以影响与抑郁症相关的多个脑区。Vink 等[36]利用rTMS分别刺激DLPFC 和初级运动皮层(primary motor cortex,M1),发现刺激DLPFC 可以诱导亚属前扣带皮层(subgenual anterior cingulate cortex,sgACC)的激活,而刺激M1 sgACC 处检测不到活动信号,该研究证明rTMS 诱导的信号能够直接或间接传播到sgACC。基于以上rTMS 诱导的脑活动,Fox 等[33]发现rTMS磁刺激可通过神经传导进而改变DLPFC、DMN 和sgACC 等多个脑区的活动,且这些活动变化与抑郁症改善有关。
1.2 功能连接方面
研究表明,rTMS 可能通过改变与抑郁症神经机制密切相关的AN、DMN、CCN 等网络的异常连接发挥作用[40-41]。DMN 的连接异常与患者过度的思维反刍相关,并与疾病持续时间和治疗反应强弱有关[42];AN 的连接异常与患者持续的负性情绪及疾病严重程度相关[43];CCN 的连接异常与患者认知控制能力下降及情绪失调相关[44-45]。
rTMS 可对DMN 的功能连接进行有效调节。Liston 等[46]对17 例抑郁症患者进行了5 周DLPFCrTMS 治疗,参照健康对照组,对治疗前后DMN 和CCN 之间的功能连接进行了测量比较。发现在治疗前,抑郁症患者DMN 内的功能连接强度增强,而CCN内的功能连接强度降低;治疗后,DMN的异常连接恢复正常,而CCN 中的连接却无显著变化。此外,该研究还发现rTMS 可诱导DLPFC 与DMN之间产生负连接。此证据表明,rTMS 可以选择性地调节相关神经网络连接,改善抑郁症状,如图1 所示。
同时,rTMS 也可对AN 尤其是该网络的重要节点sgACC 的连接进行调节。研究显示,经过DMPFCrTMS 处理后,症状减轻的重性抑郁症(major depressive disorder,MDD)患者sgACC 与尾状核之间功能连接强度降低,且背内侧前额叶皮层(dorsomedial prefrontal cortex,DMPFC)与丘脑之间的功能连接强度升高[47],sgACC 与DMN 的功能连接强度也存在降低情况[46],表示rTMS 能够对sgACC 的功能连接进行有效调节。Taylor 等[48]发现症状显著改善的患者,sgACC 与AN、DMN、额顶叶网络(fronto-parietal network,FPN)的连接强度均下降,而治疗无反应的患者对应区域的连接保持不变,这再次印证了上述结论。Fox 等[33]表示rTMS 的抗抑郁效果与左侧DLPFC 及sgACC 之间负性功能连接相关,并提示rTMS 可能是通过对sgACC 及其他边缘区域活动进行远程抑制发挥抗抑郁机制。此外,Philip 等[49]发现rTMS 治疗后,MDD 患者症状的减轻程度和sgACC 与DMN、DLPFC 及岛叶之间的连接强度降低程度以及和海马与SN 之间的连接强度降低程度相关。同时研究结果显示sgACC、DMN 和SN 参与了rTMS 抗抑郁神经机制作用,且可作为rTMS 抗抑郁疗效预测因子。
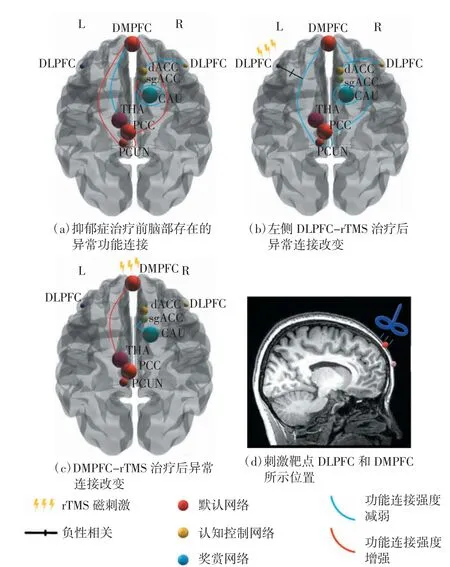
图1 rTMS 抗抑郁机制原理图
另外,rTMS 对RN 的功能连接异常也有显著的调节作用。前期研究显示,与健康对照组相比,抑郁症患者的边缘额纹状体(RN 的重要节点)的功能连接强度降低[50-52],反映了负责调节认知控制的神经回路的紊乱与快感缺乏、奖赏处理和情绪调节缺陷相关[53]。Avissar 等[54]发现,对患者进行DLPFC-rTMS 治疗后,抑郁症患者的左侧DLPFC 与纹状体的功能连接强度降低。左侧DLPFC 和纹状体之间较高的基线功能连接强度能够预测rTMS 的治疗效果,而且基线功能连接强度越高,治疗效果越好,表明DLPFC 与纹状体之间的功能连接改变可能构成了rTMS 的抗抑郁机制,同时提示部分脑区的基线功能连接可以作为rTMS 治疗抑郁症效果的预测因子。另外,Kang等[55]指出,与伪刺激组相比,真刺激组DLPFC 和左尾状核之间的连接强度显著降低,并表示DLPFC-左尾状核连接强度降低预示了抑郁症状的改善。
1.3 结构方面
从介观角度来看,抑郁症患者经过rTMS 治疗,除大脑的功能连接改善之外,还存在大脑解剖结构的变化。
一项研究利用形态测量法(voxel-based morphometry,VBM)观察到健康对照组在进行5 d rTMS 治疗前后,其颞上皮层的结构存在差异,初步证实rTMS 可以引起脑解剖结构的改变[56],同时推测结构水平的神经可塑性可能参与了持续的精神类疾病临床改善。另一项研究指出,rTMS 治疗导致结构改变的脑区分别集中在左前扣带皮层(anterior cingulate cortex,ACC)、左岛叶、左颞上回和右角回,其中,抑郁症严重程度的改善与rTMS 引起的ACC 区域的灰质体积(gray matter volume,GMV)增加有关[57]。一项探究rTMS 的抗抑郁反应是否与海马、杏仁核体积随时间变化有关的实验发现,与基线相比,随着时间推移,抗抑郁效果提高与左杏仁核体积的显著增加有关,治疗无反应者的左海马体积显著下降,初步证实rTMS 可能促进神经再生或神经可塑性有利改变[58]。
从大脑微观结构角度来看,rTMS 治疗会导致神经可塑性的变化。有研究发现,大脑神经可塑性受损可能是导致认知能力下降和严重抑郁的病理机制之一[59],同时指出rTMS 可诱发神经可塑性的变化。也有研究发现,抗抑郁治疗手段可通过诱导神经可塑性变化对认知和情感等网络的结构变化进行调节,使连接异常的神经网络功能恢复[60],同时提出假说:抗抑郁治疗并不直接改善抑郁症状,而是重新激活神经可塑性状态,改善相关异常网络从而减轻症状。类似的动物临床证据表明,rTMS 可以促进大鼠的神经再生,此机制可能与rTMS 的抗抑郁作用有关[61]。对此,有研究者进一步探究发现,皮质体积的增加主要由于突触和胶质的增加[62],这为进一步研究rTMS 可以通过间接影响突触可塑性从而改变大脑结构提供了依据。Kuhn 等[63]也曾指出,与健康对照组相比,MDD 长时程增强效应(long-term potentiation,LTP)可塑性明显减弱。rTMS 治疗后,有缓解者的神经可塑性呈现恢复现象,而无缓解者则表现出持续的缺陷,同时确认了神经可塑性受损是抑郁症的潜在病理机制之一。
另外,一般认为,rTMS 可能是通过调节脑源性神经营养因子(brain-derived neurotropic factor,BDNF)的释放改变大脑可塑性从而治疗抑郁症,其中,BDNF 与神经元的存活能力和活动相关的突触可塑性功能有关[64]。目前来看,rTMS 已经被证明可以增大抑郁症患者血清中的BDNF 浓度[65],通过影响3-甲基-4-羟基苯乙二醇(3-Methoxy-4-Hydroxyphenylglycol,MHPG)和BDNF 的释放来改善抑郁症。经rTMS 处理后,血浆MHPG 水平明显降低,血浆中MHPG 的浓度变化与汉密尔顿抑郁量表(Hamilton depression rating scale,HAMD)中的躁动评分变化呈显著负相关,对rTMS 有疗效的被试中BDNF 的浓度显著增高,这与既往报道的不同抗抑郁治疗手段可增加BDNF 浓度的报道结论一致[66]。
由此可见,rTMS 治疗引起刺激靶点(DLPFC)与周边网络的功能连接变化,主要表现在调节DLPFC与sgACC 及DMN 之间的功能连接治疗抑郁症。同时,rTMS 也可对患者大脑结构进行有效调节,主要表现在ACC 体积的改变,更重要的是杏仁核体积的增加以及海马体积的减少。微观的研究验证了rTMS在很大程度上对神经可塑性存在直接或间接的诱导作用,从而导致神经皮质再生或对异常网络调节,进而治疗抑郁症[60,63]。
2 rTMS 抗抑郁疗效预测
临床试验发现,rTMS 对不同被试治疗时效果差异较大[67-69]。如果能在基线状态时对疗效进行精准预测,将能为改善治疗效果提供重要支持。多年来,功能磁共振成像(functional magnetic resonance imaging,fMRI)技术发展迅速,为确定具有预测rTMS 抗抑郁疗效能力的脑连接模式提供了技术支持[70]。
2.1 rTMS 治疗效果相关的脑连接模式
由以上研究可得,AN 的重要节点sgACC 的脑连接变化与rTMS 治疗效果密切相关。目前的研究表明,rTMS 使得异常功能网络(包括DMN、CCN 和SN)内部和之间的连接正常化从而治疗抑郁症相关功能障碍。Anderson 等[71]的研究显示,MDD 患者rTMS 治疗前存在异常基线功能连接——亚属扣带回(subgenual cingulate gyrus,SCG)除了与SN 节点之间的连接强度较低之外,与DMN 节点以及CCN 节点之间的连接强度均较高,这3 条异常连接均有望成为rTMS抗抑郁疗效的预测因子。Liston 等[46]也曾报道亚属扣带皮层的基线连接能够预测抑郁症临床改善。Salomons 等[47]利用DMPFC-rTMS 治疗MDD,发现皮质节点之间(如DMPFC 与sgACC 之间以及sgACC 与DLPFC 之间)较高的基线连接,皮质与丘脑之间(如DMPFC 与背内侧丘脑之间)、皮质与纹状体之间(如DMPFC 与核状体之间)和皮质与边缘皮质之间(即sgACC 与杏仁核之间以及sgACC 与海马体之间)较低的基线连接都与较好的治疗效果有关。Philip 等[49]的发现印证了上述猜测:SCG 的重要节点sgACC 与DMN 之间负连接越多,预测临床改善越好;杏仁核与腹内侧前额叶皮层(ventromedial prefrontal cortex,VMPFC)之间正连接越多,临床改善越好。Weigand等[72]同样证实了rTMS 刺激的皮质区域与SCG 之间的功能连接可以预测rTMS 抗抑郁效果,但有所不同的是,亚属连接可以预测抑郁症认知和情感症状的改善,但不能预测躯体症状的改善。
除此之外,Baeken 等[73]在基线和rTMS 治疗结束时对患者进行静息态功能磁共振扫描,发现高频经颅磁刺激(high frequency-repetitive transcranial magnetic stimulation,HF-rTMS)有反应者的sgACC 与左上内侧前额叶皮层部分区域之间的功能连接呈显著负相关,无反应者的sgACC 区域的静息态功能连接(resting-state functional connectivity,rsFC)没有明显变化[73]。此外研究者认为,HF-rTMS 治疗对难治性抑郁症(treatment-resistant depression,TRD)患者的sgACC相关网络起到快速调节作用[73-74]。
同时,RN 的功能连接可能也与rTMS 治疗效果相关。Du 等[75]通过对早期有反应者和无反应者的DLPFC 与左侧伏隔核(nucleus accumbens,NAcc)之间的功能连接进行测量和比较,以及对功能连接变化与抑郁和焦虑症状改善程度之间做相关分析,发现与无反应者相比,有反应者的DLPFC 和左侧NAcc之间存在负性连接强度增加,抑郁、焦虑症状改善与rTMS 刺激的DLPFC 与NAcc 之间的功能连接强度改变呈显著负相关,首次证实左侧DLPFC 和左侧NAcc 之间的功能连接可以预测rTMS 疗效。
另外,网络内与网络间的功能连接强度差异可能与rTMS 治疗效果相关。为此,有研究人员探究了rTMS 的抗抑郁治疗反应与网络隔离度(network segregation)(网络内功能连接与网络间功能连接相对强度的度量)之间的关系,重点对DMN、SN、FPN 和记忆检索网络(memory retrieval network,MRN)进行网络隔离分析,发现SN 的功能连接的基线分离度越高,可显著预测抑郁症症状改善越多,这一发现突出了网络隔离分析在治疗抑郁症中的重要性,再次印证了大脑的相关基线连接可以作为rTMS 抗抑郁疗效的预测因子[76]。
2.2 基于机器学习技术的rTMS 抗抑郁疗效预测
在基线状态下抑郁症患者AN、DMN、RN、CCN等网络内部及网络间的连接与治疗效果密切相关。以此为基础,近年来,研究者开始利用这些具有疗效预测能力的脑连接模式,借助于机器学习技术,探索精确预测rTMS 抗抑郁疗效的方法。
有研究者基于DMN 和AN 网络基线功能连接、血氧水平依赖(blood oxygen level dependent,BOLD)强度和临床特征(量表得分)这些预测因子,通过支持向量机(support vector machine,SVM)训练分类器来预测个体的治疗反应,预测疗效(有反应/无反应)准确率达到85%,特异性为92%[77]。Drysdale 等[78]基于最能区别有反应者和无反应者的连接性特征作为预测因子,包括DMPFC(刺激靶点)和左侧杏仁核、左侧DLPFC、双侧眶额叶皮质和后扣带回皮质之间的异常连接,同时结合已排除了聚类模糊数据的抑郁症亚型特征,利用SVM 和留一法交叉验证使得治疗反应的分类准确率达到92.6%。Ge 等[79]根据治疗反应与在基线时测量的sgACC 与右侧DLPFC 之间较低的功能连接以及前喙扣带皮质(rostral anterior cingulate cortex,rACC)与左外侧顶叶皮层之间较高的功能连接相关,分别以这2 种脑连接模式作为特征对治疗有反应者及治疗无反应者进行分类,准确率分别达到84%和76%(治疗结束)、88%和81%(治疗结束3 个月随访后)。由此得出,抑郁症患者的脑连接模式可预测rTMS 的治疗反应,且rTMS 治疗后相关脑回路活动的纵向变化与抑郁症患者的治疗反应有关。
3 结语
作为世界上最主要的精神障碍类疾病之一,抑郁症是导致后天残疾率增高的主要原因,因此需要对这种疾病以及rTMS 抗抑郁机制有更深入的了解。目前来看,rTMS 可通过调节患者的异常脑连接来发挥抗抑郁作用,患者在基线状态下的脑连接模式可以有效预测其治疗效果。为进一步提高rTMS 的临床效果,目前尚待解决的问题如下:(1)rTMS 最优刺激靶点无法确定;(2)rTMS 抗抑郁神经环路的刺激传导和内部机制还不清楚;(3)rTMS 抗抑郁疗效与频率强度及治疗时间长短之间的关系还不明确;(4)rTMS 治疗效果的预测以及患者的适用性还不明晰。未来可以在脑部刺激靶点选取、rTMS 刺激信号传导、rTMS 参数设置以及采用多模式影像预测因子进行疗效预测等方面采取更好的研究方法,以便更深入地揭示rTMS 抗抑郁神经机制,从而为改善治疗效果提供依据。

