济宁青山羊kiss-1基因多态性及与主要繁殖性状关系分析
张 圆 刘晓艺 高一珊 康贝宁 李增宽 赵 勇 闵令江*
(①山东省济宁市畜牧业发展中心 272000 ②青岛农业大学动物科技学院 山东 青岛)
济宁青山羊,其被毛由黑白二色毛混成青色,其角、蹄、唇为青色,前膝为黑色,有“四青一黑”的特征[1],是优良的羔皮用山羊品种,2006年该品种被农业部列入《国家级畜禽遗传资源保护名录》。性成熟早较、繁殖率高,肉质优良、风味独特,适应性强,能够生产花纹独特的青猾子皮,使得济宁青山羊享誉国内外。作为中国本土品种,济宁青山羊4月龄即可配种,母羊常年发情,发情周期17.5±0.5d,妊娠期147±2.5d,羔羊成活率95%[2]。羔羊初生重1.3±0.1kg,60日龄断奶重4.0±0.5kg。山羊一般而言产单羔居多,济宁青山羊年产两胎或两年产三胎,一胎多羔,平均产羔率293.65%[3],但其个体较小、生长速度较慢,在大规模生产中不占优势。研究其生长发育的过程,提高生长速度,降低生产成本,将成为今后育种的主要目标。
1996年,kiss-1基因在Lee等研究人黑素瘤细胞转移能力时,首次被发现其具有抑制肿瘤细胞转移的能力,ss表示抑制物序列,ki取其发源地一种有名巧克力的前缀[4]。之后人们对其研究,确定其定位于人类染色体lq32-q41,由4个外显子和3个内含子组成[5]。由4个外显子最终翻译成得1个亲水蛋白,由145个氨基酸组成,称为“kisspeptins”[6],又称“亲吻素”。之后的研究发现kiss-1能够抑制多种恶性肿瘤的转移,肿瘤的转移与预后与kiss-1的表达下调关系密切[7]。此外有研究表明下丘脑中的kiss-1/GPR54(受体)信号通路作为参与调控哺乳动物青春期发育与性成熟的关键内分泌因子—“亲吻素”[8],kisspeptins能够激活GnRh的神经元,在HPG轴(下丘脑-垂体-性腺轴)上游,通过调节促性腺激素的分泌,刺激垂体门脉系统分泌LH、FSH对性腺产生作用,刺激雌激素、睾酮等激素合成,进而促使卵子和精子的产生,使个体具备生殖能力,在生殖中起关键调控作用[9]。作为一种性早熟品种,济宁青山羊在60~90d左右就能达到性成熟,进入初情期,平均窝产活仔数为2.91只。在农业生产中,缩短母羊达到性成熟的时间,有益于降低后备母羊的生产成本。因此研究济宁青山羊中kiss-1基因与多种繁殖性状之间的关联,不论是从其通过kiss-1/GPR54信号通路刺激促性腺激素的释放进而调控一系列生殖激素从而影响动物的性成熟,还是通过kiss-1/GPR54系统调节胰岛素的分泌进而影响动物的消化和吸收从而影响其营养水平来调控动物的发情,都对于山羊在农业生产中的实际生产效益具有重要意义。
通过本研究,希望能够发现kiss-1不用基因型在济宁青山羊中与产羔数和初次配种时间的关系,从分子角度加快育种进程,以期在实际生产中,通过DNA检测,为不同基因型的山羊制定专属的培育计划,实现生产效益的最优化。
1 材料与方法
1.1 材料
1.1.1 试验动物 本试验用到的济宁青山羊来自山东嘉祥济宁青山羊原种场,通过查阅系谱档案材料,选取具有产羔数记载的年龄、体重基本一致的济宁青山羊26只(连续3胎均产3羔或3羔以上的14只,连续3胎均产单羔的12只),屠宰后取子宫组织冻存样品。
1.1.2 仪器 金属浴(南京沃拓仪器设备有限公司)、高速离心机(eppendorf生命科学公司)、旋涡混匀器(购自ⅠKA)、超微量分光光度计(购自上海美谷分子仪器有限公司)、Quick Drop超微量分光光度计(购自MOLECuLAR DEVⅠCES)、PCR扩增仪(购自北京友华照钦医疗器械有限公司)、DYY-8C型电泳仪(购自北京市六一仪器厂)、凝胶成像系统(购自北京科创锐新生物科技有限公司)。
1.1.3 试剂 DNA提取试剂盒购于生工生物工程(上海)有限公司,内含Buffer ACL、蛋白酶K、Buffer CL、吸附柱、CW1 Solution、CW2 Solution、CE Buffer等;PCR引物对(100 uMol)购于生工生物工程(上海)有限公司、2×Phanta Max Master Mix购于南京诺唯赞医疗科技有限公司,内含Taq Plus DNA Polymerase、dNTP以及优化的缓冲体系、2000的Marker购于BBⅠ、10×DNA loading Buffer购于Solarbio、DNA电泳缓冲液(50TAE)、核酸染料(4S Green Plus)、无菌超纯水、BⅠOWEST REG MLAR AGAROSE(琼脂糖干粉)、限制性内切酶Acl Ⅰ、10×NEBuffer购于NEB公司、液氮、无水乙醇、超纯水。
1.2 方法
1.2.1 DNA的提取和浓度测定 试验方法中的基因组DNA提取和测定等技术均参照《分子克隆实验指南》。
1.2.2 引物设计 根据曹贵铃等的研究,济宁青山羊kiss-1基因在296位点发生了由鸟嘌呤碱基到胞嘧啶碱基的突变,从而能够被限制性内切酶识别[10]。针对目的基因kiss-1的内含子1和内含子2总长为1101bp的目的片段设计引物,进行PCR扩增,上下游引物由生工生物工程公司提供,引物序列为:上游引物:CTTGTGTTTGCTGGACAGT CT,下游引物:TGCTCCCTCCCAACCTTCTTT。
1.2.3 PCR扩增 PCR扩增选用20μl体系,选用0.5 ml离心管,按下表加入各试剂,试剂都放在冰上。

表1 PCR反应体系 (μl)
将按顺序加入各种试剂的PCR管在漩涡震荡仪上震荡摇匀后,在小型离心机上离心后放入PCR仪。本次PCR扩增共30个循环,时间共计1h53min。扩增后的PCR产物,于冰上放置,等待进行下一步的电泳检测。此外,多次实验尝试表明冷冻保存后的PCR产物会发生降解,琼脂糖凝胶电泳检测效果不佳。

表2 PCR扩增条件(PCR程序设置) (℃、min)
1.2.4 PCR产物检测 4.2%琼脂糖凝胶电泳分析,电压120V,电流100mA,电泳20min,凝胶成像系统成像。
1.2.5 限制性酶切 限制性酶切采取15μl的酶切体系,见表3。加样顺序为超纯水→10×Buffer→PCR产物→限制性内切酶。从-20℃冰柜中取出限制性内切酶后要立马放入事先准备好的冰盒。将按顺序加好试剂的离心管在离心机上1000rpm离心10s,取出后放入37℃水浴锅加热15min后进行琼脂糖凝胶电泳,取5μl的酶切产物与1μl的10×Loading Buffer混合后加入点样孔,第一个孔中加入6μl 2000的Marker作为对照电泳步骤同上述PCR产物的电泳。

表3 酶切反应体系 (μl)
1.2.6 统计方法 通过EXCEL、SPSS.23单因素ANOVA分析实验数据,分析了不同基因型与窝平均产羔数、初配时间、初生重、子宫角长的关系,发现只与窝平均产羔数和初配时间有显著影响。卡方值χ2=Ʃ[(O-E)2/E]。
2 结果及分析
2.1 PCR扩增结果
通过上述20μl PCR体系以及生工生物公司提供的kiss-1基因的上下游引物,对1101bp的目的片段展开PCR扩增,通过2%琼脂糖凝胶电泳检测扩增产物,图一PCR扩增产物特异性明显,与预期结果相符,可以用于后续实验。
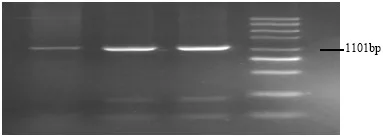
图1 kiss-1PCR扩增产物电泳条带
2.2 酶切结果
研究表明,kiss-1基因在296位点发生了由G→C的突变,由此可以被限制性内切酶识别并在特定位点切割。由此预期实验结果为CC、CG、GG三种基因型的条带。电泳结果显示,在本次实验所选用的26个济宁青山羊样本中,kiss-1基因存在CC型(突变纯合子)、CG型(杂合子)、GG型(野生型)三种基因型,其中CC型片段长度为805+296bp,CG型片段长度为1101+805+296bp。GG型片段长度为1101bp。

图2 山羊kiss-1G296C位点的PCR-RFLP分析
2.3 基因型频率和基因频率
由PCR-RFLP后确定此次试验中的26个样本的基因型如下表所示。其中,基因型为CC型的个体有3个,基因型为CG型的个体有7个,剩余的16个样本均未发生突变,基因型为GG型。计算可得CC型基因型频率为11.54%,CG型基因型频率为26.92%,GG型基因型频率为61.54%。等位基因频率:C为25%(p),G为75%(q)。
2.4 哈代温伯格平衡
经卡方检验,χ2=2.0646<χ20.05(1),P>0.05差异不明显,此群体在kiss-1 296位点符合哈代温伯格平衡定律。
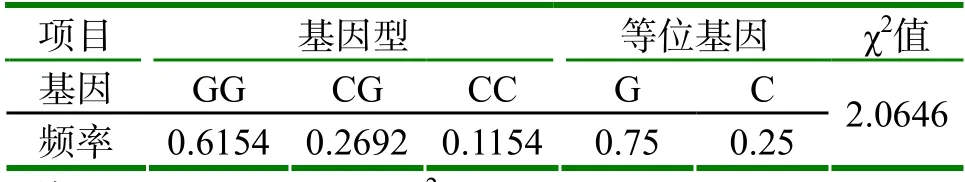
表4 济宁青山羊的基因型频率、基因频率及卡方
2.5 基因型与窝平均产羔数的关系
通过使用SPSS.23进行单因素方差ANOVA分析,得如下表结果,kiss-1该位点对济宁青山羊窝平均产羔数有显著影响(P<0.05)。GG型母羊的窝平均产羔数比CC型多0.85只(P<0.05),GG型与CG型、CG型与CC型之间(P>0.05)在窝平均产羔数上的差异不明显。

表5 不同基因型窝平均产羔数间的比较 (只)
2.6 基因型与初配时间的关系
SPSS.23单因素方差ANOVA分析结果显示,kiss-1基因296位点对初配时间有显著影响(P<0.05)。GG型母羊从出生后到第一次配种的相隔时间比CG型母羊早58.49天(P<0.05),GG型比CC型早77.40d(P<0.05),CG型与CC型从出生后到第一次配种相隔时间之间的差异不显著(P>0.05)。

表6 不同基因型初配时间的比较 (d)
3 讨论
3.1 目的基因的PCR扩增
在本次实验中,PCR作为连接DNA和酶切过程关键的一环,百转曲折。从更换PCR体系到降低退火温度,笔者尝试了多种操作,最终也只是做出了特异性较好的条带,疑似出现非特异性扩增。同时,在多次实验中发现,无论是放在-20℃还是4℃,实验证明,产物都会发生一定的降解,致使电泳条带不明显,因此PCR产物最好当天跑完当天用。
3.2 kiss-1基因在繁殖上的研究
本研究初步表明,GG型个体在生产中,第一次配种时间比其他两种基因型个体要早,这对于指导生产实践有重要意义。从分子育种角度,及早确定山羊基因型,便可在实际生产中极大实现早发现、早配种、早受益。对于人而言,青春期的启动与遗传、营养、环境密切相关[11]。同理,动物性成熟的时间开始的早晚除了受激素的信号通路调控,也与动物的营养状况有着密切联系。吴琰的实验结果表明,kiss-1/GPR54系统在山羊初情期的消化系统中广泛表达,但该系统在初生时胰脏内并不表达,这种基因表达的时效性说明kiss-1/GPR54系统通过协同作用,利用调节胰岛素的分泌来调节动物的营养状况来保障动物的发情[12]。张冬梅等人的研究表明kisspeptin、kiss-1r在复发性流产患者绒毛组织中呈低表达,与复发性流产有关[13]。丁赫等人的研究表明随着初情期的启动,kiss-1基因启动子区甲基化水平显著降低,尤其是在启动子区-501位点降低最明显,并且kiss-1基因mRNA表达量随着初情期的启动显著升高[14]。师美红等人的研究发现,小鼠卵巢中次级卵泡中kisspeptin表达减少可能使卵泡对FSH的敏感性降低,使血清中FSH水平升高,因募集大量的初级卵泡,最终使卵母细胞耗竭[15]。kiss-1基因在小尾寒羊卵泡期下丘脑和松果体的表达量均显著高于黄体期,提示其可能在小尾寒羊黄体期到卵泡期发情状态转换中起促进作用[16]。上述研究都进一步表明,kiss-1基因在动物生长、发育、繁殖方面有着不可或缺的作用。
综上所述,基于kiss-1基因对济宁青山羊生长、发情的调控,可以初步认为,没有发生突变的GG型济宁青山羊短性成熟期、高产仔数方面占有优势,这与kiss-1基因促进发情、生长发育的生物功能相契合。在曹贵铃等的研究中,选取了198只济宁青山羊作为样本,最后发现CC型母羊的产羔数比其他两种基因型的母羊的产羔数要多,这与本次研究结果不符,推测可能的原因是此次选取的样本含量太少有关,接下来可以扩大样本容量,进行进一步试验。
4 小结
试验结果表明kiss-1该位点对济宁青山羊窝平均产羔数和初配时间有显著影响(P<0.05),但由于群体有限,其用于分子标记辅助选择的可靠性还有待于扩展样本进一步验证。

